老年类风湿性关节炎患者的血清细胞因子的表达及意义
张如峰, 包淑贞
(青海省西宁市第一人民医院 风湿血液科, 青海 西宁, 810000)
类风湿性关节炎(RA)是一类慢性、进行性的自身免疫系统疾病,其主要特点为侵蚀性的滑膜炎症[1], 主要临床症状包括多关节的晨僵、肿痛、功能障碍,且病变常呈对称性的发展。目前RA的发病机制还未完全明了,有研究[2]表明多种炎性细胞因子共同参与了RA的起病、进展过程。本研究探讨了RA患者血清中的IL-33及其他细胞因子如IL-4、IL-13等的表达变化。
1 资料与方法
1.1 研究对象
分析2012年4月—2014年2月在本院风湿血液科接受住院治疗的老年RA患者的临床资料,并选取相似年龄段的正常体检者作为对照组。入组标准:年龄45~70周岁,根据ACR(美国风湿病学院)和EILAR(欧洲风湿病防治联合会)2009年制定的RA评分及分类标准明确诊断为 RA[3], 且评分≥6分的患者;初诊RA患者。排除标准:非初诊患者,既往有甲氨蝶呤等抗风湿药物、激素、生物制剂等药物使用史;伴有强直性脊柱炎、系统红斑狼疮等其他自身免疫系统类疾病;伴有恶性肿瘤、严重感染者。RA评分的内容包括受累关节数量、血清RF或CCP抗体水平、滑膜炎的持续时间以及C-反应蛋白、血沉水平[4]。
1.2 研究方法
比较入组RA患者(观察组)和正常对照组的一般临床信息、炎性因子包括IL-33、IL-13、IL-4及IFN-γ的水平、RA评分与炎性因子的相关性。血液相关指标均由清晨、空腹抽取外周静脉血所测得,炎性因子的测定均采用ELISA法测定,研究所用的ELISA试剂盒均由RD生物公司提供。使用的仪器包括全自动定量酶标仪(型号AUSTRIA HT-2, 奥地利产)、台式离心机(型号LDZ5-2, 购自北京医用离心机厂)、电热恒温水温箱(型号HH-501, 成都赛可隆机械公司提供)、低温冰箱(型号MDF-382E,日本三洋生产)。
1.3 统计学方法
2 结 果
2.1 一般资料
本研究共纳入研究对象70例,其中观察组RA患者38例,对照组32例。表1为两组受试者详细资料,可见两组受试者的基线资料之间并无显著差异(P均>0.05)。
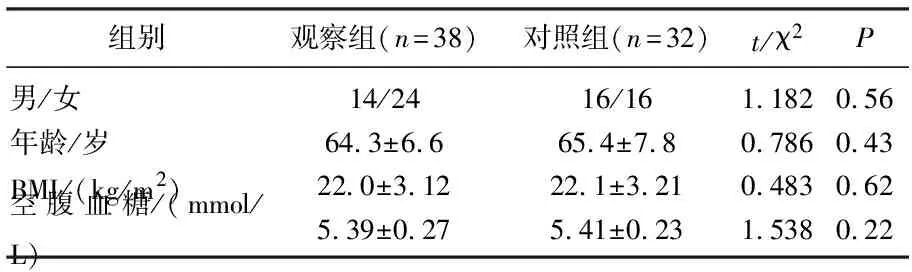
表1 观察组与对照组临床资料对比
2.2 观察组与对照组的炎性因子对比
2组的炎性因子详细数据见表2。可见观察组患者的IL-33(t=3.765,P<0.01)、IL-13(t=4.124,P<0.01)、IL-4(t=3.687,P<0.01)及IFN-γ(t=2.228,P<0.01)水平均显著高于正常对照组。
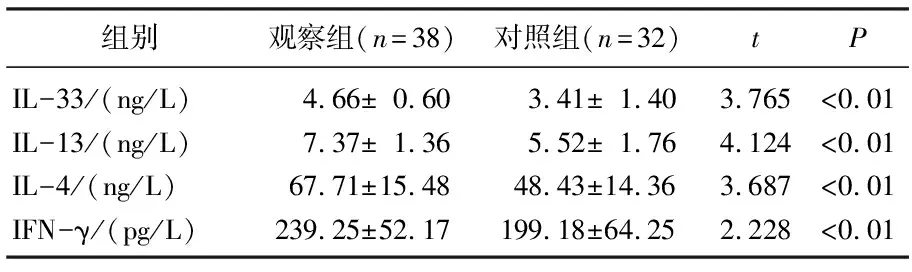
表2 观察组与对照组炎性因子对比
2.3 RA评分与炎性因子相关性
入组的38例RA患者的RA评分与炎性因子IL-33、IL-13、IL-4及IFN-γ的相关性分析结果见表3。可见RA评分与IL-33(r=0.366,P=0.024)、IL-13(r=0.461,P=0.012)均呈线性正相关,而与IL-4、IFN-γ并无线性关系。
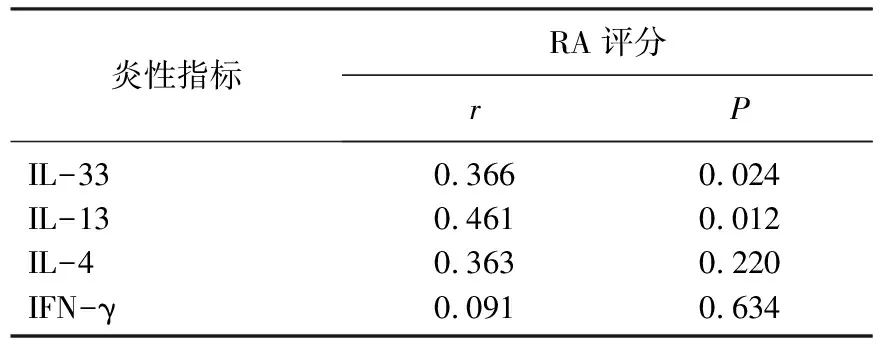
表3 RA评分与炎性因子相关性
3 讨 论
类风湿性关节炎(RA)是一类慢性、进行性的自身免疫系统疾病,其主要临床症状可表现为手、足、腕、膝、髋的多个大、小关节的炎症,且常呈双侧、对称性的发病,临床可伴有贫血、发热、皮下结节等其他关节之外的症状[5]。RA在任何年龄均可发病,好发于45~55岁的中年人群,女性发病率明显高于男性。绝大多数患者的发病过程缓慢、不断进展、破坏,若未能给予及时而有效的治疗,可导致患者关节畸形、受损,可致残疾,对于患者的生活质量有着严重的影响。而部分患者发病过程急,进展迅猛,很快即致残甚至致死[6]。目前RA的发病机制还未完全弄清楚,学者考虑遗传,感染, T、B淋巴细胞,及滑膜细胞等均参与了RA的发病。大量研究[7]表明,很多细胞因子也参与了RA的具体发病过程,部分细胞因子如IL-1、IL-6、TNF-α等参与了RA的促炎过程,其他细胞因子则与RA的抗炎过程相关,如IL-4、IL-10等,这些研究结果均表明细胞因子与RA的发病过程之间有着重要的联系。IL-33属IL-1家族成员,是一种最近发现的前炎症的细胞因子, IL-1家族中的各类细胞因子在炎症过程急免疫调节中有着重要的意义,而主要作用途径是通过诱导趋化因子、细胞因子、基质蛋白酶及氧化亚氮合酶等不同的效应蛋白来实现[8]。IL-1在体内主要促进了Th1型的反应,而IL-33则是主要对Th2细胞因子进行诱导, IL-33结合其受体后,通过对下游信号分子如IL-1相关蛋白激酶1、髓样分化因子88等因子的募集,从而激活下游的MAPK(有丝分裂原激活蛋白激酶)及NF-kB, 进而对Th2反应相关的如IL-4、IL-13等的细胞因子转录、发挥相应生物学的功能的调节[9]。IL-33作为一种多功能的蛋白质,其不仅可以作为一种可溶性的细胞因子,对Th2免疫反应进行调节,促使肥大细胞分泌前炎症因子,还能够作为核因子,而对转录起抑制性作用。近些年来还有研究证实,IL-33对于Th1和Th2都有着相应的调节作用。因IL-33的靶细胞是各类免疫细胞,故而对于各种自身免疫系统疾病、全身慢性炎症等均有着一定的调控作用[9-11]。IL-4是一类特征性的Th2细胞因子,其主要产自Th2细胞,是诱导Th2进行分化的十分重要的细胞因子,其能抑制机体的细胞免疫,而同时促进其体液免疫,使得机体的特异性、非特异性的杀伤功能均有所增强[12-13]。IL-4水平表达的升高能够促进Th0细胞向Th2分化,而抑制Th1细胞的形成及Th1细胞因子的分泌。IL-13也是由活化Th2细胞产生,具有抗炎和免疫调节的作用,其生物学活性大致与IL-4类似[14]。IL-13可对单核-巨噬细胞分泌细胞因子如IL-8、IL-6等起抑制作用,还能够促使人B细胞进行增殖、分化和分泌相关免疫球蛋白。T细胞、嗜碱性粒细胞以及肥大细胞都能分泌IL-13。IFN-γ是Th1细胞因子,在诱导Th1活化中起关键性的作用,其主要来源为活化的NK、T细胞,其能抑制Th0向Th2细胞转化,并对Th2型因子的合成、分泌有着抑制作用,还能提高机体对抗原的呈递功能,增强NK细胞活性,增强单核-巨噬细胞功能,在炎症过程中有着非常重要的意义[15]。本研究比较了RA患者与正常对照组两者血清炎性因子IL-33、IL-13、IL-4及IFN-γ的表达,结果显示RA患者血清几种炎性因子的水平均显著高于对照组,这与国内外相关研究结果相一致,提示了炎性因子介导的炎症过程参与了RA的发病过程。本研究还对RA患者进行了RA评分与炎性因子之间的相关性进行了探讨,结果证实RA评分与IL-33和IL-13均有着线性的正相关关系,提示了RA患者血清的某些炎性因子水平(如本研究中的IL-33和IL-13)与RA病情进展程度有着明显的相关性,一定程度上血清炎性因子的测定能够评估RA的病情进展程度[16]。
[1] Wang L, Jia J, Wang C, et al. Inhibition of synovitis and joint destruction by a new single domain antibody specific for cyclophilin A in two different mouse models of rheumatoid arthritis[J]. Arthritis Res Ther, 2013, 15(6): R208.
[2] de Brouwer S J, van Middendorp H, Kraaimaat F W, et al. Immune responses to stress after stress management training in patients with rheumatoid arthritis[J]. Arthritis Res Ther, 2013, 15(6): R200.
[3] Davis J M, Knutson K L, Strausbauch M A, et al. Immune response profiling in early rheumatoid arthritis: discovery of a novel interaction of treatment response with viral immunity[J]. Arthritis Res Ther, 2013, 15(6): R199.
[4] Kontny E, Prochorec-Sobieszek M. Articular adipose tissue resident macrophages in rheumatoid arthritis patients: potential contribution to local abnormalities[J]. Rheumatology (Oxford), 2013, 52(12): 2158.
[5] Hu F, Shi L, Mu R, et al. Hypoxia-inducible factor-1alpha and interleukin 33 form a regulatory circuit to perpetuate the inflammation in rheumatoid arthritis[J]. PLoS One, 2013, 8(8): e72650.
[6] Tanaka Y, Hirata S, Saleem B, et al. Discontinuation of biologics in patients with rheumatoid arthritis[J]. Clin Exp Rheumatol, 2013,31(4 Suppl 78): S22.
[7] Pieper J, Herrath J, Raghavan S, et al. CTLA4-Ig (abatacept) therapy modulates T cell effector functions in autoantibody-positive rheumatoid arthritis patients[J]. BMC Immunol, 2013, 14: 34.
[8] Hampel U, Sesselmann S, Iserovich P, et al. Chemokine and cytokine levels in osteoarthritis and rheumatoid arthritis synovial fluid[J]. J Immunol Methods, 2013, 396(1/2): 134.
[9] Yoon H Y, Lee E G, Lee H, et al. Kaempferol inhibits IL-1beta-induced proliferation of rheumatoid arthritis synovial fibroblasts and the production of COX-2, PGE2 and MMPs[J]. Int J Mol Med, 2013, 32(4): 971.
[10] 余斌, 陈辉强, 卢昌怀, 等. 关节内注射不同浓度臭氧对类风湿关节炎大鼠TNF-α、TNFRI和TNFRⅡ的影响[J]. 南方医科大学学报, 2011, 31(6): 1055.
[11] 陶惠红, 陆建民, 褚亚萍, 等. 类风湿关节炎社区防治路径的可行性分析[J]. 中华全科医学, 2011, 9(12): 1912.
[12] 任洁, 李娟, 冯知涛, 等. 类风湿关节炎患者滑液NK-22细胞对成纤维样滑膜细胞增殖的影响及其机制研究[J]. 南方医科大学学报, 2011, 31(4): 661.
[13] 吉恒东, 邹红梅, 路峰, 等. 类风湿关节炎心脏损害36例临床分析[J]. 中华全科医学, 2011, 9(3): 403.
[14] Fukuda K, Miura Y, Maeda T, et al. Decoy receptor 3 regulates the expression of various genes in rheumatoid arthritis synovial fibroblasts[J]. Int J Mol Med, 2013, 32(4): 910.
[15] Azizi G, Jadidi-Niaragh F, Mirshafiey A. Th17 Cells in Immunopathogenesis and treatment of rheumatoid arthritis[J]. Int J Rheum Dis, 2013, 16(3): 243.
[16] Gumus P, Buduneli E, Biyikoglu B, et al. Gingival crevicular fluid and serum levels of APRIL, BAFF and TNF-alpha in rheumatoid arthritis and osteoporosis patients with periodontal disease[J]. Arch Oral Biol, 2013, 58(10): 1302.

