胸腺素β4通过提高Akt磷酸化促进局灶脑缺血/再灌注大鼠大脑皮质eNOS和CD31表达
庞月珊,罗 勇,谢宸宸,李 满,陈瑞芳,汶海琪
(重庆医科大学附属第一医院神经内科重庆市神经病学重点实验室,重庆400016)
脑缺血后尽快促进血管、神经再生,是治疗缺血性脑血管病减少后遗症的关键。胸腺素β4(thymosinβ4,Tβ4)有多种功能如促进血管再生、神经轴突修复、抑制炎性反应[1-3]等,已经成为脑血管病研究焦点之一。用Tβ4多肽治疗脑卒中和脑外伤大鼠,均发现血管密度在损伤区大脑皮质增加,但其机制还不十分清楚[1-2]。体外研究证实 Tβ4多肽能通过PI3K/Akt/eNOS通路促进内皮祖细胞增殖迁移和抑制内皮组细胞衰老[4]。eNOS是脑缺血后骨髓源性内皮祖细胞强烈的动员剂,能通过SDF-1/CXCR4轴促进内皮祖细胞动员到局部参与血管新生[5]。脑卒中后腹腔注射Tβ4多肽是否也能通过PI3K/Akt通路提高eNOS表达,引起下游SDF-1/CXCR4变化促进血管再生?本实验采用PI3K/Akt通路抑制剂LY294002,以期阐明Tβ4促进局灶脑缺血/再灌注损伤大鼠大脑皮质血管再生情况及其机制。
1 材料与方法
1.1 主要试剂
Akt和p-Akt多克隆抗体(Cell Signaling公司),CD31多克隆抗体(Santa Cruz公司),eNOS多克隆抗体(Immunoway公司),LY294002(Sigma公司),总RNA提取试剂盒、反转录试剂盒和荧光定量扩增试剂盒(Takara公司),DAB显色试剂盒(北京中杉公司),磷酸化蛋白提取试剂盒(凯基生物公司),Tβ4定制多肽(GL Biochem Ltd公司),β-action单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG(碧云天公司)、SP试剂盒及其他相关试剂(北京鼎国公司)。
1.2 模型制备
参照文献[6]介绍经验,制作大鼠右侧大脑中动脉局灶脑缺血/再灌注模型。清洁级雄性SD大鼠120只,体质量230~260 g由重庆医科大学实验动物中心提供[SCXK(渝)2012-0001]。大鼠分为假手术组(S组6只)、模型组(IR组36只)、Tβ4治疗组(IRT组36只)、Tβ4+LY294002组(IRTL组6只)、0.9%氯化钠注射液组(IRN组36只)。IR、IRN和IRT组缺血2 h后分为再灌注3和7 d两个亚组。将冻干粉状的Tβ4多肽用0.9%氯化钠注射液稀释为1 mg/mL。IRT、IRTL组再灌注24 h腹腔注射 Tβ4,6 mg/kg,每 3 天 1 次[1]。IRN 组用同样方法注射等体积0.9%氯化钠注射液。LY294002以25 mmol/L的终浓度在IRTL组大鼠缺血2 h后从侧脑室给药(前囟后0.8 mm、矢状缝旁开1.5 mm,先用锥颅器钻开颅骨,25 μL微量注射器定位,进针3.5 mm),缓慢给药5 μL,速度为1 μL/min,留针 5 min 后取出。
1.3 神经功能学评分
采用Zea Longa 5分制对所有大鼠行神经功能学评分[7]:无任何症状,0分;提尾悬挂时左前肢屈曲,1分;行走时向左侧转圈,2分;行走时向左侧倾倒,3分;意识丧失,不能自发行走,4分。评分人对动物分组情况未知。
1.4 免疫组化
将切片常规脱蜡至水,3%H2O2室温孵育30 min,1%Trition室温孵育30 min,枸橼酸修复液中微波修复21 min,血清封闭 30 min,加一抗(Tβ4、CD31抗体稀释比均为1∶50),同时滴加PBS代替一抗作为阴性对照,4℃过夜。37℃复温1 h,加二抗,37℃孵育30 min,加辣根酶标记链霉卵白素工作液,37℃孵育30 min,DAB显色,苏木素复染、去蓝、返蓝、脱水、透明和封片。
1.5 Western blot半定量检测
取缺血区大脑皮质100 mg,按凯基磷酸化蛋白提取试剂盒说明书提取磷酸化蛋白。BCA法测蛋白浓度,用4×上样缓冲液将蛋白稀释成相同浓度,100℃沸水中煮10 min,分装后-80℃保存。以40 μg蛋白上样进行SDS-PAGE凝胶电泳(分离胶10%,浓缩胶 5%),恒压(浓缩胶 60 V,分离胶80 V);再将蛋白转至PVDF膜上(恒流,250 mA);5%牛血清蛋白封闭2 h;加一抗(Akt、p-Akt抗体稀释比为1∶2 000,eNOS 抗体稀释比为1∶200),4 ℃过夜;37℃复温2 h,TBST洗膜(5 min×3次),加二抗(稀释比为1∶4 000),37℃孵育2 h;TBST洗膜(5 min×3次);ECL显像,凝胶成像仪照相,用Quantity One行结果分析。
1.6 荧光定量PCR
取缺血大脑皮质100 mg,按Takara说明书提取总 RNA,取 2 μL 总 RNA 反转录成 20 μL 体系cDNA。根据 Genkbank提供序列用 primer-blast软件设计引物,eNOS上游5'-GCAGAGGAGTCCAGC GAACA-3',下游 5'-GAAATTGTTCCAGCACCTCTAG C-3',产物长度115 bp;SDF-1上游5'-TCCGTGGG CTCTGAGTTTTC-3',下 游 5'-CAGGGCCGTCTGTG ATCATTA-3',产物长度150 bp;CXCR4上游5'-GG ATGTGAGTTCGAGAGCGT-3,下游 5'-GCGTAGAGG ATGGGGTTCAG-3',产物长度92 bp。扩增条件为预变性95℃ 30 s,PCR反应95℃ 5 s,60℃ 30 s,40个循环。
1.7 血管计数
采用Image pro-plus6.0软件分析免疫组化图片并参考文献[8],先低倍镜(×40)找出大脑皮质缺血半暗带3个血管密度最高的热点区域,再换高倍镜(×200)计数被CD31染成阳性的微血管数目,每个样本用5个200倍视野下的血管数目的平均值表示。
1.8 统计学分析
2 结果
2.1 Tβ4对PI3K/Akt/eNOS信号通路的影响
与IRN组相比,IRT 3 d AKT磷酸化水平显著提高,第7天下降,但还保持在较高水平(P<0.05)(图1);p-Akt下游蛋白eNOS也在IRT 3 d显著增多(P<0.01)(图2);与IRT组相比,IRTL 3和7 d p-Akt和eNOS表达显著减少(P<0.01)(图1,2)。
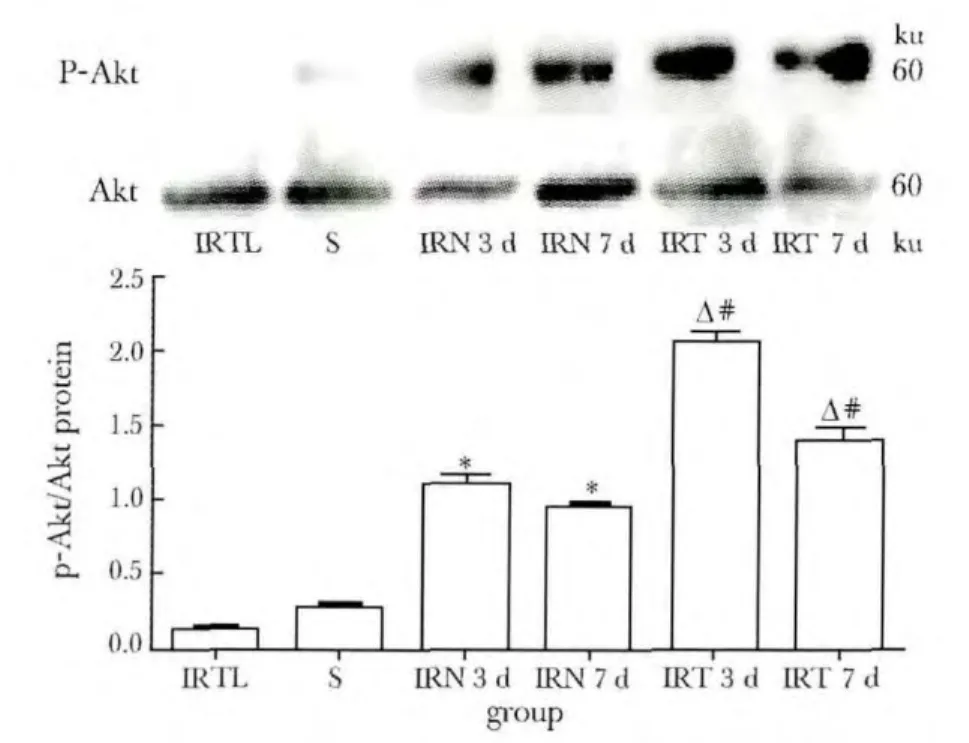
图1 不同时间点局灶脑缺血/再灌注大鼠大脑皮质Akt磷酸化水平Fig 1 The phosphorylation level of Akt at different time points in rat cerebral cortex after focal cerebral ischemia/reperfusions,n=6)
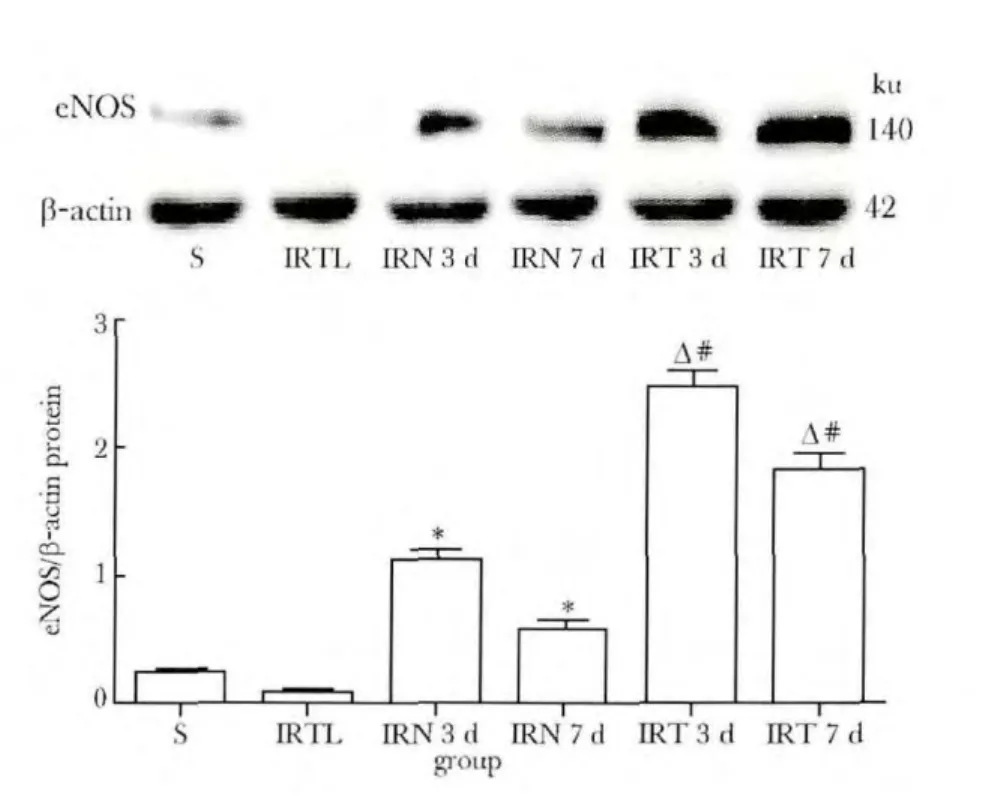
图2 不同时间点局灶脑缺血/再灌注大鼠大脑皮质eNOS蛋白表达Fig 2 The protein expression of eNOS at different time points in rat cerebral cortex after focal cerebral ischemia/reperfusion,n=6)
2.2 Tβ4 对 eNOS、SDF-1、CXCR4 mRNA 的影响
与IRN比较,IRT 3 d eNOS mRNA表达显著升高,第7天降低(P<0.05);SDF-1、CXCR4和eNOS mRNA有着平行变化的趋势,IRT 3 d增多,7 d降低(P<0.05)(表1)。
2.3 Tβ4对CD31阳性血管数目影响
与IRN组相比,IRT 3 d CD31阳性微血管密度增加,第7天增加更加明显 (P<0.05);使用PI3K/Akt通路抑制剂LY294002后,新生血管的密度显著减少(P<0.01)(图3)。
表1 各时间点局灶脑缺血/再灌注大鼠大脑皮质eNOS、SDF-1和CXCR4 mRNA表达Table 1 The mRNA expression of eNOS,SDF-1,CXCR4 at different time point in rat cerebral cortex after focal cerebral ischemia/reperfusion(the values of 2 -△△CT)(± s,n=6)

表1 各时间点局灶脑缺血/再灌注大鼠大脑皮质eNOS、SDF-1和CXCR4 mRNA表达Table 1 The mRNA expression of eNOS,SDF-1,CXCR4 at different time point in rat cerebral cortex after focal cerebral ischemia/reperfusion(the values of 2 -△△CT)(± s,n=6)
*P<0.05 compared with IRN group 3 days;#P<0.05 compared with IRN group 7 days;△P <0.01 compared with IRTL group.
group time point eNOS SDF-1 CXCR4 IRN 3 days 2.2±0.2△ 1.1±0.2△ 0.9±0.2△7 days 1.6±0.1 0.6±0.1 0.6±0.1 IRT 3 days 3.1±0.2*△ 1.4±0.2*△ 1.4±0.2*△7 days 1.9±0.1# 1.0±0.2# 0.9±0.2#IRTL - 0.4±0.1 0.3±0.1 0.2±0.1
2.4 Tβ4治疗后大脑皮质Tβ4表达情况
与IRN组比较,IRT 3 d大脑皮质缺血半暗带Tβ4蛋白表达最多(P<0.01);在梗死区,Tβ4在胶质细胞表达多见;缺血半暗带,Tβ4表达在神经元表达多见(图4)。
2.5 神经功能学评分
与IRN组相比,IRT 3 d神经功能改善并不显著,但第7天神经功能改善显著(P<0.05);与IRTL组比较,IRT组神经功能恢复较好(P<0.05)(表 2)。
3 讨论
“神经血管单元”由神经元、血管、胶质细胞组成,脑缺血后各成分相继损害。近年对“神经血管单元”的整体研究逐渐受到重视。Tβ4有促进血管再生、神经轴突修复、抑制炎性反应[1-3]等功能,是治疗局灶脑缺血/再灌注“神经血管单元”损伤的最佳候选者。
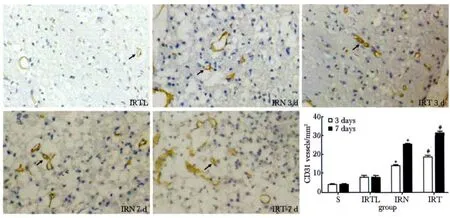
图3 各时间点局灶脑缺血/再灌注大鼠大脑皮质CD31阳性新生血管密度变化情况Fig 3 The changes of CD31 positive new vessels at different time points in rat cerebral cortex after focal cerebral ischemia/reperfusion(×200,n=6)
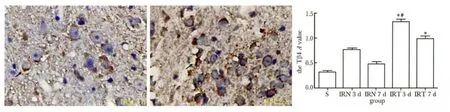
图4 局灶脑缺血/再灌注大鼠大脑皮质缺血半暗带Tβ4表达情况Fig 4 The expression of Tβ4 in rat cerebral cortex ischemic penumbra after focal cerebral ischemia/reperfusion(×400,n=6)
表2 神经功能评分Table 2 The scores of neurobehavioral function± s,n=18)
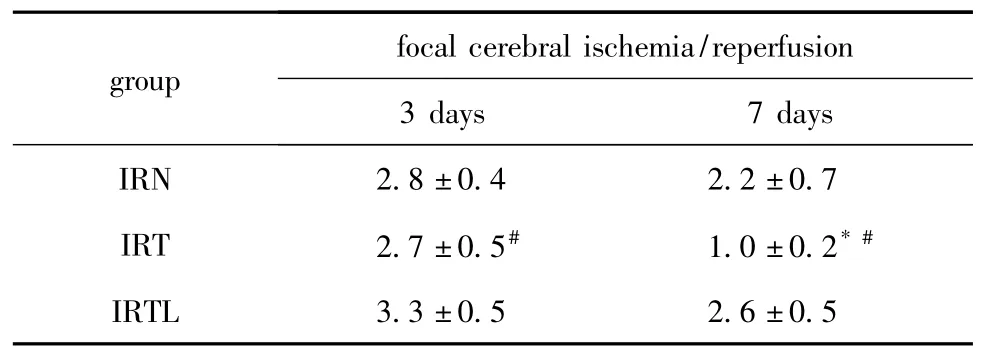
表2 神经功能评分Table 2 The scores of neurobehavioral function± s,n=18)
*P<0.05 compared with IRN group 7 day;#P<0.05 compared with IRTL group.
focal cerebral ischemia/reperfusion group 3 days 7 days IRN 2.8±0.4 2.2±0.7 IRT 2.7±0.5# 1.0±0.2*#IRTL 3.3±0.5 2.6±0.5
本研究发现Tβ4治疗第2天大脑皮质缺血半暗带Tβ4蛋白表达比IRN组显著增多,这说明腹腔注射Tβ4后大脑皮质有预期Tβ4蛋白表达的变化,而文献[1-3]没有检测。IRN 3 d p-Akt和eNOS表达升高,第7天下降,与文献[9,12]相符。体外研究已经证实Tβ4能通过提高p-Akt表达保护急性和慢性缺血的内皮祖细胞[10],激活下游eNOS减缓内皮祖细胞衰老[11],并促进大鼠缺血心肌血管再生[12]。而本实验中IRT 3d Akt磷酸化水平显著升高,第7天下降,使用PI3K/Akt通路抑制剂LY294002后,p-Akt和eNOS表达显著减少,故推测Tβ4可能通过提高大鼠缺血大脑皮质p-Akt表达,促进下游eNOS表达增加。研究认为局灶脑缺血/再灌注损伤后大脑皮质eNOS、SDF-1升高能促进骨髓源性内皮祖细胞归巢和缺血半暗带血管再生[13-14]。本实验IRT组SDF-1、CXCR4 mRNA在缺血大脑皮质表达比IRN组3和7 d显著升高,与eNOS蛋白和基因变化有相同的趋势。与IRN组比较,IRT组CD31阳性微血管密度显著增多,神经功能改善显著与参考文献[1]相符,推测Tβ4可能通过提高Akt磷酸化,促进血管再生和神经功能恢复。
Tβ4作为一种新药已进入2期临床试验,但其作用机制尚不十分清楚。本实验发现大鼠局灶脑缺血/再灌注损伤后,腹腔注射Tβ4多肽可能通过提高Akt磷酸化水平促进eNOS表达,并引起下游相应基因蛋白变化,促进大脑皮质缺血半暗带血管再生和神经功能恢复。但此实验并没有对eNOS进行直接干扰,因此将eNOS基因沉默后对Tβ4下游信号通路的研究成为未来的研究方向。
[1]Morris DC,Chopp M,Zhang L,et al.Thymosin beta4 improves functional neurological outcome in a rat model of embolic stroke[J].Neuroscience,2010,169:674-682.
[2] Xiong Y,Zhang Y,Mahmood A,et al.Neuroprotective and neurorestorative effects of thymosin beta4 treatment initiated 6 hours after traumatic brain injury in rats[J].J Neurosurg,2012,116:1081-1092.
[3]Sosne G,Qiu P,Christopherson PL,et al.Thymosin beta 4 suppression of corneal NFkappaB:a potential anti-inflammatory pathway[J].Exp Eye Res,2007,84:663-669.
[4]邱福宇.Tβ4对外周血内皮祖细胞功能的影响及机制的探讨[D].浙江:浙江大学医学院,2009,1-87.
[5]Isabelle P,David J,Shahin R.The SDF-1-CXCR4 signaling pathway:a molecular hub modulating neo-angiogenesis[J].TRENDS in Immunology,2007,28:299-307.
[6]罗勇,董为伟.Wistar大鼠插线法局灶性脑缺血/再灌注模型的实验研究[J].重庆医科大学学报,2002,27:1-4.
[7] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[8]Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147:9-19.
[9]张珊珊,罗勇,武磊.PI3K/AKT通路在电针促进局灶脑缺血再灌注大鼠脑内血管再生中的作用[J].第三军医大学学报,2010,32:2488-2491.
[10] Hinkel R,Bock-Marquette I,Hatzopoulos AK,et al.Thymosin beta4:a key factor for protecttive effects of eEPCs in acute and chronic ischemia[J].Ann NY Acad Sci,2010,1194:105-111.
[11]Li J,Yu L,Zhao Y,et al.Thymosin β4 reduces senescence of endothelial progenitor cells via the PI3K/Akt/eNOS signal transduction pathway[J].Mol Med Rep,2013,7:598-602.
[12]乔海兵,丁大有,聂李亚,等.胸腺素β4对急性心肌梗死大鼠心肌磷酸化蛋白激酶表达及纤维化的影响[J].解剖学杂志,2011,34:609-611.
[13]卢桃利,罗勇,孙宏毅,等.电针对局灶脑缺血再灌注大鼠大脑皮质eNOS mRNA及蛋白、MMP-9蛋白表达的影响[J].基础医学与临床,2012,32:158-163.
[14]赵旺,罗勇.电针对局灶脑缺血再灌注大鼠大脑皮质基质细胞衍生因子-1α表达的影响极其促进脑内血管再生的作用[J].中华物理医学与康复杂志,2010,32:409-413.

