金溶胶基底的SERS增强效果的实验研究
张心敏,史晓凤,韩晓红,马海宽,马 君
(中国海洋大学光学光电子实验室, 山东 青岛 266100)
0 引言
表面增强拉曼光谱(Surface-enhanced Raman Spectroscopy, SERS)技术作为一种极具发展潜力的光谱分析技术,逐渐成为表面科学和电化学领域有力的研究手段。因其灵敏度高、信息含量丰富、无需样品预处理,且增强基底对生物体没有损害等优势,使其在探测分析生物医学领域扮演越来越重要的角色。而高灵敏度SERS活性基底的制备是获得SERS信号的前提。金溶胶以其使用方便、易于制备、性能稳定、灵敏度高的特点,已经成为SERS技术中最常用的增强基底之一[1]。
为了将SERS技术发展成一种常规、原位的痕量分析工具,提高活性基底的增强效果及其探测灵敏度尤为重要。在实际研究中,评价一个分析方法测试性能的重要指标主要是增强因子和检测限。其中,增强因子(Enhancement Factor, EF)用来描述SERS基底的活性,可以表征基底对拉曼光谱的增强效果[2];检测限(Limit of Detection, LOD)则是评价一个分析方法、分析系统在低浓度范围内的检测水平的高低[3]。
结晶紫分子(Crystal Violet, CV)常被作为探针分子,用来研究SERS基底的活性。它是一种酸碱指示剂,能够较好的吸附在金溶胶颗粒上,产生较强的表面增强拉曼散射效应[4]。Hidebrandt等[5]的研究表明CV的SERS光谱强度与其浓度或含量之间具有良好的线性关系;Liang等[6]通过向SERS体系中添加卤素离子,实现了SERS增强因子的提高;首都师范大学的方炎小组[7]利用银纳米基底,研究了二十种氨基酸分子的结构,根据分子系列不同,通过调节pH值获得较好的探测灵敏度;马君小组[8]进一步研究发现,金溶胶体系在pH值为13的碱性环境下对多环芳烃的探测效果最佳。
本文利用CV分子作为探针分子,以金溶胶膜、自然状态下(pH=6)以及通过改变体系的pH值达到最佳SERS增强效果时的金溶胶溶液(pH=13)为例,通过对比这三种活性基底的增强因子及其对CV溶液的检测限,比较了金溶胶膜与金溶胶溶液增强效果的差异并分析了pH值对金溶胶溶液增强效果的影响。
1 实验部分
1.1 试剂与材料
氯金酸、氢氧化钠、柠檬酸钠、盐酸、浓硫酸、双氧水、硝酸、结晶紫均购于国药集团化学试剂有限公司;三氨丙基三甲氧基硅烷、2-吡咯烷酮购于阿拉丁试剂有限公司,所有试剂和药品均为分析纯,使用时未进一步提纯。结晶紫溶液均使用去离子水配制为10-8~10-3mol/L的不同浓度。
1.2 仪器
电子天平( FA2104,上海精科天平);超声清洗器(KQ2200DB,昆山市超声仪器公司);磁力搅拌器(RCT basic,德国IKA公司);移液器(QY-1000A,北京青云卓立精密设备有限公司);恒温干燥箱(DHG-9037A,上海精宏实验设备厂);紫外-可见分光光度计(UV-2550,日本岛津公司)。
拉曼光谱探测系统如图1所示,光谱仪为美国Ocean Optics公司的QE65000型拉曼光谱仪;光栅型号为H6,刻痕密度为1 200刻痕/mm,光谱分辨率为6 cm-1;光源采用的是785 nm近红外连续半导体激光器,激光功率为80 mw;光纤探头为美国InPhotonics公司的RIP-RPB-785型拉曼Y型光纤探头。

图1 拉曼探测系统结构示意图Fig.1 Schematic diagram of experimental set-up
1.3 金溶胶及金溶胶膜的制备
采用化学还原法制备金溶胶[9],将30 mL浓度为2 mmol/L的氯金酸溶液加热至沸腾,缓慢加入10 mL一定浓度的柠檬酸钠溶液,在沸腾状态下搅拌回流60 min后冷却至室温。所得金胶为砖红色,经测试其pH值为6。向金溶胶体系中添加适量氢氧化钠,得到pH值为13的金溶胶溶液。
金溶胶膜的制备参考史晓凤等改进的自组装法[10]。配制体积比为5%的三氨丙基三甲氧基硅烷(APTMS)甲醇溶液,将清洗过的石英片放入沸腾的APTMS甲醇溶液中进行硅烷化3 h,使石英片表面附着氨基,有利于金属纳米颗粒的吸附。将石英片取出,清洗后交替浸入到已制备好的金溶胶中(1 h)和1 mmol/L的吡咯烷酮溶液中(0.5 h),将上述浸泡过程重复5次,即可获得对785 nm激发波长增强效果最佳的金溶胶膜[11]。
2 结果与讨论
光谱数据采用origin8.1软件对SERS光谱进行去基线处理。光谱探测时,每个样品分别探测五次进行平均,积分时间统一设为10 s。
2.1 金溶胶及金溶胶膜的表征
SERS活性基底的制备对于获得SERS信号至关重要。采用化学还原法获得的金溶胶,在正常情况下经测试pH值为6,颜色为砖红色,这是由于制备溶胶时柠檬酸钠在加热条件下生成的甲酸和乙酰乙酸未与氯金酸充分反应造成的[12]。实验中发现,直接利用此自然状态下的金溶胶溶液作为活性基底的增强效果一般。通过加入氢氧化钠调节金溶胶体系的pH值可以改变金溶胶溶液中金纳米颗粒的聚集程度,从而得到增强效果更佳的SERS活性基底[8]。随着OH-离子在金溶胶溶液中浓度的升高,其颜色由砖红色逐渐变为蓝黑色。图2(A)为 pH=6 和 pH=13 时的金溶胶溶液的消光光谱。分析此图可知,在pH=6时,金溶胶溶液只有530 nm左右的一个等离子共振吸收峰,而当pH=13时,消光光谱除530 nm的峰外又明显出现了一个760 nm左右的等离子共振吸收峰。这可能是由于金纳米颗粒发生聚集而产生的。图2所示(B)和(C)为平均粒径为57 nm的金溶胶溶液在pH=6和pH=13时的扫描电镜图,可以看出金溶胶溶液在pH值为6的状态下金纳米颗粒只有少数聚合;而当pH值为13时,金纳米颗粒出现显著的聚合现象。

图2 不同pH值金溶胶溶液的消光光谱(A)和SEM图像(B:pH=6; C:pH=13)Fig.2 Extinction spectra (A) and SEM images (B and C) obtained from the gold colloid solutions with different pH values of pH=6 and pH=13
采用自组装法制备金溶胶膜,通过控制APTMS甲醇溶液的温度,控制吸附到石英片上APTMS的量,从而控制自组装到石英片表面上金纳米颗粒的个数,进而控制金溶胶膜等离子共振吸收峰的位置。得到灵敏度高、重复性好的SERS活性基底。图3所示为金溶胶膜的消光光谱和SEM图。相对于金溶胶的单分散性,纳米颗粒在石英片上的自组装以及颗粒之间的相互作用大大促进了金纳米颗粒的聚集程度。从图中可以看出,该金溶胶膜的平均粒径为62 nm,除了具有金溶胶530 nm处的等离子共振吸收峰外,在与激发波长(即785 nm)相近处也出现了明显的吸收峰。
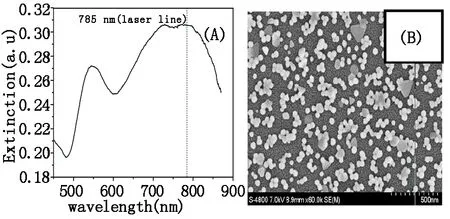
图3 金溶胶膜的消光光谱(A)和金溶胶膜的SEM图像(B)Fig.3 Extinction spectra(A) and SEM image (B) obtained from the gold colloid film
2.2 结晶紫SERS光谱探测及增强因子的计算
图4为5×10-7mol/L CV溶液分别以金溶胶膜、pH=6及pH=13的金溶胶溶液为活性基底的SERS光谱与10-3mol/L CV溶液的普通拉曼光谱的比较。图中,CV溶液的拉曼光谱、以金溶胶膜和pH值为6的CV溶液为活性基底的SERS光谱分别放大了10倍、5倍和2倍。图中标示出的CV的部分特征峰分别为:419 cm-1处的C-苯弯曲振动,722 cm-1、801 cm-1、1 172 cm-1的C-H弯曲振动,907 cm-1、941 cm-1处的环骨架振动,1 297 cm-1的苯环内C-C伸缩振动以及1 579 cm-1处的苯环内C-C伸缩、弯曲振动[13]。与CV溶液的普通拉曼光谱相比,以金溶胶为活性基底时,CV溶液的拉曼峰位有1~8 cm-1的频移,说明CV分子与金纳米颗粒之间发生了强烈的相互作用,并且CV分子中的N具有孤对电子、苯环上具有π电子,这些都使得CV分子很容易与金纳米表面发生电荷转移[14]。
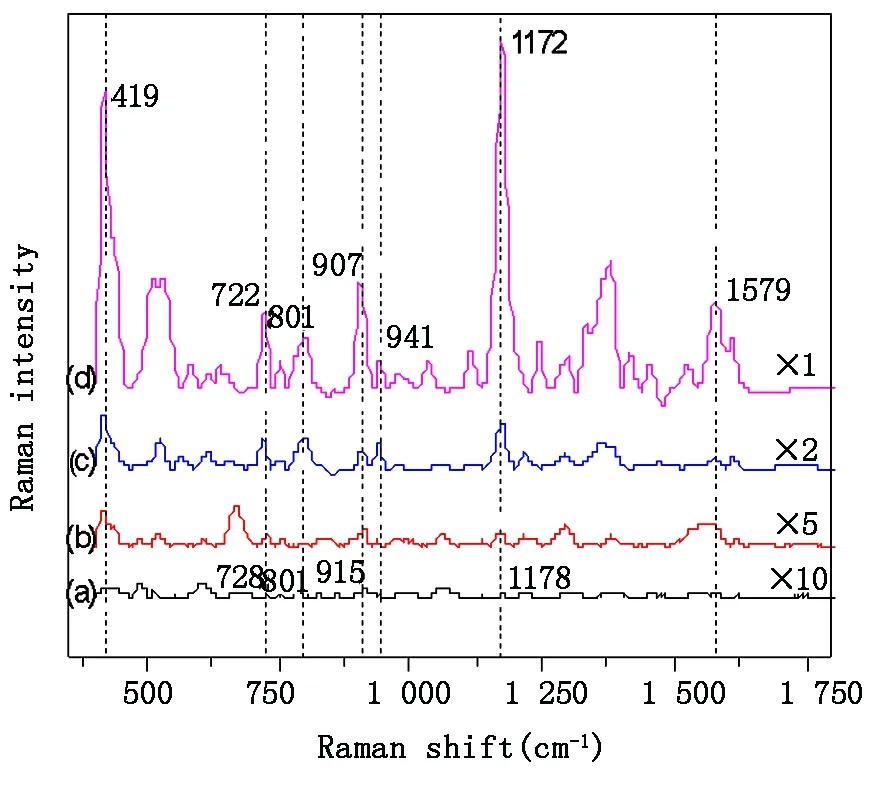
图4 三种不同基底的CV溶液(5×10-7 mol/L)SERS光谱(b, c, d)及较高浓度(10-3 mol/L)的CV溶液的拉曼光谱(a)比较. 所采用的基底分别为金溶胶膜(b)、pH=6金溶胶溶液(c)及pH=13金溶胶溶液(d)Fig.4 The SERS spectra of CV solution (5×10-7 mol/L) obtained with three different substrates of gold colloid film(b), gold colloid solution at pH=6 (c) and gold colloid solution at pH=13 (d). Spectrum (a) taken from CV solution ( 10-3 mol/L ) with conventional Raman setup as a comparison
以CV为探针分子,SERS活性基底的增强因子(EF)可通过下式计算[2]:
(1)
式中ISERS为CV分子的SERS信号强度,IRS为普通拉曼的信号强度,Nsurf和Nvol分别为SERS体系下和普通拉曼体系下有效散射体积内CV的平均分子数。
当以面积为S=0.6 cm×0.8 cm的金溶胶膜为SERS活性基底时,增强因子计算公式可进一步表示为:
(2)
式中Cvol=10-3mol/L和Csurf=5×10-7mol/L分别是普通拉曼探测和SERS探测时CV溶液的浓度,h=0.23 cm为有效散射深度,Vsurf=50 μL是滴加在金溶胶膜上的的CV溶液的体积。根据文献,CV分子在粗糙表面的吸附率大约为10%[15,16]。
对于金溶胶溶液活性基底,SERS探测和拉曼探测时的有效散射体积近似相同,此时SERS增强因子的计算公式可以表示为:
(3)
以金溶胶膜以及pH=6和pH=13的金溶胶溶液为活性基底,选取CV位于722cm-1、801 cm-1、1172 cm-1处三个特征峰为例计算了其增强因子,结果如表1所示。
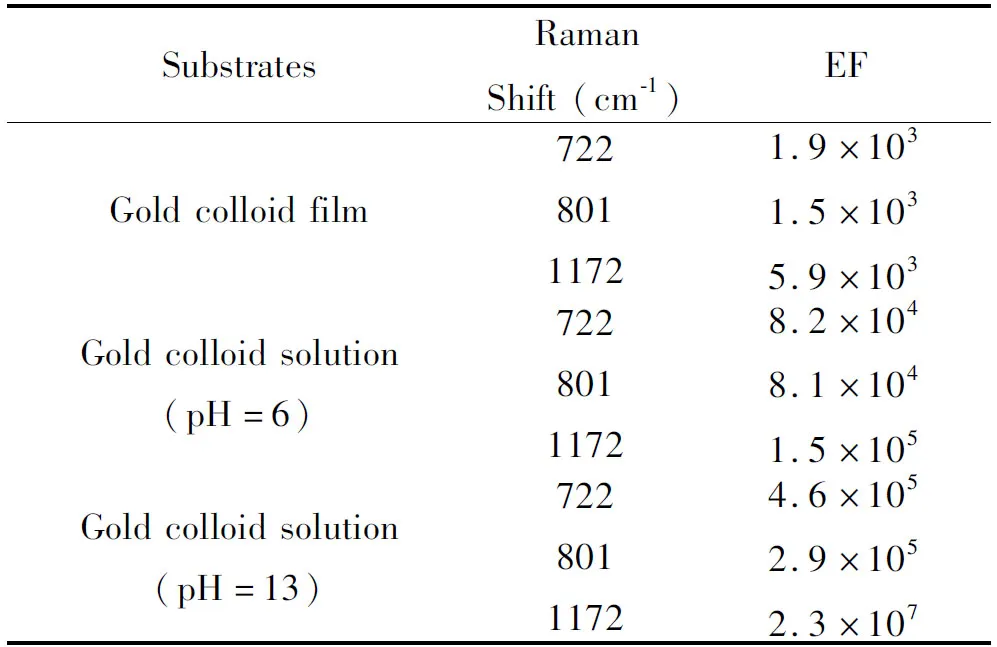
从表1可以看出,与金溶胶膜相比,金溶胶溶液作为基底时的增强因子更高。这是因为金溶胶体系是处于三维空间内,而金溶胶膜体系只是处于二维平面内,导致CV分子在相同有效散射面积内,在金溶胶溶液表面的吸附数量要远大于金溶胶膜表面。所以金溶胶溶液的增强效果要优于金溶胶膜。对比两种不同pH环境下金溶胶溶液的增强因子可知,pH=13时金溶胶溶液的增强效果有极大的提高,在1 172 cm-1处,其增强因子达到2.3×107。这可能是由于OH-的加入促进了金纳米颗粒的聚合,导致pH=13的金溶胶溶液相对于pH=6的金溶胶溶液出现了一个与激发波长相近的等离子共振吸收峰(如图2A),使拉曼跃迁的几率大大增加,同时聚合的金纳米颗粒增强了粒子间的耦合从而增加了局域电磁场的强度,并且OH-的加入能够增加金属表面的活位数量从而增加与表面吸附的CV分子数量,使得SERS信号能够进一步增强[6, 17]。
2.3 结晶紫检测限的计算
为进一步比较金溶胶膜、pH=6及pH=13的金溶胶溶液的探测灵敏度,本文计算了以这三种金溶胶为活性基底时CV溶液的检测限。图5及图6分别是以金溶胶膜为活性基底时不同浓度CV的SERS光谱以及CV溶液722 cm-1、801 cm-1、1 172 cm-1处特征峰的拉曼峰强与浓度之间的关系。以pH=6以及pH=13的金溶胶溶液为SERS基底时CV溶液位于722 cm-1、801 cm-1、1 172 cm-1处的拉曼峰强与浓度之间的关系如图7及图8所示,图中的误差条均为标准偏差。从中可以看出,以金溶胶膜为活性基底时,对同一样品多次探测的标准偏差明显大于以金溶胶溶液为基底时。这表明,采用金溶胶溶液为活性基底更有利于样品的定量分析。
根据检测限的计算公式:
(4)
式中σ为多次测得空白响应信号的标准偏差,k为CV定标曲线的斜率。经上述公式计算,结果如表2所示。
由表2可知,CV溶液在金溶胶膜、pH=6及pH=13的金溶胶SERS基底上的检测限分别能够达到70.7 nmol/L、9.6 nmol/L和1.8 nmol/L。充分表明,调节金溶胶溶液的pH值,可以有效的提高基底的SERS增强效果,降低其对CV溶液的检测限。
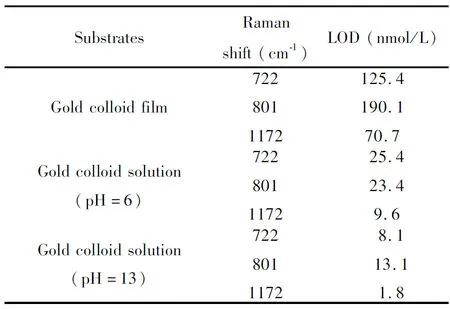
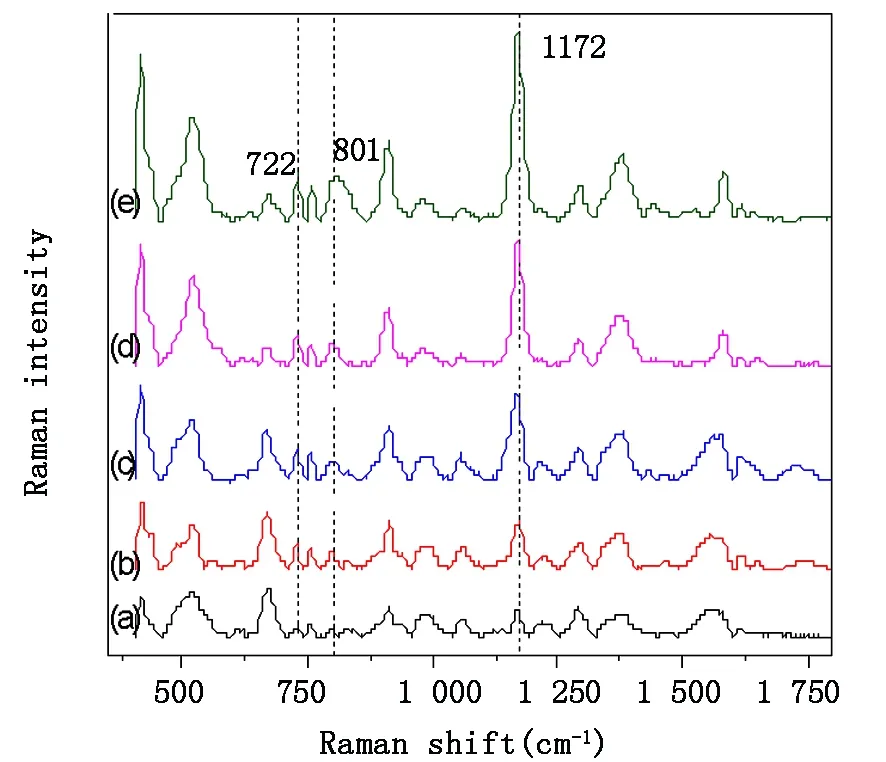
图5 不同浓度CV溶液在金溶胶膜上的SERS光谱. (a) 500 nmol/L, (b) 700 nmol/L, (c) 800 nmol/L, (d) 900 nmol/L, (e) 1 000 nmol/LFig.5 The SERS spectra obtained from CV solution of different concentrations of 500 nmol/L(a), 700 nmol/L (b), 800 nmol/L (c), 900 nmol/L(d) and 1 000 nmol/L (e) with the substrate of gold colloid film
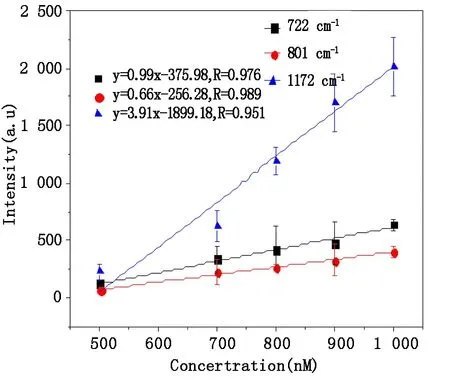
图6 金溶胶膜为SERS基底时CV在722 cm-1、801 cm-1和1 172cm-1拉曼频移处的定标曲线Fig.6 Calibration curve for CV at Raman shifts of 722 cm-1, 801 cm-1 and 1 172cm-1 with the substrate of gold colloid film
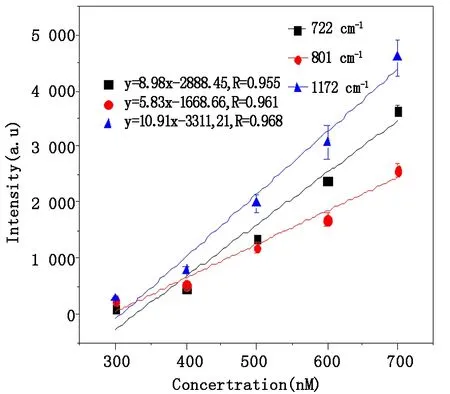
图7 pH=6的金溶胶溶液为SERS基底时CV在722 cm-1、801 cm-1和1 172 cm-1拉曼频移处的定标曲线Fig.7 Calibration curve for CV at Raman shifts of 722 cm-1,801 cm-1 and 1 172 cm-1 with the substrate of gold colloid solution(pH=6)
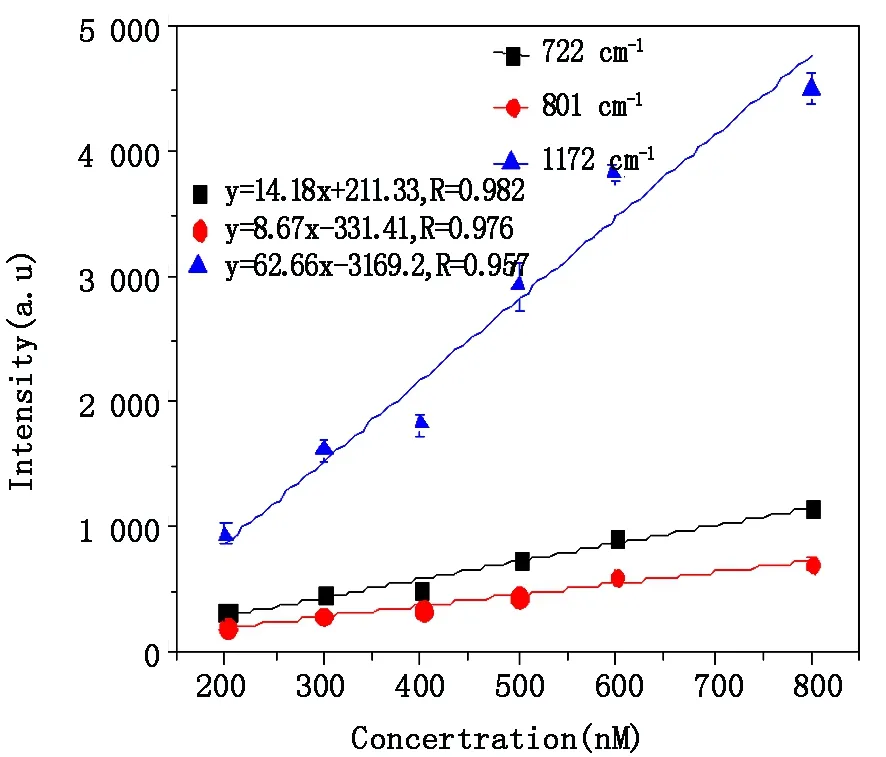
图8 pH=13的金溶胶溶液为SERS基底时CV在722 cm-1、801 cm-1和1 172 cm-1拉曼频移处的定标曲线Fig.8 Calibration curve for CV at Raman shifts of 722 cm-1,801 cm-1 and 1 172 cm-1 with the substrate of gold colloid solution(pH=13)
由表2可知,CV溶液在金溶胶膜、pH=6及pH=13的金溶胶SERS基底上的检测限分别能够达到70.7 nmol/L、9.6 nmol/L和1.8 nmol/L。充分表明,调节金溶胶溶液的pH值,可以有效的提高基底的SERS增强效果,降低其对CV溶液的检测限。
3 结论
通过计算CV溶液在金溶胶膜、pH=6和pH=13的金溶胶溶液表面的SERS增强因子以及在这三种金溶胶基底上CV溶液的检测限,分析了这三种SERS基底的增强效果。计算结果表明,在785 nm近红外激发条件下,这三种活性基底都能得到较好的SERS增强,尤其是pH=13时的金溶胶溶液,能达到高于金溶胶膜及pH=6的金溶胶溶液103和102倍的增强。利用这三种金溶胶基底对CV进行SERS探测,可以得到CV的检测限分别为70.7 nmol/L、9.6 nmol/L 和1.8 nmol/L。说明,金溶胶溶液的增强效果要明显优于金溶胶膜,而调节金溶胶体系的pH值能够达到使其探测灵敏度进一步提高的目的。因此,调节pH的金溶胶体系是一种在生物医学乃至临床医学研究中具有广阔应用前景的SERS活性基底。
[1] LIU Z, ZHANG F, YANG Z,etal. Gold mesoparticles with precisely controlled surface topographies for single-particle surface-enhanced Raman spectroscopy [J]. J Mater Chem C, 2013, 1(35):5567-5576.
[2] LE RU E C, BLACKIE E, MEYER M,etal. Surface enhanced Raman scattering enhancement factors:a comprehensive study [J]. J Phys Chem C, 2007, 111(37):13794-13803.
[3] YU L L, FASSETT J D, GUTHRIE W F. Detection limit of isotope dilution mass spectrometry [J]. Analytical Chemistry, 2002, 74(15):3887-3891.
[4] 陈建, 张卫红, 张卓良, 等. 结晶紫的表面增强拉曼光谱研究 [J]. 中山大学学报(自然科学版), 1995, 34(1):114-117.
CHEN Jian, ZHANG Weihong, ZHANG Zhuoliang, et.al. Surface-enhanced Raman scattering spectra of crystal violet [J]. Journal of Sun Yatsen University, 1995, 34(1):114-117.
[5] HIDEBRANDT P, STOCKBURGER M. Surface-enhanced resonance Raman spectro-scopy of rhodamine 6G adsorbed on colloidal silver [J]. J PhysChem, 1984, 88(24):5935-5944.
[6] LIANGE J, YE X L, KIEFER W, Surface-enhanced Raman spectroscopy of crystal violet in the presence of halide and halate ions with near-infrared wavelength excitation [J]. J. Phys Chem A, 1997, 101(40):7330-7335.
[7] 方炎, 李勤. Nd:YAG 1 064 nm激发的氨基酸系列的近红外表面增强拉曼散射 [J]. 光电子·激光, 1998, 9(3):224-226.
FANG Yan, LI Qin. Surface enhanced Raman scattering of series of amino acids on silver surface with Nd:YAG 1064nm excitation [J]. Journal of Optoelectronics·Laser, 1998, 9(3):224-226.
[8] 马君, 刘澍, 史晓凤, 等. 多环芳烃的表面增强拉曼光谱探测与分析 [J]. 光谱学与光谱分析, 2012, 32(9):2452-2457.
MA Jun, LIU Shu, SHI Xiaofeng,etal. Detection and analysis of polycyclic aromatic hydrocarbons using surface-enhanced Raman spectroscopy [J]. Spectroscopy and Spectral Analysis, 2012, 32(9):2452-2457.
[9] FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions [J]. Nature Physical Science, 1973, 241(1):20-22.
[10] SHI Xiaofeng, MA Jun, ZHENG Ronger,etal. An improved self-assembly gold colloid film as surface-enhanced Raman substrate for detection of trace-level polycyclic aromatic hydrocarbons in aqueous solution [J]. Journal of Raman Spectroscopy, 2012, 43(10):1354-1359.
[11] 马君, 孔德地, 韩晓红,等. 应用银溶胶膜探测水中抗生素的表面增强拉曼光谱研究 [J]. 光谱学与光谱分析, 2013, 33(10):2688-2693.
MA Jun, KONG Dedi, HAN Xiaohong,etal. Detection of antibiotics in water using silver colloid films as substrate of surface-enhanced Raman scattering [J]. Spectroscopy and Spectral Analysis, 2013, 33(10):2688-2693.
[12] 刘琨, 吴世法. 微波法制备银胶体及其在表面增强拉曼散射中的应用 [J]. 光散射学报, 2006, 17(4):332-335.
LIU Kun, WUShifa. Silver colloid synthesized by microwave method and applied in surface enhanced Raman scattering [J]. Chinese Journal of Light Scattering, 2006, 17(4):332-335.
[14] 杜勇, 方炎. 酸性条件下染料结晶紫分子的近红外表面增强拉曼散射研究 [J]. 光散射学报, 2003, 15(3):131-138.
DU Yong, FANG Yan. NIR-SERS study on crystal violet molecules at acidic conditions [J]. Chinese Journal of Light Scattering, 2003, 15(3):131-138.
[15] WANG Y, BECKER M, WANG L,etal. Nanostructured gold films for SERS by block copolymer-templated galvanic displacement reactions [J]. Nano Lett, 2009, 9(6):2384-2389.
[16] CAI W B, REN B, LI X Q,etal. Investigation of surface-enhanced Raman scattering from platinum electrodes using a confocal Raman microscope:dependence of surface roughening pretreatment [J]. Surface Science, 1998, 406(1-3):9-22.
[17] LI Y S, CHENG J, WANG Y. Surface-enhanced Raman spectra of dyes and organic acids in silver solutions:chloride ion effect [J]. Spectrochim Acta Part A, 2000, 56A(11):2067-2072.

