化浊通脉散对ASO家兔IL-1表达的影响
程 磊,李慎贤,金钟太,胡 莹,吴 迪,张 丽
0 引言
下肢动脉硬化闭塞症(ASO)是临床上常见的一种周围血管疾病,近年来发病率呈明显上升趋势,已成为危害中老年人生活及生命的主要疾病之一[1]。目前,研究者提出众多关于动脉粥样硬化发病机制的假说,如脂质浸润学说、单核巨噬细胞作用学说、血栓源性学说、内膜损伤反应学说、炎症学说等,但其确切发病机制迄今尚未完全阐明。本实验通过高脂饮食喂养家兔及股动脉血管内膜球囊扩张后造成机械性损伤模拟ASO,以化浊通脉散干预检测实验前后家兔的血脂变化,实验结束后应用RT-PCR方法观察动脉硬化斑块组织中白介素-1(IL-1)的表达情况,以阐明化浊通脉散治疗ASO的作用靶点,进一步从分子生物学角度探讨化浊通脉散治疗ASO的作用机制。
1 实验材料
1.1 实验动物 健康纯种的新西兰雄性白兔50只,10月龄,体重2.8~3.0 kg,由中国医科大学附属盛京医院动物实验中心提供,许可证号:SCXK(辽)2009-0002。
1.2 实验药物 化浊通脉散药物组成:黄芪、金银花、胆星、半夏、茯苓、白术、泽泻、焦山楂、川芎、延胡索、水蛭(三九药业集团提供,批号:0807021)。通塞脉片由江苏南星药业有限公司提供,批号:120509。西洛他唑片由浙江大冢制药有限公司提供,批号:120708T。胆固醇:由国药集团化学试剂沈阳有限公司提供,批号:20120109。牛血清白蛋白:由北京奥博星生物技术有限责任公司生产,批号:20120106。猪油自备。
1.3 实验试剂 Triozol Reagent:美国Invitrogen Life technologies公司,引物合成:北京华大基因公司,荧光定量PCR试剂盒:大连宝生物。血脂系列试剂由我院生化室提供。
1.4 实验仪器 德国eppendorf5417R离心机,雅培ARCHITECTci8200全自动生化免疫分析仪,小型台式离心机(美国SIGMA,1-13),高速冷冻离心机 sigma 31k5C型,美国PCR扩增仪(德国Biometra),紫外分光光度计(英国UV-visible Spectrometer,UV300)。
2 方法
2.1 分组及造模 造模前以基础饲料适应性喂养1周,排除饮食异常者。1周后随机分为5组,每组10只:即正常组(A)、模型组(B)、化浊通脉散组(C)、西洛他唑组(D)、通塞脉片组(E),分笼饲养。正常组喂养普通饲料,自由饮水。其余4组自实验开始喂高脂饮食,每只每日在正常饲料中加胆固醇1 g、猪油5 g。试验第3天开始,模型组(B)、化浊通脉散组(C)、西洛他唑组(D)、通塞脉片组(E)均在10%乌拉坦麻醉下由左侧股动脉插管,4F气囊导管拖拉左侧髂股动脉8次,造成机械性内膜损伤[2]。实验第7天,模型组(B)、化浊通脉散组(C)、西洛他唑组(D)、通塞脉片组(E)按文献经耳缘静脉一次性注射牛血清白蛋白250 mg/kg,造成免疫性内皮损伤[3],正常组注射等量生理盐水。
2.2 药物干预 从21周开始至24周末,各组改为正常饮食。中药治疗组予化浊通脉散,按生药7.2 g/(kg·d)给药(药物均根据“人和动物间按体表面积折算的等效剂量比率表”计算[4]);中药对照组予通塞脉片0.75片/(kg·d),按60 kg体重成人每日用量20片计算;西药对照组予西洛他唑片4.5 mg/(kg·d),按60 kg体重成人的人兔体表换算公式计算,均混入饲料中喂养。
2.3 血脂测定 各组动物于造模前及治疗后分别取外周静脉血5 mL,均以2 500 r/min离心30 min,取得血清,2 h内应用雅培全自动生化免疫分析仪分别检测TC、TG、HDL-C、LDL-C,比较造模前及治疗后各组指标的变化。
2.4 取材及实时荧光定量PCR检测IL-1的mRNA含量
2.4.1 取材 实验结束后用麻醉法处死动物,解剖切取股动脉血管多块(段),长约0.2~0.3 cm,放到盛有1 mL Trizol的1.5 mL EP管中保存,制备实验标本。
2.4.2 液体配制 ①DEPC水:吸出1 mL放在1 000 mL双蒸水中配成1 ‰DEPC水,放于1 000 mL容量瓶中静置4 h备用。②75%乙醇:用无水乙醇+DEPC水配,然后放-20 ℃保存(其中DEPC水需先高压)。
2.4.3 引物设计 目的基因采用RT-PCR方法检测引物,设计引物如下:

引物名称引物序列(5′➝3′)扩增产物大小(bp)GAPDH rabbit5′ TGCCGCCTGGAGAAAG 3′105 5′ GACCTGGTCCTCGGTGTAG 3′IL-1 rabbit5′ AGACGAGGGCATCCA 3′81 5′ AGAGCCACAACGACTGA 3′
2.4.4 操作步骤 ①Trizol法抽提总RNA:参照Trizol说明书采取一步法提取总RNA。取0.1 g组织置于1.5 mL离心管中加入Trizol 1 mL,在冰浴中迅速匀浆30 s以充分研碎组织,置于室温中5 min,后加入0.2 mL氯仿摇振15 s,置室温中3 min,以12 000×g 4 ℃离心15 min,吸取上清液0.5 mL加入0.5 mL异丙醇摇匀,-20 ℃放置2 h,12 000×g 4 ℃离心15 min,弃上清,加75%乙醇1 mL,7 500×g 4 ℃离心15 min,弃上清,加Nuclease free water 15 μL。采用紫外可见分光光度计测定260 nm、280 nm OD值,样品-80 ℃保存备用。②RNA浓度和纯度测定:取1 μL RNA样本,加79 μL DEPC水,紫外分光光度计测量OD 260与OD 280,二者比值应为1.8~2.0,提示样本中RNA纯度合格。RNA(μg/μL)浓度=OD 260×40×稀释倍数(80)/1 000。③逆转录合成cDNA:见表1。

表1 逆转录合成cDNA
反应条件
37 ℃ 15 min
↓
85 ℃ 5 s
④PCR扩增:见表2。

表2 PCR扩增
⑤PCR扩增:应用ABI 7500 扩增仪。
反应条件 95 ℃ 30 s 1个循环
↓
95 ℃ 5 s
60 ℃ 34 s 40个循环
↓
95 ℃ 15 s
60 ℃ 60 s
95 ℃ 15 s 1个循环

3 结果
3.1 血脂系列检测结果 见表3。造模前各组血脂指标比较差异无统计学意义(P>0.05)。实验结束后,B组、C组、D组、E组与A组比较,TC、TG、LDL-C均升高,差异有统计学意义(P<0.01);C组、D组、E组与B组比较,TC、TG、LDL-C均降低,差异有统计学意义(P<0.01),HDL-C较B组升高,但差异无统计学意义(P>0.05);D组、E组与C组比较,TC、HDL-C差异无统计学意义(P>0.05),但TG、LDL-C高于C组,差异有统计学意义(P<0.05)。说明化浊通脉散对调控TC、TG、LDL-C有显著效果。

表3 造模前各组动物血脂指标比较(mmol/L)
3.2 RT-PCR检测结果 根据RT-PCR原始检测结果,仪器可自动按设定的分析方法计算出各样品的目的基因相对定量结果,即其他各个样品相对于正常组目的基因mRNA转录水平的差异,即2-△△ct值(见表4),以及各组中IL-1的mRNA相对表达量(见图1)。

表4 各组对IL-1表达的影响
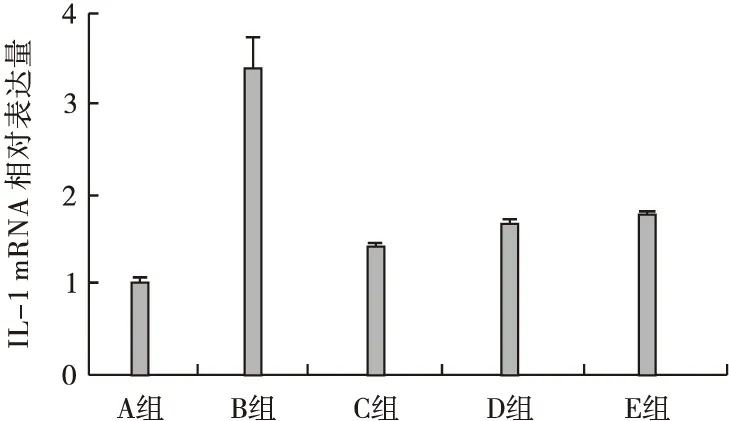
图1 Real-time PCR检测IL-1 mRNA的相对表达量
结果表明,与A组比较,B组、C组、D组、E组的IL-1 mRNA表达水平明显升高(P<0.01),与B组比较,C组、D组、E组的IL-1 mRNA表达水平明显下降(P<0.01),与C组比较,D组、E组的IL-1 mRNA表达水平略有升高(P<0.05)。IL-1、GAPDH的扩增曲线和溶解曲线见图2~图5。
图2 IL-1扩增曲线
图3 IL-1溶解曲线

图4 GAPDH扩增曲线
图5 GAPDH溶解曲线
4 讨论
下肢动脉硬化闭塞症是由动脉粥样硬化引起的一种慢性闭塞性疾病,一般发生于下肢大中动脉,多见于40岁以上中老年男性[5],是全身动脉粥样硬化在患者肢体的局部表现,常伴有脑动脉病变和冠状动脉硬化性心脏病[6]。本病属于祖国医学中“脱疽”范畴,目前大多数学者认为该病为本虚标实证,本虚即五脏气血阴阳的亏虚,标实即瘀、痰、毒、湿热等证候[7]。本实验主要认为ASO病机中脾虚为关键因素,脾主运化水湿,脾失健运则水湿泛溢成痰浊,痰为湿之变,热为火之渐,湿热与痰火异名而同源,痰为阴邪,易阻滞气机,进而化为瘀。现代医学研究表明,痰浊多反映高脂血症和高凝状态[8],笔者认为,高血脂和高凝状态正是动脉粥样硬化的最主要的危险因素;湿热内蕴是动脉粥样硬化的重要发病基础,是动脉粥样硬化的主要病理环节[9];血液流变学异常、血小板活化及血管内皮损伤是血瘀证候的重要表现。
本实验遵循中医“治病务求其本”的原则,在补阳还五汤的基础上加减化裁成化浊通脉散。本方重用黄芪,大补元气,使气旺则血行,瘀消而不伤正,为君药。川芎、水蛭:活血祛瘀止痛,为臣药。茯苓、白术、泽泻:健脾利水渗湿;半夏、胆南星:祛痰泄浊通络;焦山楂:消痰化瘀;金银花:清热解毒消炎;延胡索:行血中之气,又能行气中之血,共为佐药。全方共同组成益气化瘀通络、健脾祛痰化浊之功。
现代医学认为,动脉粥样硬化病变是从受累动脉的内膜开始,近年来,多数学者支持内膜损伤炎症反应学说,认为动脉粥样硬化形成的各种危险因素最终都导致相应动脉内膜的损伤和对内膜损伤做出的炎症纤维增生性反应。Ross[10]于1999年指出,动脉粥样硬化是具有慢性炎症反应特征的病理过程。IL-1是一种由巨噬细胞分泌的促炎性细胞因子,是体内调节炎症反应的中心介质之一[11-12]。IL-1能刺激血管内皮细胞活化并自身分泌产生IL-1β,IL-1β是重要的前炎症细胞因子,在动脉粥样硬化形成过程中起一定促进作用[13-14]。IL-1β能引起单核细胞聚集和浸润,又能移入内膜形成巨噬细胞。动脉粥样硬化形成过程中始终都有各种促炎症细胞因子的参与,进一步研究证实促炎性细胞因子IL-1在病灶发展的调节中起关键作用[15]。
本实验用实时荧光定量PCR检测结果显示,化浊通脉散对实验家兔的动脉硬化斑块组织中IL-1的表达有明显的降低作用,证明此方通过降低促炎性细胞因子IL-1,可有效抑制其刺激血管内皮细胞活化,并使其减少分泌前炎症细胞因子IL-1β,阻止单核细胞及淋巴细胞浸润到动脉内膜形成巨噬细胞,从而有效延缓和防止动脉粥样硬化形成的病变进展。
参考文献:
[1] 郑光儒.中西医结合治疗下肢动脉硬化闭塞症64例[J].西部中医药,2011,24(12):4-6.
[2] 王春喜,吴咸中.下肢动脉硬化闭塞症模型的探讨[J].中国中西医结合外科杂志,1999,5(5):316-324.
[3] Pu J,Wang L,Zhang CT,et al.Defibrase inhibits atherosclerosis induced by immunologic injury and high-fat diet in rabbit through restoring nitric oxide availability[J].Arterioscler Thromb Vasc Biol,2004,24:E7.
[4] 徐淑云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:202-203.
[5] 贾岩.下肢动脉硬化闭塞症临证心得[J].河南中医,2012,32(5):596-597.
[6] 张柏根.下肢硬化闭塞症治疗趋势与思考[J].中华普通外科杂志,2012,27(11):865-866.
[7] 徐剑,李越华,李海涛,等.动脉粥样硬化的中医病因病机研究进展[J].四川中医,2013,31(5):149-150.
[8] 张憨.冠心病痰浊辩证分型与血清脂蛋白动态平衡关系的研究[J].中西医结合杂志,1995,15(l):9.
[9] 林培政,杨开清.动脉粥样硬化性疾病与中医湿热证的关系[J].中药新药与临床药理,2006,3(2):147-149.
[10]Ross R.Atherosclerosis:an inflammatory disease[J].New Engl J Med,1999,340(2):115.
[11]王世军,李文豪,黄小宾,等.脉管II号胶囊对下肢动脉硬化闭塞症白介素-1、白介素-10及患肢趾端肤温的影响[J].光明中医,2013,28(2):276-277.
[12]Wrinkles JA,Alberts GF,Brosi E,et al.Endothelin-1 and endothelins receptor Mrna expression in normal and atherosclerotic human arteries[J].Biochem Biophys Res Commum,1993,191(3):1081.
[13]Latkovskis G,Licis N,Kalnins U.C-reactive protein levels and common polymorphisms of the interleukin-1 gene cluster and interleukin-6 gene in patients with coronary heart disease[J].Eur J Immunogenet,2004,31(5):207.
[14]吴伟,吴辉,卿立金,等.解毒活血方对动脉粥样硬化易损斑块兔模型CD40及白细胞介素-1β表达的影响[J].广州中医药大学学报,2013,30(4):507-510.
[15]Libby P.Inflammation in atherosclerosis[J].Nature,2002,420:868-874.

