Caspase-9抑制剂对SD大鼠椎间盘软骨终板细胞凋亡的影响
卢伟,李德芳,朱斌,吴靖平
(1.复旦大学附属金山医院骨科,上海 201508;2.安徽医科大学第二附属医院骨科,合肥 230601)
椎间盘退变是一系列脊柱退行性疾病(如椎间盘突出症、椎管狭窄症、腰椎滑脱症等)发生的前提条件和病理基础,脊柱退行性疾病是骨科常见病、多发病[1]。研究表明软骨终板退变是导致椎间盘退变的始动因素[2]。凋亡目前被认为是软骨终板退变发生的关键因素,这一过程主要由含半胱氨酸的天冬氨酸蛋白水解酶(caspase)的激活介导的。应用低胎牛血清法培养大鼠椎间盘软骨终板细胞可诱导软骨终板细胞凋亡并建立椎间盘软骨终板细胞凋亡体外模型[3]。模型的建立为探讨凋亡机制以及探索治疗椎间盘退变的新方法提供了条件。本研究采用caspase-9抑制剂Z-LEHD-FMK(氟甲基酮)进行抑制caspase-9活化实验,初步探讨低胎牛血清培养椎间盘软骨终板细胞凋亡机制并寻求新的椎间盘退变的药物治疗方法。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
DMEM高糖型培养基、胎牛血清、胰蛋白酶、双抗(Gibco公司,美国);caspase-9抑制剂Z-LEHD-FMK(R&D Systems,美国);二甲基亚砜DMSO(Sigma公司,美国);Annexin V-FITC/PI双染试剂盒(KeyGEN BioTech,中国);caspase-3、8抗体(CST公司,美国);BCA试剂盒(碧云天公司,中国)。
培养瓶、6孔及96孔细胞培养板(Corning公司,美国);二氧化碳细胞培养箱、超净工作台(上海力申科学仪器有限公司,中国);倒置相差显微镜(Olympus公司,日本);FACScan流式细胞仪(BD公司,美国)。
1.1.2 实验动物
清洁级SD大鼠20只,12周龄,雌雄不限,体重230 ~260 g,来源于上海市公共卫生临床中心【SCXK(沪) 2010-0024】。无菌手术在上海市公共卫生临床中心实验动物科学部屏障动物实验设施进行【SYXK(沪)2010-0098】,并按实验动物使用的3R原则给予人道关怀。
1.2 方法
1.2.1 SD大鼠椎间盘软骨终板细胞的分离与培养
12周龄SD大鼠,雌雄不限,水合氯醛腹腔麻醉后颈椎脱臼法处死,常规消毒,无菌条件下取下整个腰椎,解剖显微镜下剥离包裹脊柱的筋膜和肌肉显露椎间盘,将脊柱标本用预先准备的无菌PBS液洗涤3遍,分离软骨终板,放入盛有PBS液的锥形瓶中,剪碎成0.3~0.5 mm3的组织块,移入15 mL离心管中,用含双抗的PBS液冲洗软骨终板3次。采用序贯消化法获取软骨终板细胞。用预先配制好的完全培养基DMEM(含有10%FBS、1%双抗)重悬沉淀物,将细胞团吹打成单个细胞后用0.22 μm滤网过滤,收集滤液,1000 r/min离心5 min,弃上清;加入完全DMEM液3 mL清洗离心(1000 r/min,5 min)去上清液,重复3次。加入适量(约6~8 mL)含10%胎牛血清、1%双抗的DMEM培养液,以约2×104的密度接种于培养瓶中,将培养板置于含5% CO2、37℃的细胞培养箱中培养,每3天换液一次,倒置显微镜观察细胞贴壁及生长情况。细胞融合为单层时,进行传代,用0.25%胰蛋白酶消化,收获细胞制成细胞悬液,按2×105/mL接种于新的六孔培养板中。
1.2.2 建立低胎牛血清椎间盘软骨终板细胞凋亡模型
按照李德芳等[3]的方法建立低胎牛血清椎间盘软骨终板细胞凋亡模型。接种于6孔培养板中的软骨终板细胞,用DMEM+10% FBS+1%双抗培养基2 mL,5% CO2、95%湿润空气、37℃,24 h后换液,改用含1% FBS的培养基进行培养。随机进入各实验分组。
1.2.3 实验分组
随机分为3组:A组为1% FBS凋亡组;B组为caspase-9抑制剂组,即在用1% FBS诱导凋亡同时向培养基中加入caspase-9抑制剂Z-LEHD-FMK,使其终浓度为50 μmol/L;C组为DMSO对照组,因caspase-9抑制剂在配制时需用DMSO作为溶剂,而DMSO本身是对细胞有毒性的化学物质,为排除DMSO对试验的干扰,增此一组,在用1% FBS诱导凋亡同时向培养基中加入DMSO,使DMSO终浓度亦为50 μmol/L。
1.2.4 流式细胞仪检测软骨终板细胞凋亡率
采用annexin V-FITC联合PI法进行。检测结果判断:正常活细胞annexin V、PI均低染;凋亡细胞annexin V高染、PI 低染;坏死细胞annexin V、PI均高染。培养48 h后,收集各孔培养基的上清液(其中包含漂浮细胞),贴壁的细胞用不含EDTA的胰酶消化收集,二者混合后进行离心弃上清,孵育annexin V-FITC与PI染色剂,上机FACScan进行凋亡率检测。本实验中“凋亡”细胞包括早期和晚期凋亡细胞,实验独立重复三次。
1.2.5 Western blot检测caspase-9和caspase-3的表达
培养48 h后,收集各孔培养基的上清液(其中包含漂浮细胞),贴壁细胞胰酶消化收集,二者混合后进行离心弃上清。每孔加入RIPA裂解液100 μL冰上裂解30 min,不断吹打,收集裂解液4℃离心取上清液,BCA试剂盒定量。细胞蛋白上样量50 μg,12%聚丙烯酰胺凝胶电泳(SDS-PAGE),先行SDS-PAGE胶染色确定待测蛋白的表达。重复SDS-PAGE凝胶电泳,分离蛋白并转至PVDF膜上,室温下5%脱脂奶粉(含1% Tween20)封闭1h,此后在4℃时孵育一抗caspase-9(1∶500)、caspase-3(1∶3000)、PVDF膜用TBST液清洗3遍后,室温下孵育辣根过氧化物酶标记的兔抗大鼠的二抗1h,再次TBST清洗三遍后,采用增强型化学发光系统发光,曝光。以β-actin作为内参。
1.2.6 统计学分析

2 结果
2.1 软骨终板细胞凋亡率
流式细胞仪结果显示:1% FBS凋亡组获得较好的诱导凋亡效果,平均凋亡率为(40.8±0.84)%,DMSO组凋亡率为(40.2±1.56)%,与1% FBS组比较,DMSO对细胞凋亡未产生明显影响(P>0.05);而caspase-9抑制剂组凋亡率为(26.3±2.56)%,抑制剂组与1% FBS组及DMSO对照组比较凋亡率明显降低,差异有显著性(P<0.05)(图1)。
2.2 凋亡相关蛋白的检测
Western blot对凋亡相关蛋白的检测显示,在1% FBS凋亡组、DMSO对照组以及caspase-9抑制剂组中,procaspase-9表达均较高,1% FBS凋亡组与DMSO对照组中的active caspase-9表达亦较高,但在caspase-9抑制剂组中的active caspase-9表达却较低(图2)。进一步观察caspase-3的表达情况,结果发现各组active caspase-3均表达,但在caspase-9抑制剂组,其表达较1% FBS凋亡组和DMSO对照组灰度明显降低,差异有显著性(P<0.05)(表1)。这说明加入caspase-9抑制剂能明显抑制procaspase-9活化为有功能的active caspase-9,并且使凋亡执行者caspase-3的活化减少,从而抑制细胞的凋亡。

图1 流式细胞仪检测软骨终板细胞凋亡率

表1 caspase-3表达灰度分析
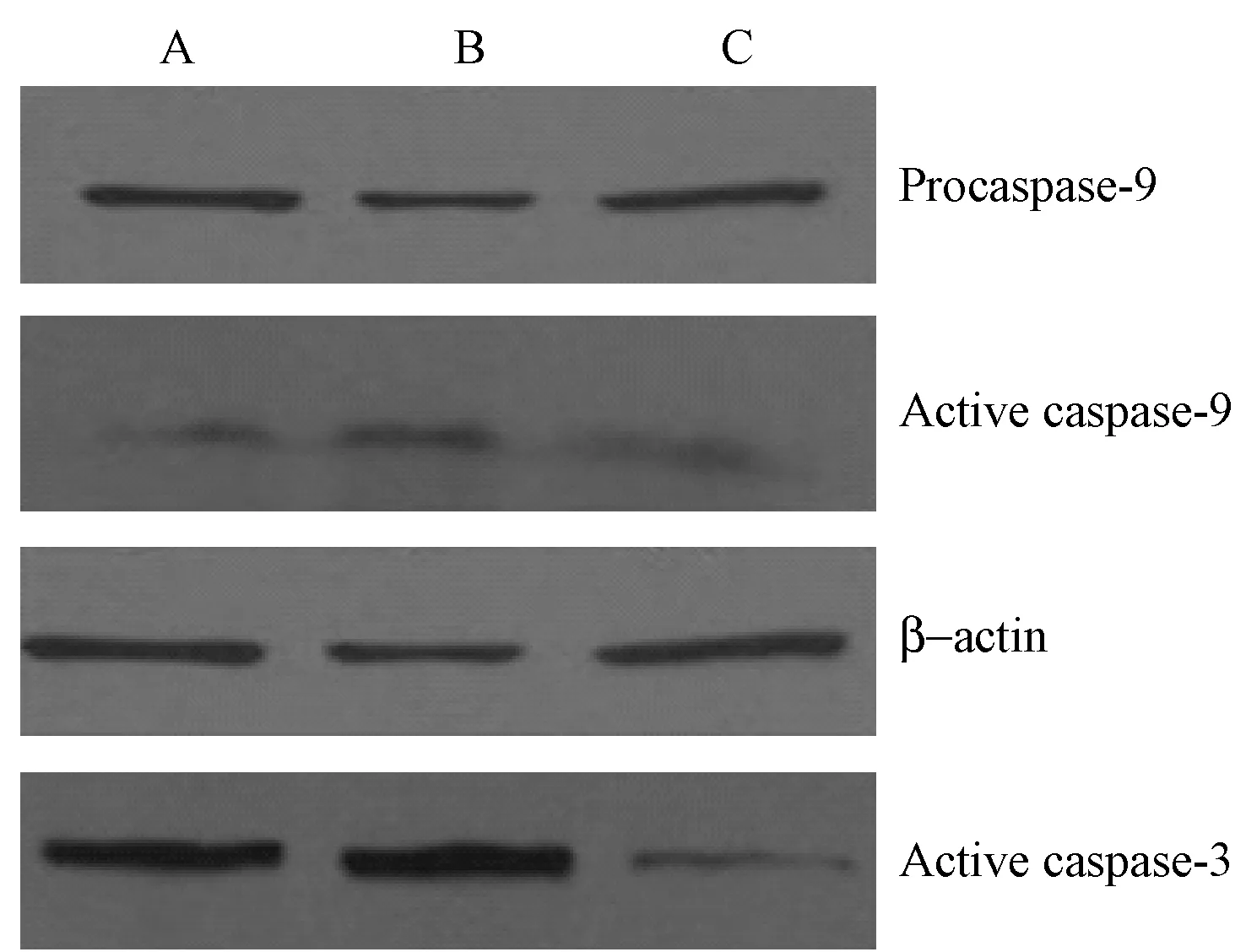
注: A:1% FBS凋亡组;B:DMSO对照组;C:Caspase-9抑制剂组。
3 讨论
椎间盘退变引起的椎间盘突出是临床上的常见病和多发病,显著影响患者的生活质量并伴有高致残率。临床上尚无有效的治疗椎间盘退变方法,仅在其产生神经压迫或脊柱不稳定时采用手术方法予以病变椎间盘切除和固定,虽然在一定程度上可缓解临床症状,但不能恢复椎间隙高度和承载应力能力。目前针对椎间盘退变修复的实验研究包括:注射生长因子、转基因、细胞移植等方法促进基质再生,修复受损的椎间盘基质[4,5],但仍需解决如生长因子在体内半衰期短、转基因的生物安全、细胞获取等方面的问题,至今仍未取得满意的结果。如何通过早期抑制椎间盘退变,从根本上防治椎间盘退行性病变的发生发展,还需要探索椎间盘退变的机制以及寻求治疗的新方法。
凋亡,又称细胞程序性死亡,是指有核细胞在一定条件下启动自身内部机制,通过内源性DNA内切酶的激活而发生的细胞自然死亡过程,它通常伴有细胞核内染色质聚集、DNA 断裂及凋亡小体形成等病理变化[6]。细胞内外的刺激因素,如相应配体结合死亡受体、紫外线照射、电离辐射、抗癌药物、生长因子缺乏、过度表达某些癌基因或抑癌基因均可以引起细胞发生凋亡,凋亡后期的共同途径是caspase的激活[7]。caspase是一类与凋亡密切相关的蛋白水解酶家族,以caspase前体酶原的形式存在于细胞中,是细胞凋亡的核心成分。目前已发现14种, 分启动caspase(如caspase-8,9)和效应caspase(如caspase-3,7)两类,分别参与凋亡的启动和执行过程。在整个凋亡通路中,最终都是激活效应caspase-3而执行凋亡[8,9]。近年来的研究结果显示凋亡与椎间盘退变关系密切[10],研究发现,椎间盘退变的重要因素是软骨细胞凋亡,且目前研究表明凋亡是椎间盘软骨终板内细胞数量减少的主要原因,并在椎间盘软骨终板退变过程中起重要作用[11,12]。在凋亡caspase级联反应过程中,caspase-3处于核心地位,是细胞凋亡的主要效应因子和最重要的凋亡执行者,是细胞凋亡发生的关键步骤及一切凋亡信号传导的共同通路[13]。如此关键的因子,针对其进行干预一定要非常小心,因为生物体的凋亡过程是新陈代谢的重要过程,与许多疾病的发生有直接或间接的关系,如肿瘤、自身免疫性疾病等[14,15],若对caspase-3进行抑制,则包括细胞生理性凋亡在内一起抑制,可能导致细胞无限增殖,引起肿瘤等疾病。目前有研究表明,软骨终板细胞凋亡可能主要经线粒体途径[16](由caspase-9起始),所以我们利用抑制剂抑制线粒体途径启动caspase-9,从而避免完全抑制凋亡导致其他疾病的发生。
由于caspase蛋白水解酶家族是凋亡过程的中心环节,因此对caspase抑制剂的研究有着重要的理论和实际意义。目前已知的caspase抑制剂主要包括:病毒及内源性的caspase抑制剂、人工合成caspase抑制剂。在体外实验中,多数caspase抑制剂受到细胞膜通透性的限制,不能进入细胞发挥作用。人工合成caspase-9抑制剂Z-LEHD-FMK(氟甲基酮),它是一种能不可逆地抑制caspase-9活性的人工合成短肽化合物,分子量小,特异性较高,并且连接FMK基团,因FMK衍生物能形成通透性较高的P1天冬氨酸的甲基脂类,对细胞膜具有高通透性,在较低浓度即发挥很好抑制作用[17-19],适合于体外实验研究。
在此基础上,本实验利用低胎牛血清法建立的椎间盘软骨终板细胞凋亡体外模型[3],该模型是一种非细胞损伤的模拟椎间盘退变时内环境变化(低营养供给)的细胞凋亡模型,它具有较好的可重复性、易于操作、经济,且能完成从细胞分子水平对椎间盘退变细胞改变进行定性、定量分析。实验应用caspase-9抑制剂Z-LEHD-FMK(氟甲基酮),对体外低浓度胎牛血清培养条件下的椎间盘软骨终板细胞进行干预,利用流式细胞仪及Western blot技术检测细胞培养后凋亡率的变化以及凋亡相关蛋白的表达情况。流式细胞仪显示caspase-9抑制剂组与1%FBS凋亡组及DMSO对照组比较凋亡明显降低,有显著统计学差异(P<0.05)。Western blot显示在caspase-9抑制剂组中,active caspase-9表达较其他两组低,并且caspase-9抑制剂组中active caspase-3表达灰度较其他两组明显较低(P<0.05)。结果表明抑制caspase-9的激活能明显降低胎牛血清培养条件下诱导的软骨终板细胞凋亡。
综上所述, 在体外条件下,caspase-9抑制剂能抑制低胎牛血清培养下诱导的椎间盘软骨终板细胞凋亡。从而为研究用抑制剂抑制caspase激活的方法逆转细胞凋亡及椎间盘退变提供了一个很有希望的研究方向,但人工合成caspase抑制剂真正应用到临床仍需克服以下问题:(1)具有一定的毒副作用,如600 mmol/ L的Z-VAD-FMK能够导致培养的张氏肝细胞有丝分裂后期阻滞[20];(2)代谢不稳定,体内广泛存在蛋白、多肽酶,肽类抑制剂作为其天然底物,会在体内迅速酶解、失活,不能以有效浓度持续足够长时间。这需要对用于治疗的caspase抑制剂进行包装或改进以便于通过口服或其他途径用于临床治疗椎间盘退变。相信在不久的将来,随着相关研究的不断深入,caspase-9抑制剂有望成为治疗椎间盘退变的一种有效方法。
[1] 黄宗强, 刘尚礼, 郑召民.椎间盘退变的分子生物学研究进展 [J].中国矫形外科杂志, 2003, 11(01):55-58.
[2] Shirazi-Adl A, Taheri M, Urban J P.Analysis of cell viability in intervertebral disc: effect of endplate permeability on cell population [J].J Biomech, 2010, 43(7):1330-1336.
[3] 李德芳, 吴靖平, 朱斌, 等.大鼠椎间盘软骨终板细胞凋亡体外模型的建立 [J].中国矫形外科杂志, 2013(02):172-177.
[4] Walsh A J, Bradford DS, Lotz JC.In vivo growth factor treatment of degenerated intervertebral discs [J].Spine (Phila Pa), 2004, 29(2):156-163.
[5] Nishida K, Kang JD, Suh JK, et al.Adenovirus-mediated gene transfer to nucleus pulposus cells.Implications for the treatment of intervertebral disc degeneration [J].Spine (Phila Pa), 1998, 23(22):2437-2442, 2443.
[6] Goyeneche AA, Harmon JM, Telleria CM.Cell death induced by serum deprivation in luteal cells involves the intrinsic pathway of apoptosis [J].Reproduction, 2006, 131(1):103-111.
[7] Larsen BD, Rampalli S, Burns LE, et al.Caspase 3/caspase-activated DNase promote cell differentiation by inducing DNA strand breaks [J]. Proc Natl Acad Sci U S A, 2010, 107(9):4230-4235.
[8] Kim KW, Ha KY, Lee JS, et al.The apoptotic effects of oxidative stress and antiapoptotic effects of caspase inhibitors on rat notochordal cells [J].Spine (Phila Pa), 2007, 32(22):2443-2448.
[9] Park JB, Park IC, Park SJ, et al.Anti-apoptotic effects of caspase inhibitors on rat intervertebral disc cells [J].J Bone Joint Surg Am, 2006, 88(4):771-779.
[10] Zhao CQ, Jiang LS, Dai LY.Programmed cell death in intervertebral disc degeneration [J].Apoptosis, 2006, 11(12):2079-2088.
[11] Gruber HE, Hanley EJ.Analysis of aging and degeneration of the human intervertebral disc.Comparison of surgical specimens with normal controls [J].Spine (Phila Pa), 1998, 23(7):751-757.
[12] Lotz JC, Chin JR.Intervertebral disc cell death is dependent on the magnitude and duration of spinal loading [J].Spine (Phila Pa), 2000, 25(12):1477-1483.
[13] Strasser A, Jost PJ, Nagata S.The many roles of FAS receptor signaling in the immune system [J].Immunity, 2009, 30(2):180-192.
[14] Wong RS. Apoptosis in cancer: from pathogenesis to treatment [J].J Exp Clin Cancer Res, 2011, 30:87.
[15] Nagata S.Apoptosis and autoimmune diseases [J].Ann N Y Acad Sci, 2010, 1209:10-16.
[16] Hirai T, Chagin AS, Kobayashi T, et al.Parathyroid hormone/parathyroid hormone-related protein receptor signaling is required for maintenance of the growth plate in postnatal life [J].Proc Natl Acad Sci U S A, 2011, 108(1):191-196.
[17] Ekert P G, Silke J, Vaux DL.Inhibition of apoptosis and clonogenic survival of cells expressing crmA variants: optimal caspase substrates are not necessarily optimal inhibitors [J].EMBO J, 1999,18(2):330-338.
[18] Gurevich RM, Regula KM, Kirshenbaum LA.Serpin protein CrmA suppresses hypoxia-mediated apoptosis of ventricular myocytes [J].Circulation, 2001, 103(15):1984-1991.
[19] Ekert P G, Silke J, Vaux D L.Caspase inhibitors [J].Cell Death Differ, 1999, 6(11):1081-1086.
[20] Swe M, Sit KH.zVAD-fmk and DEVD-cho induced late mitosis arrest and apoptotic expressions [J].Apoptosis, 2000, 5(1):29-36.

