低氧诱导的小窝蛋白-1上调参与人肺腺癌细胞A549迁移和侵袭*
左 蓓, 刑 敏, 孙珍贵, 汪向海, 陈兴无
(皖南医学院弋矶山医院呼吸内科,安徽 芜湖 241001)
恶性胸腔积液(malignantpleuralefusion,MPE)最常见病因为肺癌,其是非小细胞肺癌(non-smallcelllungcancer,NSCLC)患者预后不良的标志,目前尚无根治方法。癌细胞胸膜转移是MPE形成的主要原因,而转移的初始步骤是癌细胞迁移和侵袭。肿瘤微环境信号分子对癌细胞的迁移特性产生重要影响,MPE内富含多种细胞因子、趋化因子和生长因子等复杂成分,对维持癌细胞的生长、迁移和侵袭有十分重要的意义。
小窝蛋白-1(caveolin-1,Cav-1)是细胞质膜微囊主要结构蛋白,通过调节细胞生长分化和增殖侵袭而与肿瘤的发生发展密切相关。Davidson等[1]观察卵巢癌及原发性腹膜癌并发胸腹腔积液中癌细胞及肿瘤原发灶Cav-1的表达,发现胸腹水中癌细胞无论细胞膜还是细胞质Cav-1表达阳性率明显高于肿瘤原发灶中癌细胞相应部位Cav-1阳性率。肺癌组织中Cav-1表达下降,表现为抑癌作用。但在不同分期的肺癌,其表达存在差异。免疫组化分析NSCLC患者术后癌组织,发现几乎所有无淋巴结转移的标本Cav-1表达量很少,而在局部淋巴结转移的标本,Cav-1表达显著增加,提示Cav-1可能促进NSCLC细胞淋巴结转移[2]。目前认为肺癌患者Cav-1表达水平与转移能力增强和短生存期有关[3]。但胰腺癌和乳腺癌Cav-1过表达则抑制癌细胞的运动[4]。因此,Cav-1在癌细胞迁移和转移包括浆膜腔转移中的作用及其生成调节仍不清楚,可能呈细胞依赖性。最近研究发现Cav-1在肿瘤组织中的表达与肿瘤缺氧微环境密切相关,Cav-1可能作为缺氧诱导因子(hypoxia-induciblefactor,HIF)-1α的下游基因在肿瘤的发生发展中起着重要的作用[5]。
我们推测Cav-1在MPE中表达升高参与MPE发生,其生成可能与低氧环境诱导的HIF-1α生成有关。本研究比较肺癌及结核性胸膜炎患者胸腔积液中Cav-1和HIF-1α表达水平及两者相关性并以不同浓度二氯化钴(CoCl2)作用于肺腺癌A549细胞诱导细胞缺氧,探讨低氧诱导生成的Cav-1对A549细胞迁移和侵袭的影响及HIF-1α对Cav-1生成的调节。
材 料 和 方 法
1 临床病例资料
选择皖南医学院弋矶山医院呼吸内科2011年7月~2012年7月间确诊为肺癌合并胸水的住院患者(MPE组)52例(男38例,女14例),平均年龄(62.33±11.91)岁、结核性胸水患者(TBPE组)25例(男17例、女8例),平均年龄(38.54±16.14)岁,所有患者签知情同意书。MPE诊断标准:(1) 患者影像学符合原发性支气管肺癌合并胸腔积液;(2) 胸腔积液中找到肺癌细胞和(或)胸膜活检标本病理学确诊为肺癌;TBPE诊断标准:胸水为渗出液,腺苷脱氨酶(adenosine deaminase, ADA)>40 IU/L,胸膜活检示结核性肉芽肿[6]。
2 胸水采集和存储
收集患者入院后第1次经胸腔穿刺抽取的胸水20 mL,经3 000 r/min离心分离,留取上清等份分装于离心管、-20 ℃冻存备用。
3 A549细胞的培养与处理
人肺腺癌细胞株A549细胞(中科院细胞库)常规培养于含10%胎牛血清(杭州四季清公司)的RPMI-1640培养基中,于37 ℃、5% CO2培养箱中培养。以不同浓度的CoCl2(0、100、200、400、800 μmol/L,Sigma)作用A549细胞24 h;在另一实验中,以200 μmol/L CoCl2作用细胞6、12、24、48 h。为观察HIF-1α对Cav-1生成的影响,以200 μmol/L CoCl2作用A549细胞(培养液含0.1% DMSO)或同时加入HIF-1α抑制剂YC-1(10或100 μmol/L,Sigma)培养细胞24 h,培养结束后取细胞上清,3 000 r/min离心,留取上清-20 ℃保存。
4 主要方法
4.1MTT检测CoCl2对肺腺癌A549细胞存活及生长状态的影响 取对数生长期细胞,将A549细胞以1×108/L接种于96孔板;细胞贴壁后加入含不同浓度CoCl2(0、100、200、400、800 μmol/L)的无血清培养液培养12、24、48 h,每组设6复孔;每孔加入20 μL MTT溶液(5 g/L,Sigma),继续培养4 h;加入150 μL DMSO,于全自动酶标仪549 nm处测定吸光度值(A)。根据A值绘制细胞生长曲线,并计算细胞生长抑制率(IR)。IR=[1-(A实验孔值/A阴性对照孔值)]×100%,实验重复3次,取平均值。
4.2细胞划痕实验 将A549细胞以1×108/L的密度接种于24孔培养板,待细胞完全融合后,无血清培养液继续培养24h。用10μL加样枪枪头尖端在细胞板上划痕,PBS漂洗2次,每孔加入400μL含不同浓度CoCl2(0、100、200μmol/L)的无血清培养液,另选200μmol/LCoCl2分别以加入10或100μmol/LYC-1(溶于0.1%DMSO),以200μmol/LCoCl2+0.1%DMSO作为对照。分别于0h、24h在倒置相差显微镜下观察、拍照。
4.3Transwell小室迁移实验 将A549细胞以1×108/L接种于Transwell上室(Corning),培养24 h后,下室加入500 μL含YC-1和/或CoCl2的无血清培养液,实验按如下分组:0、100、200 μmol/L CoCl2组、200 μmol/L CoCl2+YC-1(10、100 μmol/L)组,对照组200 μmol/L CoCl2+0.1% DMSO;培养24 h。取出Transwell小室,弃培养液,甲醇固定20 min,将小室适当风干,0.1%结晶紫染色20 min;自来水洗3遍,棉签擦尽上室面细胞,光学显微镜下随机选取3个视野,计数小室下室面的细胞数,每组设3复孔,取平均值。
4.4Transwell细胞侵袭实验 方法与4.3项类似,只是侵袭小室的上室面滤膜用5g/LMatrigel基质胶(北京威格拉斯生物技术有限公司)100μL覆盖,风干后用于实验。
4.5胸水和细胞上清Cav-1、HIF-1α浓度的检测 ELISA法测定Cav-1、HIF-1α浓度,操作步骤参照试剂盒(上海豪森生物科技有限公司)说明书进行。检测灵敏度下限为1.0 ng/L。
5 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件处理,组内两两比较均采用q检验,2组间均数比较采用独立样本t检验,双变量相关分析采用Pearson相关性分析。以P<0.05为差异有统计学意义。
结 果
1 2组患者胸水中Cav-1、HIF-1α浓度比较及相关性分析
MPE组和TBPE组胸水中Cav-1浓度分别为(95.22±7.94)ng/L、(51.29±5.03)ng/L,HIF-1α浓度分别为(126.92±6.17)ng/L、(96.76±7.20)ng/L;MPE组均明显高于TBPE组(P<0.05),见图1;此外,MPE及TBPE中Cav-1与HIF-1α显著正相关(R=0.8990和0.6560,P<0.01),见图2。
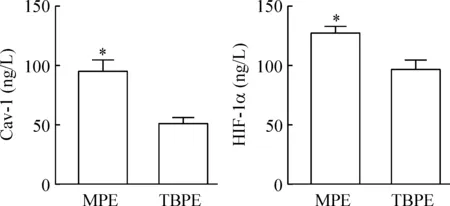
Figure 1. Comparison of Cav-1 and HIF-1α levels in the pleural effusion of patients.Mean±SD.n=3.*P<0.05 vs TBPE.
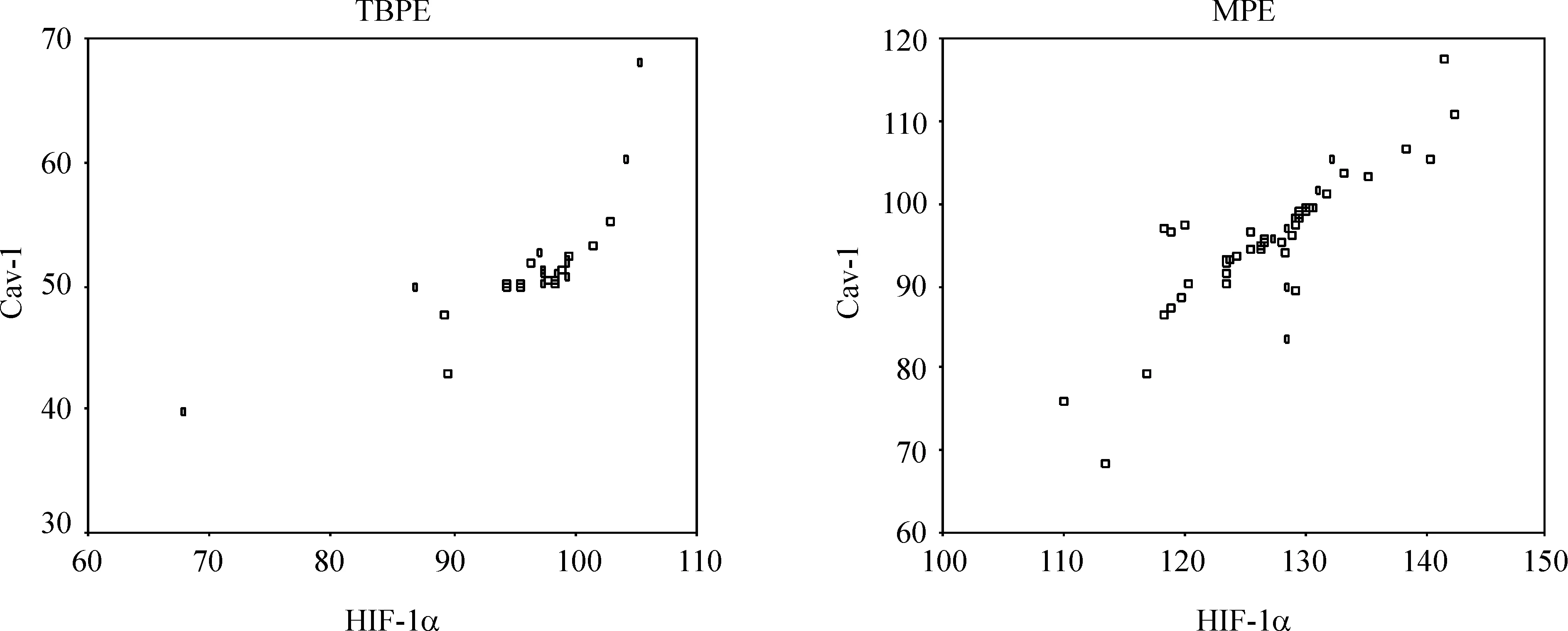
Figure 2. Correlation between Cav-1 and HIF-1α in the pleural effusion of patients.
2 CoCl2对肺腺癌A549细胞增殖的影响
分别以不同浓度CoCl2作用A549细胞12、24、48 h,由图2可见,低浓度CoCl2(<200 μmol/L)短时间(<24 h)诱导的缺氧对A549细胞增殖无明显抑制作用,而随着CoCl2浓度增加和作用时间延长,A549细胞增殖呈现时间和剂量依赖性抑制,见图3。
3 CoCl2影响A549细胞Cav-1、HIF-1α生成的量效关系及两者相关性
分别以不同浓度CoCl2作用于细胞24 h,作用浓度小于200 μmol/L时,随浓度增加HIF-1α和Cav-1水平上升,作用浓度大于200 μmol/L则诱导两者生成的作用减弱;各组Cav-1表达和HIF-1α呈正相关(P<0.05)。以200 μmol/L CoCl2分别作用于A549细胞6 h、12 h、24 h和48 h,随缺氧时间延长,Cav-1和HIF-1α浓度升高,至24 h达峰值,24 h后两者浓度均下降。YC-1浓度依赖性抑制CoCl2(200 μmol/L)诱导的HIF-1α和Cav-1水平(P<0.05),见图4。

Figure 3. The effects of CoCl2 on A549 cells proliferation.Mean±SD.n=3.*P<0.05 vs control (0 μmol/L).
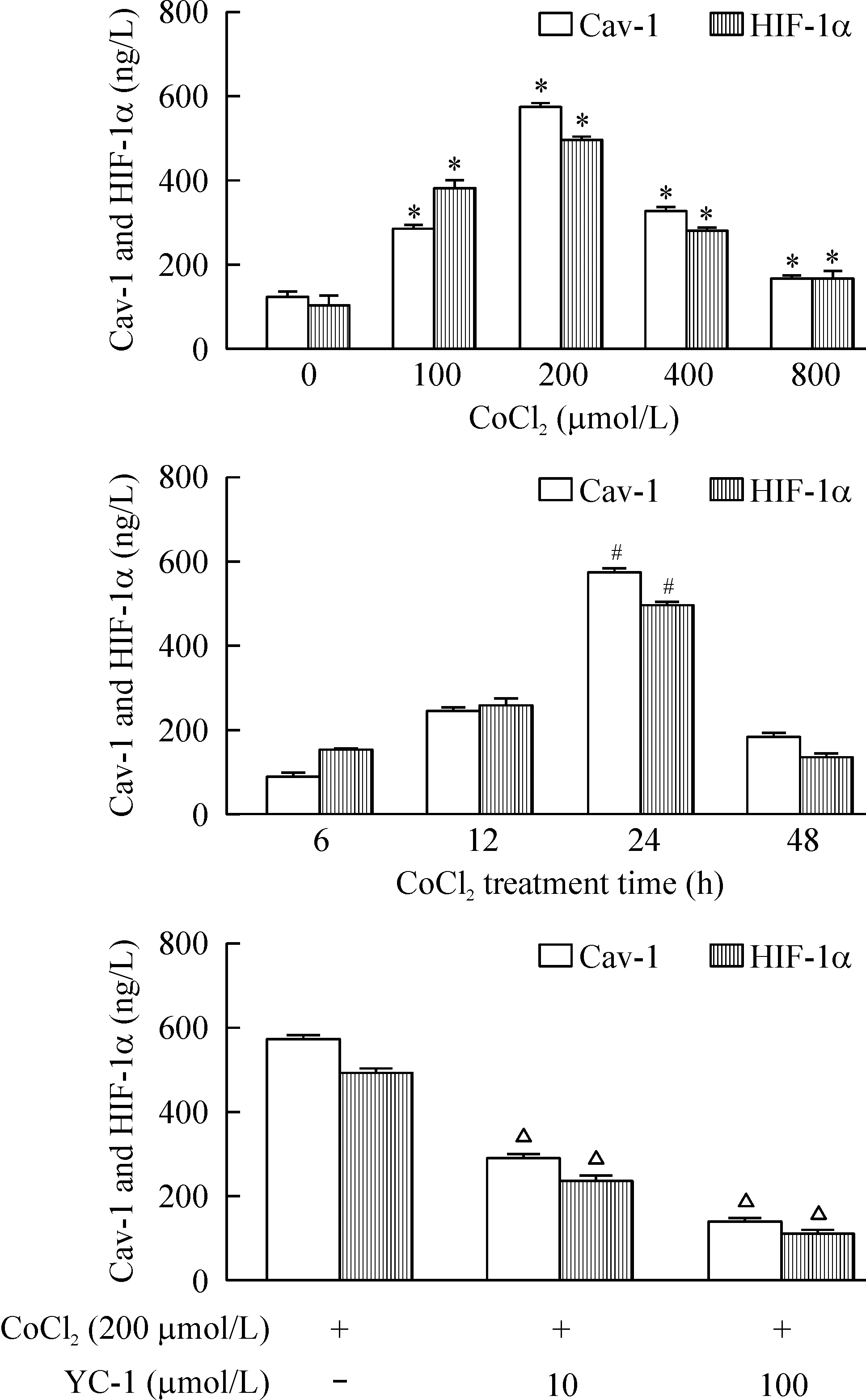
Figure 4. The effects of CoCl2 and/or YC-1 on Cav-1 and HIF-1α generation in A549 cells.Mean±SD.n=3.*P<0.05 vs 0 μmol/L; #P<0.05 vs 6 h; △P<0.05 vs CoCl2 alone.
4 CoCl2对A549细胞迁移能力的影响
细胞划痕后以不同浓度(0~200 μmol/L) CoCl2或同时加入10、100 μmol/L YC-1作用24 h,随着CoCl2浓度增高,促进细胞向损伤区域迁移,200 μmol/L CoCl2作用最明显,YC-1浓度依赖性抑制损伤区域细胞迁移,见图5。

Figure 5. The effects of CoCl2 and/or YC-1 on A549 cells migration (×200). A: control (0 μmol/L CoCl2); B: 100 μmol/L CoCl2; C: 200 μmol/L CoCl2; D: 200 μmol/L CoCl2+0.1% DMSO; E: 200 μmol/L CoCl2+10 μmol/L YC-1; F: 200 μmol/L CoCl2+100 μmol/L YC-1.
随着CoCl2浓度增高,穿过微孔膜的细胞数越多,200 μmol/L CoCl2最明显,YC-1浓度依赖性抑制细胞穿过微孔膜;镜下计数各组穿过Transwell小室的细胞每个视野个数分别为(63.0±2.9)、(110.0±3.8)、(220.0±10.3)、(144.0±5.1)、(74.0±3.0),加YC-1后穿过的细胞数较对照组明显减少(P<0.05),见图6。

Figure 6. The effects of CoCl2 on A549 cells migration by Transwell assay (×200).Mean±SD.n=3. A: control (0 μmol/L CoCl2); B: 100 μmol/L CoCl2; C: 200 μmol/L CoCl2; D: 200 μmol/L CoCl2+0.1% DMSO; E: 200 μmol/L CoCl2+10 μmol/L YC-1; F: 200 μmol/L CoCl2+100 μmol/L YC-1.*P<0.05 vs control; #P<0.05 vs 200 μmol/L CoCl2+0.1% DMSO.
5 CoCl2对A549细胞体外侵袭的影响
分别以0~200 μmol/L CoCl2或同时加入10、100 μmol/L YC-1作用于A549细胞24 h,发现与上述类似的现象,光镜下计数穿过聚碳酸酯膜的细胞每个视野的平均个数分别为57.0±5.5、96.0±7.9、197.0±12.7、135.0±8.9和63.0±9.3;随着CoCl2浓度增高,细胞侵袭数增多,200 μmol/L刺激作用最明显;YC-1抑制细胞侵袭并呈浓度依赖性,见图7。
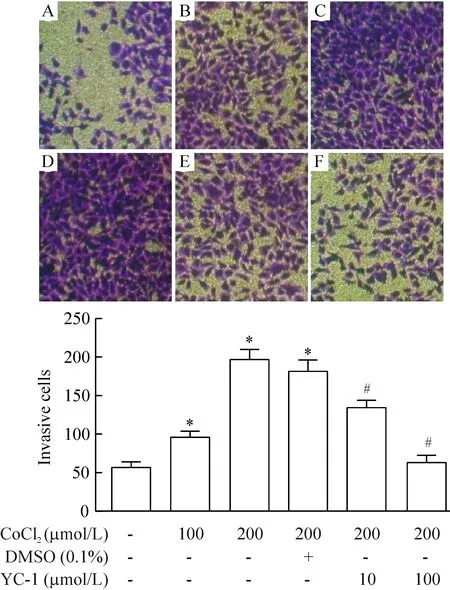
Figure 7. The effects of CoCl2 on the invasion of A549 cells (×200).Mean±SD.n=3. A: control (0 μmol/L CoCl2); B: 100 μmol/L CoCl2; C: 200 μmol/L CoCl2; D: 200 μmol/L CoCl2+0.1% DMSO; E: 200 μmol/L CoCl2+10 μmol/L YC-1; F: 200 μmol/L CoCl2+100 μmol/L YC-1. *P<0.05 vs control; #P<0.05 vs 200 μmol/L CoCl2+0.1% DMSO.
讨 论
本研究中,我们检测了肺癌合并MPE与结核性胸水中Cav-1、HIF-1α水平,发现肺癌合并MPE中Cav-1、HIF-1α浓度均较结核性胸水升高,并且Cav-1与HIF-1α呈正相关。先前的研究也发现,肺癌合并MPE患者胸水中HIF-1α表达升高,免疫组化和免疫荧光分析肺癌组织中恶性程度高、侵袭性强和转移早的小细胞肺癌HIF-1α的表达强度显著高于鳞状细胞癌及腺癌;淋巴结有转移组HIF-1α的表达强度显著高于淋巴结无转移组[7]。考虑Cav-1和HIF-1α共同在肺癌胸膜转移中起作用或互为上下游调节基因而发挥作用,推测MPE中高表达的Cav-1、HIF-1α可能与MPE的形成有关。
缺氧是恶性肿瘤最重要的病理特征,CoCl2常用于体外诱导细胞缺氧,其刺激的低氧特征类似于体内低氧微环境[8]。体外模拟缺氧的直接表现是HIF-1α蓄积增加,研究显示,CoCl2刺激HIF-1α表达在一定范围内具有时间和剂量相关性,延长作用时间或加大浓度并不增加HIF-1α的水平。
与缺氧密切相关的另一蛋白成分Cav-1是一个颇受争议的蛋白,在不同肿瘤细胞及不同发展阶段显示抑制或促进肿瘤发展的作用,在多数癌组织及肿瘤细胞系如肺癌[9]中Cav-1表达下降,并且Cav-1的重新表达会抑制癌细胞生长及癌细胞集落的形成,因此认为Cav-1对细胞恶变有抑制作用。已证实Cav-1与癌细胞运动和肿瘤进展有关,在胰腺癌细胞,Cav-1通过失活RhoC GTP酶和ERK-金属蛋白酶的信号通路抑制细胞迁移和侵袭[4,10]。类似的抑制作用见于乳腺癌MTLn3和MCF-7细胞。然而,Cav-1在肺癌侵袭转移中的作用,目前报道并不一致,Yeh等[11]将野生型Cav-1基因转染入小细胞肺癌细胞系NCI-H446中,发现Cav-1调节转移相关基因E-Cadherin和MMP-3表达及MMP-3酶活性促进NCI-H446体外运动和侵袭能力。相反,Zhang等[12]将Cav-1的siRNA转染到小鼠Lewis肺癌细胞系P29后ERK1/2和Akt信号通路激活,细胞增殖和运动能力明显增强。因此,Cav-1在肺癌细胞侵袭转移中的确切作用和调控机制仍不清楚。另一方面,尽管Cav-1的表达差异可能受癌细胞类型和分期影响, 肿瘤微环境低氧环境可能发挥关键作用。
为进一步探讨Cav-1在肺癌细胞胸膜侵袭过程中的作用及其生成与HIF-1α的关系,本研究以CoCl2作为细胞缺氧微环境诱导剂,观察后者是否影响Cav-1、HIF-1α生成进而促进细胞迁移和侵袭。首先观察了CoCl2对细胞活力的影响情况,发现较低浓度(<200 μmol/L)或作用时间少于24 h时CoCl2对细胞活力影响较小,增加浓度或延长处理时间明显降低细胞活力。其次,我们发现一定浓度范围(<200 μmol/L)和作用时间(<24 h)内CoCl2促进Cav-1和HIF-1α表达存在时效和量效关系,高浓度(400 μmol/L)或延长处理时间,两者表达逐渐下调;这种情况可能与高浓度CoCl2对细胞的毒性作用或长时间缺氧引起负反馈效应有关。此外,CoCl2诱导Cav-1和HIF-1α生成过程中,两者浓度高度正相关,而同时应用HIF-1α抑制剂YC-1剂量依赖性抑制CoCl2诱导的HIF-1α和Cav-1;上述结果虽然不能直接说明两者的相互作用关系,也不清楚Cav-1和HIF-1α互相调节的具体机制,但结合两者与低氧的密切关系及既往研究[5],提示HIF-1α可能作为Cav-1的上游调节因子影响Cav-1表达。
细胞侵袭是癌症进展的一个重要方面,低氧条件下癌细胞表现更高的迁移和侵袭能力。在阐述了CoCl2促进Cav-1和HIF-1α生成的量效和时效关系基础上,通过细胞划痕及Transwell小室迁移实验均观察到一定浓度范围(<200 μmol/L)内的缺氧诱导剂CoCl2浓度依赖性增强A549细胞迁移,HIF-1α抑制剂YC-1减弱该诱导作用;同样,体外侵袭实验得到类似结果,这从一定意义上提示CoCl2诱导生成的Cav-1和/或HIF-1α上调生成的Cav-1与肺癌细胞某些恶性生物学特性有关,可以从黏附、迁移和侵袭环节促进A549细胞的侵袭转移能力。
总之,本研究结果初步提示Cav-1促进肺癌细胞株A549黏附、迁移和侵袭的作用,也提示其在肺癌并发MPE形成过程中起重要作用,我们的结果还提示HIF-1α在肿瘤细胞运动和Cav-1表达中有重要作用, 这可能对阐明肺癌发展及其胸膜转移具有重要意义。但Cav-1如何介导肺癌细胞转移至胸膜腔及MPE中癌细胞表达Cav-1的机制目前尚不清楚,对其进行研究可能有助于开发肺癌相关MPE的治疗策略。
[参 考 文 献]
[1]DavidsonB,GoldbergI,Givant-HorwitzV,etal.Caveolin-1expressioninovariancarcinomaisMDR1independent[J].AmJClinPathol, 2002, 117(2):225-234.
[2] Zhan P, Shen XK, Qian Q, et al. Expression of caveolin-1 is correlated with disease stage and survival in lung adenocarcinomas[J]. Oncol Rep, 2012, 27(4):1072-1078.
[3]SotgiaF,Martinez-OutschoornUE,HowellA,etal.Caveolin-1andcancermetabolisminthetumormicroenvironment:markers,models,andmechanisms[J].AnnuRevPathol, 2012, 7:423-467.
[4] Han F, Zhu HG. Caveolin-1 regulating the invasion and expression of matrix metalloproteinase (MMPs) in pancreatic carcinoma cells[J]. J Surg Res, 2010, 159(1):443-450.
[5]WangY,RocheO,XuC,etal.Hypoxiapromotesligand-independentEGFreceptorsignalingviahypoxia-induciblefactor-mediatedupregulationofcaveolin-1[J].ProcNatlAcadSciUSA, 2012, 109(13):4892-4897.
[6] Light RW. Update on tuberculous pleural effusion[J]. Respirology, 2010, 15(3):451-458.
[7] 黄 磊, 敖启林, 李 芳, 等. 低氧诱导因子1α诱导卵巢癌细胞周期阻滞的研究[J]. 中国病理生理杂志, 2005, 21(4): 718-721.
[8] Zhang B, Guo W, Yu L, et al. Cobalt chloride inhibits tumor formation in osteosarcoma cells through upregulation of HIF-1α[J]. Oncol Lett, 2013, 5(3):911-916.
[9]RacineC,BélangerM,HirabayashiH,etal.Reductionofcaveolin-1geneexpressioninlungcarcinomacelllines[J].BiochemBiophysResCommun, 1999, 255(3):580-586.
[10] Lin M, DiVito MM, Merajver SD, et al. Regulation of pancreatic cancer cell migration and invasion by RhoC GTPase and caveolin-1[J]. Mol Cancer, 2005, 4(1):21.
[11]YehD,ChenC,SunMZ,etal.Caveolin-1isanimportantfactorforthemetastasisandproliferationofhumansmallcelllungcancerNCI-H446cell[J].AnatRec(Hoboken), 2009, 292(10):1584-1592.
[12] Zhang Q, Furukawa K, Chen HH, et al.Down-regulation of caveolin-1 in mouse Lewis lung cancer P29 is a causal factor for the malignant properties in a high-metastatic subline[J]. Oncol Rep, 2006, 16(2):289-294.

