高原鼠兔有效洞穴密度对高寒草甸优势植物叶片和土壤氮磷化学计量特征的影响
李倩倩,赵 旭,郭正刚
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室, 兰州 730020)
高原鼠兔有效洞穴密度对高寒草甸优势植物叶片和土壤氮磷化学计量特征的影响
李倩倩,赵 旭,郭正刚*
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室, 兰州 730020)
采用有效洞穴密度代替高原鼠兔(Ochotonacurzoniae)活动强度的方法,研究了高原鼠兔有效洞穴密度(10、15、21和31 个/625 m2)对高寒草甸优势植物高山嵩草(Kobresiapygmaea)、垂穗披碱草(Elymusnutans)、小花草玉梅(Anemonerivularis)叶片和土壤氮(N)磷(P)化学计量特征的影响。结果表明,3种优势植物叶片N含量随有效洞穴密度增加而显著增加(P<0.05),但叶片P含量却出现分异,表现为高山嵩草和垂穗披碱草叶片P含量随有效洞穴密度增加而先增加后降低(P<0.05),小花草玉梅叶片P含量逐渐增加(P<0.05);高山嵩草叶片N∶P随有效洞穴密度增加先降低后增加(P<0.05),垂穗披碱草叶片N∶P逐渐增加,小花草玉梅叶片N∶P则先增加后降低。土壤0—10 cm和10—20 cm土层N含量随有效洞穴密度增加无明显变化;0—10 cm土层P含量随有效洞穴密度增加先降低后增加,10—20 cm土层P含量逐渐降低;0—10 cm土层N∶P随有效洞穴密度增加无明显变化,而10—20 cm土层N∶P则逐渐增加。优势植物叶片N、P、N∶P与土壤N、P、N∶P的相关性受植物根系分布特征和生存微环境的约束。
高原鼠兔; 有效洞穴密度; 高寒草甸优势植物; 土壤; 氮磷含量; 氮磷比值
高原鼠兔(Ochotonacurzoniae)是青藏高原高寒草甸生态系统的关键组分,其密度变化必然引起高寒草甸生态系统其它组分的联动响应[1],而植物和土壤是应答高原鼠兔密度变化最直接的载体[2- 3]。当高原鼠兔密度适度时,其采食和挖掘活动改善了高寒草甸植物群落的顶级结构和土壤的致密结构,促进了植物吸收和利用光照、水分和养分的能力,提高光合速率和资源利用效率[4],优化群落结构,增加优良牧草比例[2]。然而当高原鼠兔密度极度扩张,且超过高寒草甸生态系统承载力阈值的上限时,其强大的采食能力和频繁的掘土活动迫使高寒草甸生态系统受损,表现为草甸植物群落高度和覆盖度降低,毒杂草丛生[1],土壤疏松,水土流失严重[5],演化为严重的鼠害[6],说明高原鼠兔对高寒草甸的作用随其密度变化而发生利害转变。在这种转变的过程中,植物和土壤具有一定的适配性,他们间相互作用、相互适应,协同变化[7],而这种协同演变程度和过程则决定了高寒草甸演变的方向,因此深刻阐明植物和土壤协调演变过程对明晰高原鼠兔在高寒草甸中的功能定位具有重要的意义。
植物和土壤协同变化时,其互作过程一定程度上取决于有机体不同元素的含量及其比值[8]。众多矿质元素中,氮(N)和磷(P)是植物生长的必须营养元素,也是各种蛋白质和遗传因子的重要组成部分[9],因此植物和土壤中N、P含量及其计量比影响植物群落内的种群密度和种间竞争格局,从而最终决定群落的演替方向[10]。植物叶片和土壤内的N、P含量往往随着土壤供给力和植物吸收能力的变化而变化。高寒草甸生态系统内土壤N主要来源于有机质分解,P主要来源于土壤母质,因此影响有机质分解和地表径流的因素均能引起土壤N和P含量的变化,进而影响植物叶片的N、P含量变化。高原鼠兔密度变化时土壤通气性会发生明显改变,从而影响土壤微生物活性,迫使土壤N含量发生一定程度的变化[2],地表盖度降低容易引起水土流失和矿质元素的下渗,从而改变P含量。目前关于高原鼠兔对高寒草甸作用的研究主要集中于其功能的分析[1,7],以及草甸植物群落特征和土壤性质随着高原鼠兔密度的变化规律[2- 5,11],但关于高原鼠兔作用下,植物有机体和土壤N、P含量及其比值变化的研究较少。高原鼠兔活动强度的变化势必引起土壤物理性质和植物生长状况的变化,而植物叶片N和P均来自于土壤供给,因此一定程度上植物叶片,特别是优势植物叶片的N和P含量及其比值反映土壤N和P的供给能力,N和P计量特征能够揭示植物生长受抑的现状,从而说明高原鼠兔密度多大时植物生长受N限制,或P限制,或者N和P共同限制。因此研究高原鼠兔密度变化过程中优势植物及土壤N和P计量特征的变化规律,有助于将高原鼠兔密度调控在其有益的范畴,避免密度过大成灾,这能够为维持高寒草甸生态系统健康提供信息。因此,本研究通过分析不同高原鼠兔密度下优势植物和土壤N、P含量,及其计量比变化特征,明晰植物和土壤协调变化过程中N、P含量及其计量比的关系,为全面阐明高原鼠兔对高寒草甸植物群落演变的影响提供科学依据。
1 研究地区概况与方法
1.1 研究区概况
研究地区位于青藏高原东端,行政区划隶属于甘肃省玛曲县境内,地理坐标为100°40′—102°29′ E,33°06′—34°30′ N。海拔介于3300至4806 m之间。气候属高寒湿润气候,长冬无夏,年相对无霜期仅19 d,无绝对无霜期。年均温度1.2 ℃, 月平均温度从1月份的-10 ℃到7月份的11.7 ℃,年降水量约564 mm,年日照时数约2613.9 h。植被类型主要是高寒草甸,占全县总面积的89.4%,植物群落内优势种主要是高山嵩草(Kobresiapygmaea),主要伴生种有垂穗披碱草(Elymusnutans),小花草玉梅(Anemonerivularisvar.flore-minore),矮藨草(Scirpuspumilus),羊茅(Festucaovina),米口袋(Gueldenstaedtiaverna),钝裂银莲花(Anemoneobtusiloba),蒲公英(Taraxacummongolicum)和长毛风毛菊(Saussureahieracioides)等。全县受鼠害危害的草地面积占总草地面积的比例30%左右,其中高原鼠兔是主要的危害鼠类,自20世纪70年代以来,高原鼠兔危害面积逐渐加大,单位面积有效洞穴数量逐渐增加[6],已经严重威胁高寒草甸生态系统的健康。
1.2 研究方法
1.2.1 试验设计和取样
受采食行为、营居方式和动物迁移特征的影响,直接度量高寒草甸内单位面积的高原鼠兔密度具有不确定性[2],因此,本研究采用有效洞口数代替高原鼠兔密度。有效洞口数越多,表示高原鼠兔密度越大,有效洞口数越少,表示高原鼠兔密度越低[3]。2012年5月份在玛曲县阿孜站地势相对一致的地块,选取了36个25 m×25 m (625 m2) 的样地,每个样地四角利用木桩做简单标记,用连续3d堵洞法测定各样地的有效洞口数,这些样地的坡度和坡向等立地条件基本接近。查清、测定每个样地内的高原鼠兔有效洞口数,裸斑面积比例和草丛高度。裸斑面积比例采用样地内所有裸斑的面积占据样地面积的百分数表示,样地内每个裸斑面积采用分割法求和;草丛高度采用随机测定群落内植物高度100次的平均值。高原鼠兔有效洞口数、裸斑面积和草丛高度作为变化因子,将36个样地聚类,结果分为4个类群,然后求出各个类群的平均值,其分别为10(10±3)、15(15±2)、21(21±3)、31(31±4),以这些平均值为基准,选择研究样地。每个梯度选择3个样地,作为重复,其余未被遴选的样地没有做进一步观测。然后将这些样地围栏,避免放牧对高原鼠兔作用的影响。采用“W”型布设5个1 m×1 m的观测样方,样方间隔约8 m,并对样方做出标记。2012年8月中旬,先完成各个样方内群落高度和盖度的测定,此时群落高度的测定采用样方内随机测定50次植物高度的平均值的方法,盖度采用点测法测定。然后将样方内所有优势种高山嵩草,主要伴生种垂穗披碱草和小花草玉梅分种齐地收割,其他物种另外收割。然后在高山嵩草、垂穗披碱草和小花草玉梅样品内挑选植株顶部的健康叶片,清洗叶片表面尘土,其他未挑选的叶片分别收集,然后将所有植物样品按照各自收集状况在105 ℃下杀青15 min后,65 ℃烘干至恒重。分别称量每个植物收割部分的干重,称重后将挑选的健康叶片粉碎后密封保存,以备分析。每个样方内3部分植物样品的总和作为群落生物量。在每个样方内随机打钻5次(梅花状,每钻之间的距离大于25 cm),按照0—10 cm和10—20 cm分层收集土壤样品,去除植物根、石头等杂质后,将每个样方内同一土层的土样混合保存。在室温下自然风干,充分研磨过0.25 mm的尼龙筛后密封保存,以备分析。
1.2.2 样品分析
植物和土壤N含量采用凯氏定氮法测定,植物和土壤P含量采用钼锑抗比色法测定[12]。
1.3 统计分析
采用SPSS 17.0统计软件处理数据,用One-Way ANOVA 进行单因素方差分析,若有显著差异,应用Duncan法对平均值进行多重比较,优势植物N和P含量与土壤N和P含量之间关系采用Two-tailed的Pearson相关性分析。
2 结果
2.1 高原鼠兔密度变化对草甸群落特征及优势种生物量的影响
高原鼠兔有效洞穴密度从10 个/625 m2增至31 个/625 m2时,高寒草甸群落的优势种仍然为高山嵩草,而主要伴生种依然为垂穗披碱草和小花草玉梅(表1),但不同有效洞穴密度下,次主要伴生种发生了一定的变化,从有效洞穴密度为10 个/625 m2时的秦艽(Gentianamacrophylla)和长毛风毛菊演变为31 个/625 m2时的黄帚橐吾(Ligulariavirgaurea)和矮金莲花(Trolliusfarreri)。随着高原鼠兔有效洞穴密度增加,高寒草甸群落总生物量变化不大,草丛高度先增加后降低,而盖度逐渐降低。
不同优势植物生物量随着高原鼠兔有效洞穴密度增加出现不同变化趋势(图1),表现为随有效洞穴密度增加,高山嵩草生物量逐渐降低,垂穗披碱草生物量先逐渐增加再下降,小花草玉梅生物量逐渐增加。
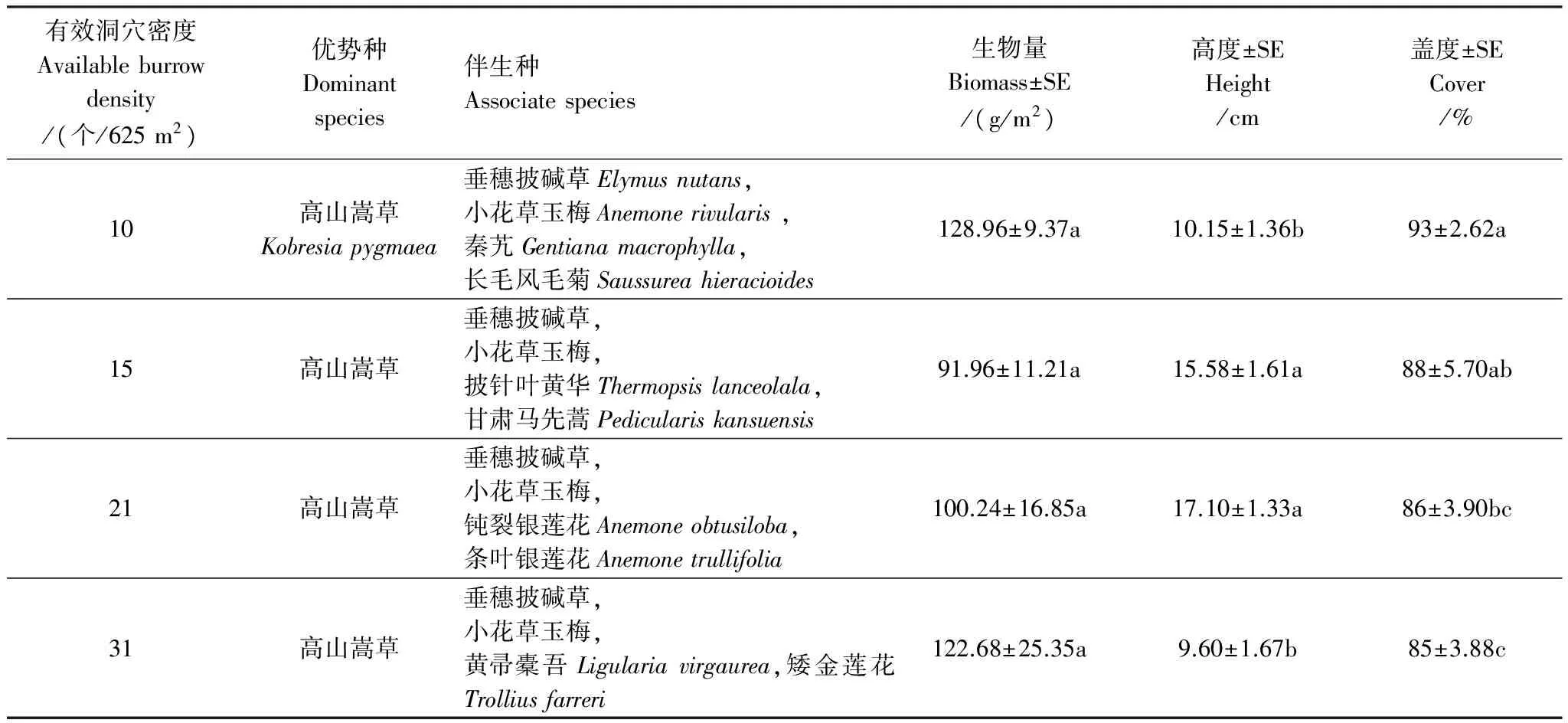
表1 高原鼠兔有效洞穴密度对高寒草甸群落特征的影响
SE,标准误差
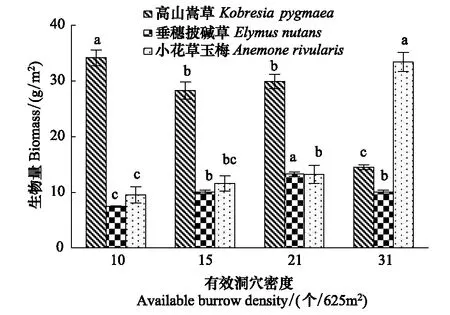
图1 高原鼠兔有效洞穴密度对高寒草甸优势植物叶片生物量的影响Fig.1 Effect of available burrow density of plateau pika on biomass of dominant plant leaves
2.2 高原鼠兔密度变化对优势植物叶片N和P化学特征的影响
2.2.1 高原鼠兔密度变化对优势植物叶片总N、P含量及其计量比的影响
3种优势植物叶片N、P含量及N∶P的算术平均值分别为16.8 mg/g、2.0 mg/g和8.8(表2)。N和P含量的变异系数接近,均为0.1,但低于N∶P的变异系数0.16。随高原鼠兔有效洞穴密度增加,优势植物叶片N和P含量均表现为先增加后趋于稳定的变化趋势,在有效洞穴密度为15 个/625 m2以上趋于稳定;3种优势植物的N∶P随高原鼠兔有效洞穴密度变化不明显。优势植物N含量的变异系数随有效洞穴密度增加而逐渐增加,P含量和N∶P的变异系数随着有效洞穴密度增加表现为先增加后降低,两者最大值均出现在有效洞穴密度为15 个/625 m2条件下,但有效洞穴密度从15 个/625 m2增加到21 个/625 m2时,P含量的变异系数没有发生明显变化,但N∶P的变异系数却出现明显的降低,这说明N、P含量及其计量比对高原鼠兔有效洞穴密度增加的响应存在一定的分异性,但整体上N∶P小于10。
2.2.2 高原鼠兔密度变化对不同优势植物N和P含量及其计量比的影响
随高原鼠兔有效洞穴密度增加,优势植物高山嵩草和垂穗披碱草叶片N含量先显著增加,然后具有降低的趋势(表3),在21 个/625 m2时最大(P<0.05),而小花草玉梅叶片N含量显著增加。但不同优势植物叶片的N含量随有效洞穴密度增加的幅度不一致,当有效洞穴密度从10 个/625 m2增至31 个/625 m2时,高山嵩草、垂穗披碱草和小花草玉梅叶片N含量增幅分别为4.76%,18.29%,26.52%,其中小花草玉梅增幅最大,高山嵩草最小。当有效洞穴密度为10 个/625 m2时,3种优势植物叶片N含量差异不大,而当有效洞穴密度超过15 个/625 m2时,垂穗披碱草和小花草玉梅叶片的N含量远远大于高山嵩草叶片的N含量。

表2 高原鼠兔有效洞穴密度对高寒草甸优势植物叶片N、P含量及N∶P的影响
AM: 算术平均数; CV: 变异系数; SE: 标准误差
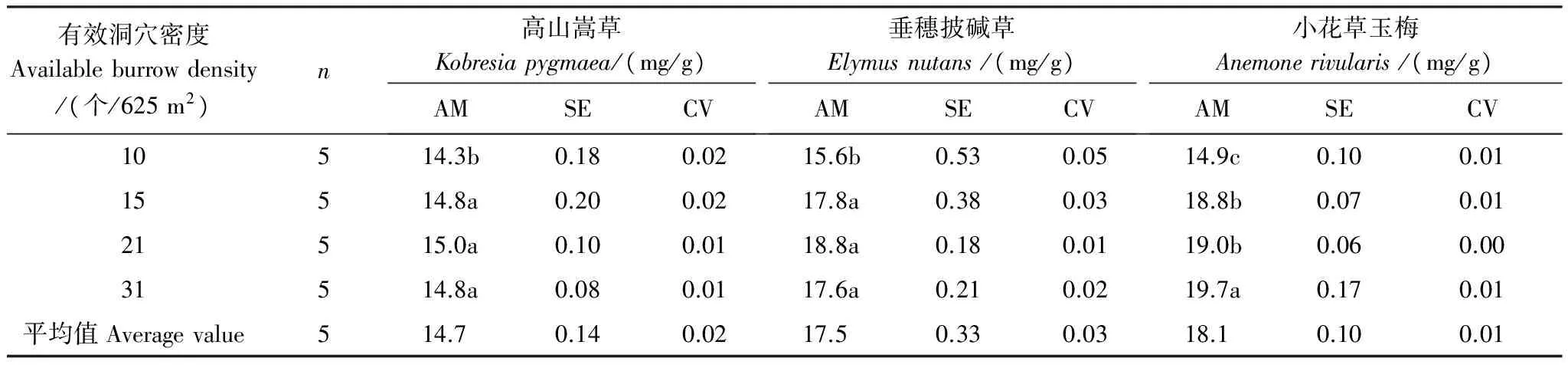
表3 高原鼠兔有效洞穴密度对不同优势植物叶片N含量的影响
AM: 算术平均数; CV: 变异系数; SE: 标准误差
优势植物叶片P含量随高原鼠兔有效洞穴密度增加出现分异(表4),表现为高山嵩草和垂穗披碱草随有效洞穴密度增加而先显著增加后逐渐降低(P<0.05),而小花草玉梅则表现为逐渐显著增加的趋势(P<0.05)。当有效洞穴密度为10 个/625 m2时,垂穗披碱草叶片P含量大于高山嵩草和小花草玉梅叶片P含量,后两者基本接近,当有效洞穴密度增为15个/625 m2时,高山嵩草叶片P含量增加到和垂穗披碱草叶片P含量接近的水平,而当有效洞穴密度为31 个/625 m2时,小花草玉梅叶片P含量也增加至和高山嵩草以及垂穗披碱草接近的水平。
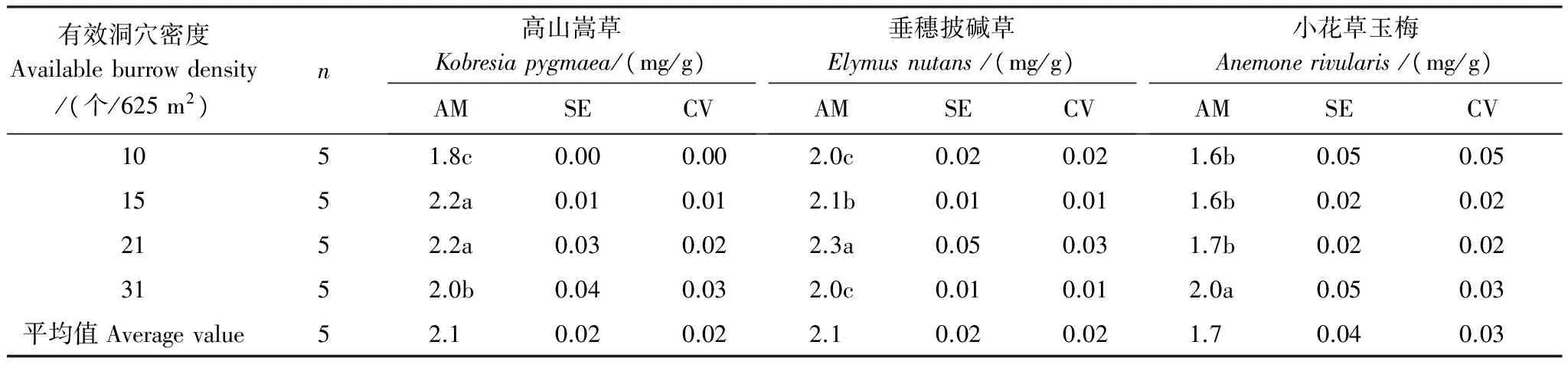
表4 高原鼠兔有效洞穴密度对不同优势植物叶片P含量的影响
AM: 算术平均数; CV: 变异系数; SE: 标准误差
3种优势植物叶片N、P含量随高原鼠兔有效洞穴密度增加的过程并不一致,导致3种优势植物N∶P随高原鼠兔有效洞穴密度增加的变化过程出现一定的分异性,其中高山嵩草叶片的N∶P随有效洞穴密度增加而显著降低(P<0.05),垂穗披碱草叶片的N∶P逐渐增加,而小花草玉梅叶片N∶P表现为先增加后降低的趋势(表5)。相同有效洞穴密度下,小花草玉梅叶片的N∶P大于高山嵩草和垂穗披碱草叶片的N∶P,高山嵩草叶片N∶P和垂穗披碱草叶片N∶P的关系受有效洞穴密度约束,当有效洞穴密度为10 个/625 m2时两者基本接近,而当有效洞穴密度大于15 个/625 m2时,垂穗披碱草叶片的N∶P要大于高山嵩草叶片的N∶P。高山嵩草和垂穗披碱草叶片N∶P在4个有效洞穴密度下均小于10,但小花草玉梅叶片的N∶P在最低和最高有效洞穴密度时小于10,而有效洞穴密度在15 个/625 m2时和21 个/625 m2时则大于10。

表5 高原鼠兔有效洞穴密度对不同优势植物叶片N∶P比值的影响
AM: 算术平均数; CV: 变异系数; SE: 标准误差
2.3 高原鼠兔密度变化对土壤N和P化学特征的影响
2.3.1 高原鼠兔密度变化对土壤总N、P含量及其计量比的影响
研究结果表明,土壤中N、P含量及N∶P的算数平均值分别为3.5 mg/g、1.1 mg/g和3.4(表6)。其中N含量的变异系数与N∶P比值较接近,分别为0.14和0.15,而P含量的变异系数小于N含量和N∶P的变异系数,为0.09。随着高原鼠兔有效洞穴的增加,土壤N含量没有明显的变化,P含量与有效洞穴密度的关系不具规律性,而N∶P则表现为逐渐增加的趋势(P<0.05)。

表6 高原鼠兔有效洞穴密度对土壤N、P含量及N∶P的影响
AM,算术平均数; CV,变异系数; SE,标准误差
2.3.2 高原鼠兔密度变化对不同土层土壤中总N和P含量及其计量比的影响
随高原鼠兔有效洞穴密度增加,0—10 cm和10—20 cm土层中N含量虽然表现为逐渐增加的趋势,但没有达到显著水平(表7)。相同有效洞穴密度下,0—10 cm土层N含量及其变异系数大于10—20 cm土层N含量及其变异系数。
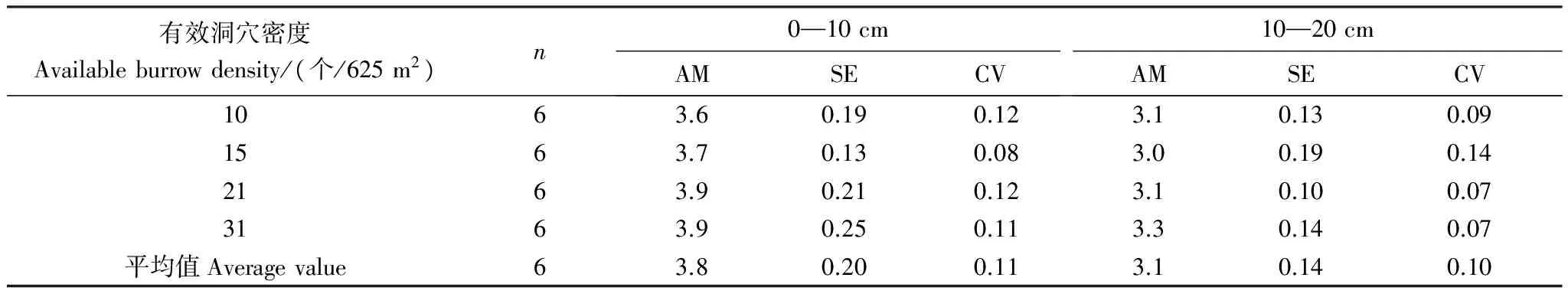
表7 高原鼠兔有效洞穴密度对不同土层N含量的影响/(mg/g)
AM: 算术平均数; CV: 变异系数;SE: 标准误差
高原鼠兔有效洞穴密度的变化对0—10 cm和10—20 cm土层P含量的影响具有一定的差异(表8),表现为0—10 cm土层P含量随有效洞穴密度增加虽然具有先降低后增加的趋势,但差异不显著,而10—20 cm土层P含量具有降低趋势,在31 个/625 m2时最低。土壤0—10 cm土层P含量及其变异系数和10—20 cm土层P含量及其变异系数差异不明显。
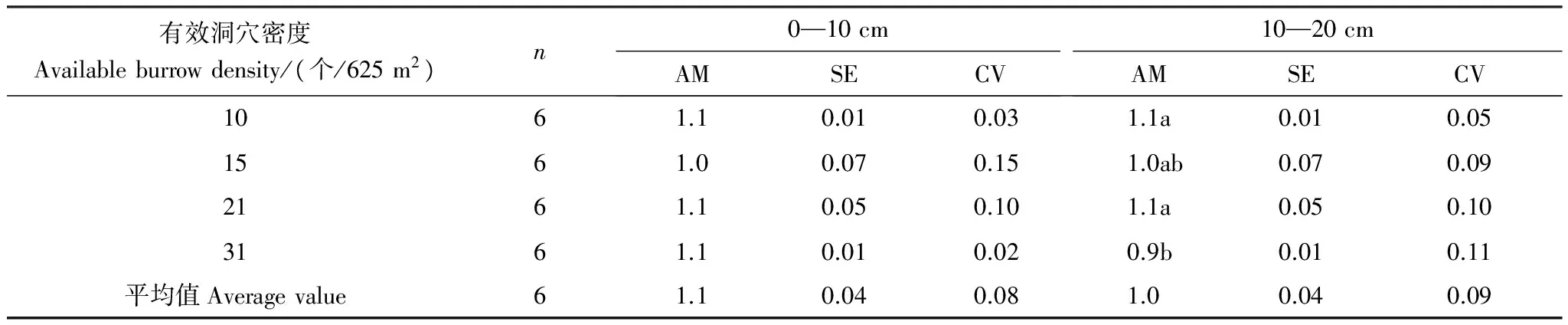
表8 高原鼠兔有效洞穴密度对不同土层P含量的影响/(mg/g)
AM: 算术平均数; CV: 变异系数; SE: 标准误差
高原鼠兔有效洞穴密度变化对0—10 cm土层的N∶P没有明显影响,但10—20 cm土层N∶P随高原鼠兔有效洞穴密度增加具有增加的趋势(表9)。0—10 cm土壤N∶P及其变异系数大于10—20 cm土壤N∶P及其变异系数。

表9 高原鼠兔有效洞穴密度对不同土层N∶P的影响
AM: 算术平均数; CV: 变异系数; SE: 标准误差
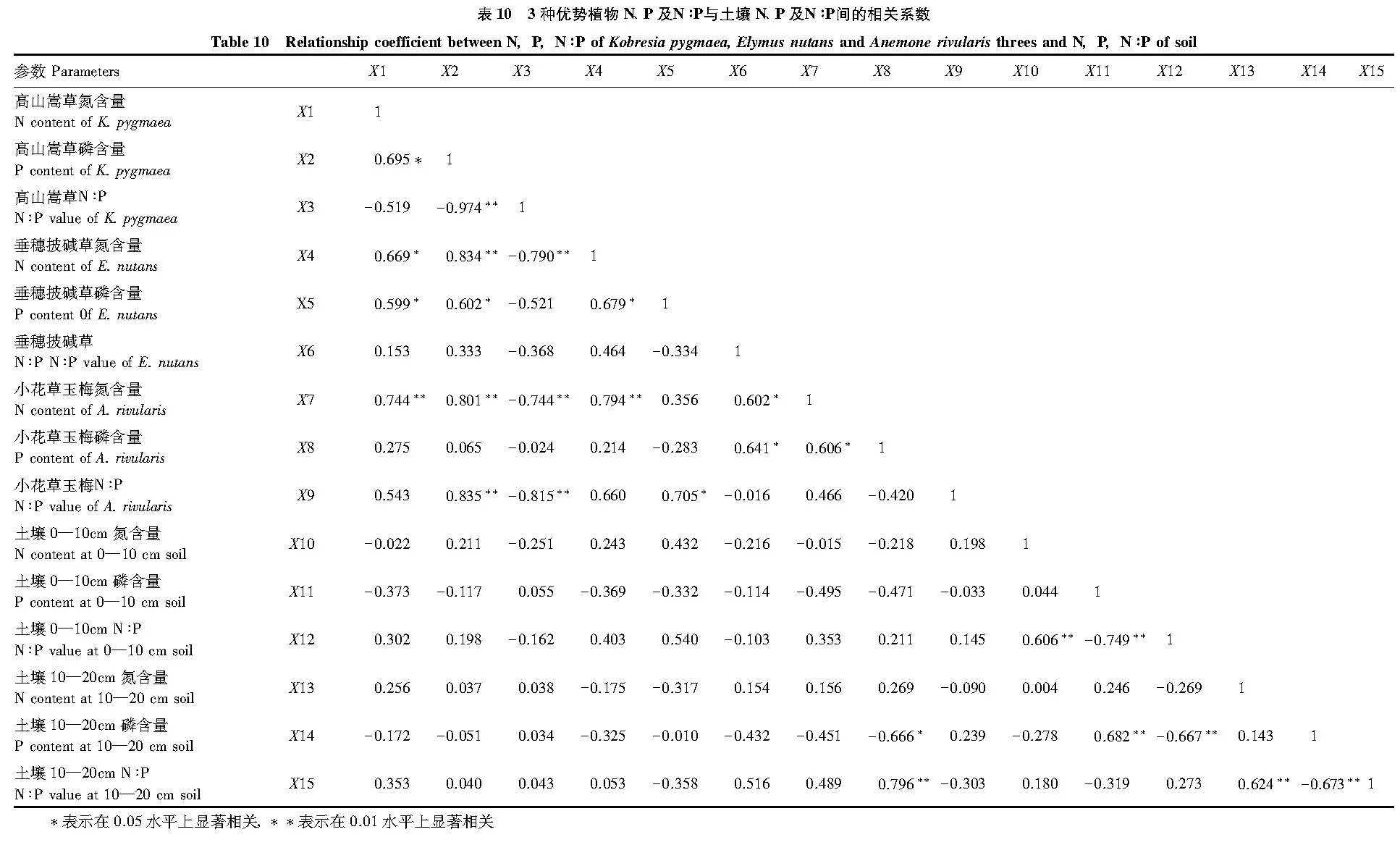
2.4 优势植物叶片N、P、N∶P与土壤N、P、N∶P的相关性
相关分析结果表明,3种优势植物叶片N、P含量及其N∶P与土壤N、P含量及其N∶P的相关性具有一定的差异(表10)。高山嵩草叶片N、P含量及N∶P分别与0—10 cm土层N、P含量及N∶P呈负相关,与10—20 cm土层N含量及N∶P呈正相关,但与10—20 cm土层P含量为负相关。垂穗披碱草叶片N含量与0—10 cm土层N含量呈正相关,而P含量和N∶P与0—10 cm土层的P含量和N∶P呈负相关;垂穗披碱草叶片N和P含量与10—20 cm土层N和P含量表现为负相关,而N∶P则与10—20 cm土层N∶P为正相关。小花草玉梅叶片N和P含量与0—10 cm土层N和P含量为负相关,而N∶P却与0—10 cm土层N∶P为正相关;小花草玉梅叶片N含量与10—20 cm土层N含量为正相关,P含量和N∶P与10—20 cm土层P含量和N∶P为负相关。
3 讨论
3.1 高原鼠兔有效洞穴密度与高寒草甸变化间的关系
高原鼠兔通过挖掘活动会在洞口形成星罗棋布的小块裸斑,镶嵌于高寒草甸,降低其地表盖度[2],改变了原有高寒草甸地表吸收和辐射热量的过程[13],客观上改变了高寒草甸原有生境的特点[1],而这些裸斑为以种子繁殖为主的阔叶草种入侵创造了条件[4]。同时,高原鼠兔采食行为打破了原生高寒草甸群落内种群间竞争格局后,一部分植物的生长潜势受到抑制,另一部分植物的生长潜势得到释放,垂穗披碱草和草地早熟禾(Poapratensis)在原生高寒草甸群落内一直受高山嵩草的抑制,但随着高原鼠兔密度逐渐增加,其在群落内的比例逐渐增加[3]。研究结果表明,高原鼠兔有效洞穴密度变化对高寒草甸群落总生物量虽然存在一定的影响,但差异不显著,这与高原鼠兔对青海果洛地区高寒草甸群落生物量的影响不一致[3],主要原因可能是不同地区高寒草甸群落的主要伴生种不同,这种差异取决于海拔分异所引起的水热组合变化,青海果洛地区海拔高,气温低,植物生产速率较研究地区植物生长速率低,说明高原鼠兔有效洞穴密度变化对高寒草甸群落初级生产力的影响随着群落组分和海拔变化存在分异。研究结果发现,3种优势植物种群生物量随着高原鼠兔有效洞穴密度增加的变化趋势不同,当高原鼠兔有效洞穴密度从10 个/625 m2增加至21 个/625 m2时,垂穗披碱草生物量增幅高达56%以上,高山嵩草生物量降幅仅为11%,小花草玉梅生物量变化不大,说明适量的高原鼠兔有效洞穴密度可以优化高寒草甸群落结构,增加优良牧草比例,改良高寒草甸品质,这与青海果洛地区的研究结果一致[3]。但当高原鼠兔有效洞穴密度达31个/625 m2时,垂穗披碱草生物量较10 个/625 m2时仅增加了17%,小花草玉梅生物量较10 个/625 m2时增至3.5倍以上,高山嵩草生物量较10 个/625 m2时却降低了57%,说明高寒草甸群落组分已经劣化。当高原鼠兔有效洞穴密度介于15 个/625 m2与21 个/625 m2之间时,高寒草甸群落结构较密度较低时有所优化,优良牧草比例增加;高原鼠兔有效洞穴密度超过21 个/625 m2时,高寒草甸植物群落结构逐渐劣化,草甸品质降低。因此,高原鼠兔有效洞穴密度的最佳阈值应该是15 个/625 m2到21 个/625 m2。
3.2 高原鼠兔有效洞穴密度与高寒草甸优势植物和土壤N、P含量及其计量比的关系
高原鼠兔有效洞穴密度的变化迫使高寒草甸植物组分和土壤发生协同变化,以适应变化后的生境,这种协同适应新生境的过程一定程度上取决于有机体不同元素含量及其比值[3],其中N、P含量及其比值是影响植物种群密度和种间竞争格局的重要因子[10],这是因为N是植物蛋白质、叶绿素和多种酶的重要组分[14],P是能量代谢、核酸及其膜合成的重要底物[8]。本研究结果表明,高寒草甸的3种优势植物高山嵩草、垂穗披碱草和小花草玉梅叶片内N、P含量及N∶P算术平均值分别为16.8 mg/g、2.0 mg/g和8.8,其中N含量小于全球尺度植物叶片平均值(20.1 mg/g)[15]和西藏地区植物叶片平均值(28.6 mg/g)[16],P含量与全球尺度和西藏地区植物叶片P含量的平均值(分别为1.8 mg/g和1.9 mg/g)接近,N∶P小于全球尺度和西藏地区植物叶片的平均值(全球尺度和西藏地区分别是13.8和15.7)[14- 15]。优势植物叶片N含量低主要与采样时间和土壤供给能力有关。青藏高原地区优势植物生长末期叶片N含量相对较高,超过20.0 mg/g[17- 18], 而本研究的取样时间是7月中旬,正值高寒草甸植物生长旺盛季节,叶片生物量迅速增加,营养元素逐渐稀释[19- 20],导致叶片N含量较低,这与吴统贵等人[21]对草地植物海三棱藨草(Scirpusmariqueter)、糙叶薹草(Carexscabrifolia)和芦苇(Phragmitesaustralis)叶片N含量的研究结果类似。7月份优势植物叶片较低的N含量,导致了叶片N∶P较低。N∶P被用来判断植物生长受限因子,当N∶P小于14时,植物生长状况受N限制较大,当N∶P大于16时,则植物生长状况受P制约较大,当N∶P介于14和16之间时,则植物生长状况受到N和P的共同限制[22- 23]。本研究中高寒草甸植物N∶P比值小于10,说明植物生长主要受到N限制,而中国753种陆地植物生长整体受P限制[9],这种分异性与研究地区的气候特征密切相关,青藏高原地区土壤温度低,微生物活性受抑,有机质分解慢且时间短[2],虽然土壤有机质含量较高,但其分解速率较慢,因而土壤N含量较低,这可能是研究地区植物生长受N限制的主要原因。3种优势植物叶片N含量均随高原鼠兔有效洞穴密度增加而逐渐增加,主要是高原鼠兔采食植物叶片组织后,促进了植物再生生长,植物新生的幼嫩组织发达[18],富含叶绿素,而N是叶绿素的主要组成成分[24]。因此,随有效洞穴密度的增加,植物叶片在高原鼠兔长期采食过程中,经过补偿生长一直处于幼嫩状态[25- 26],从而增加了叶片N含量。3种优势植物P含量随高原鼠兔有效洞穴密度增加变化趋势出现分异,高山嵩草和垂穗披碱草表现为先增加后降低,而小花草玉梅则表现为逐渐增加,这可能与不同物种P利用策略有关,也可能与不同物种的生物学习性有关,高山嵩草和垂穗披碱草根系丛状,叶片为条叶状[27- 28],而小花草玉梅根系为直根系,叶片为阔叶[29],植物种间的形态学特征与其利用P策略的关系还需要深入研究。优势植物叶片P含量随高原鼠兔有效洞穴密度变化的分异导致了其N∶P的分异,其中高山嵩草叶片N∶P随有效洞穴密度增加表现为先降低后增加,垂穗披碱草叶片N∶P逐渐增加,小花草玉梅叶片N∶P为先增加后降低,这说明不同物种在利用N、P的过程中生态位出现了分化,使群落内部不同优势植物采用不同养分利用和消费策略,以实现激烈竞争状态下的物种共存[14]。优势植物化学计量学特征在一定程度上能够指示物种更替以及群落演替方向[30],因此适量的高原鼠兔有效洞穴可减轻优良牧草生长受N限制程度,增加不可食牧草受N限制程度,促进优良牧草生长,抑制不可食牧草生长,但当高原鼠兔密度过大时,优良牧草受N限制程度反而加剧,而不可食牧草受N限制程度有所减轻。因此当高原鼠兔有效洞穴密度从10 个/625 m2增加至21 个/625 m2时,高寒草甸植物群落处于正向演替阶段,而有效洞穴密度超过21 个/625 m2时,高寒草甸群落则处于逆向演替阶段。
本研究结果表明土壤N和P含量平均值分别为3.5 mg/g和1.1 mg/g,这和王长庭等人在青海省果洛地区研究结果基本一致[31],另外N含量与内蒙古呼伦贝尔草地土壤N含量接近,但P含量却低于呼伦贝尔草地土壤P含量[32],主要是青藏高原地区为水源区,降雨次数和量相对于内蒙古呼伦贝尔地区要多且大,因此青藏高原地区草地地表径流形成的次数相对于呼伦贝尔地区要频繁的多,这可能增加了土壤P的流失,从而降低了土壤P含量。土壤0—10 cm层的N含量大于10—20 cm土壤N含量,而P含量差异不大,这与N、P来源不同有关。土壤N含量主要来源于有机质分解,而土壤浅层较土壤深层具有较多的有机质来源,地表较高的温度加速了微生物分解有机质的能力,从而导致浅层N含量较深层N含量高;而P主要来源于土壤母质,因此浅层和深层差异不是很大[33]。研究地区土壤N∶P为3.4,这小于青海海北地区高寒草甸[34]和内蒙古锡林郭勒盟地区[30]土壤的N∶P,但与甘肃兴隆山地区[35]的研究结果一致,说明不同地区土壤N∶P存在一定的差异,这种差异与不同地区土壤的N、P含量不同密切相关。高原鼠兔有效洞穴密度增加对0—10 cm和10—20 cm土层N含量没有明显影响,但对不同土层P含量产生一定的影响,表现为0—10 cm土层P含量先降低后增加,10—20 cm土层P含量逐渐降低,说明高原鼠兔的活动改变了土壤P含量。然而,有效洞穴密度增加对0—10 cm的N∶P没有明显的影响,但增加了10—20 cm土层N∶P,这可能与高原鼠兔活动对不同土层P含量的改变程度存在差异有关。土壤表层P容易受到径流影响,其随有效洞穴密度增加流失量也有所增加,土壤深层P含量受地表径流的影响相对较少,因此表现出有效洞穴密度对浅层N∶P影响不明显,而对深层土壤N∶P影响明显;土壤表层P含量可能受有效洞穴密度和地表径流双重因素,而深层土壤P含量则主要与有效洞穴密度有关。因此地表径流和高原鼠兔有效洞穴密度一起影响土壤P的供给。
3.3 青藏高原优势种植物的N、P含量与土壤N、P含量的相关关系
高山嵩草叶片N含量及其N∶P与10—20 cm土壤层N含量及其N∶P正相关,垂穗披碱草叶片N∶P与10—20 cm土壤层N∶P正相关,小花草玉梅叶片N∶P与0—10 cm土壤层N∶P正相关,小花草玉梅叶片N含量与10—20 cm土壤层N含量正相关,而P及其N∶P与土壤P及其N∶P负相关,这与不同植物根系分布位置密切相关。高山嵩草在浅层土壤内根系致密,根土比较大[36],根系吸收部位比实际接触的土壤表面积较小,而深层根系根土比较小,这增加了根系吸收部分与土壤接触的面积,从而表现出深层土壤N和P含量与植物叶片的关系更加密切。垂穗披碱草和高山嵩草混生,浅层根系受高山嵩草根系的制约,吸收能力非常有限,只有深入到深层的根系才能吸收大量的矿质元素,垂穗披碱草根系较高山嵩草根系要深的多,最深可达88—100 cm[28]。小花草玉梅主要生长于高山嵩草竞争力相对较弱的生境或裸斑上[29],这样其根系既能吸收浅层土壤的养分,又能吸收深层土壤的养分,因此表现出其叶片内N含量与浅层和深层土壤N含量均显示为正相关。
高原鼠兔有效洞穴密度变化改变了高寒草甸生境,而高寒草甸群落内植物种群需要重新适应这种新的生境,但不同植物种群的适应性存在差异,这种差异性最终左右了高寒草甸的演变趋势。通过分析土壤、优势植物叶片N、P含量与高原鼠兔有效洞穴密度间的协同变化过程发现,当高原鼠兔有效洞穴密度介于15 个/625 m2和21 个/625 m2之间时,高寒草甸组分趋向优化,从草甸利用角度应属于正向演替,而当高原鼠兔有效洞穴密度超过21 个/625 m2时,高寒草甸趋向劣化,从草甸利用角度应属于逆向演替。
[1] Zhou X R, Guo Z G, Guo X H. The role of plateau pika and plateall zokor in alpine meadow. Pratacultural Science, 2010, 27(5):38- 44.
[2] Guo Z G, Zhou X R, Hou Y. Effect of available burrow densities of plateau pika (Ochotonacurzoniae) on soil physicochemical property of the bare land and vegetation land in the Qinghai-Tibetan Plateau. Acta Ecologica Sinica, 2012, 32(2): 104- 110.
[3] Guo Z G, Li X F, Liu X Y, Zhou X R. Response of alpine meadow communities to burrow density changes of plateau pika (Ochotonacurzoniae) in the Qinghai-Tibet Plateau. Acta Ecologica Sinica, 2012, 32(1): 44- 49.
[4] Sun F D. Effects of Burrowing Plateau Pika (Ochotonacurzoniae) Densities on Primary Productivity and Soil Resource Characteristics in Alpine Meadow [D]. Lanzhou: Gansu Agricultural University, 2008.
[5] Han T H, Zhang W G, Ding L S. Features of vegetation inMyospalaxbaileyihabitat. Acta Prataculturae Sinica, 1999, 8(2): 43- 49.
[6] Zhang J.Population of Plateau Pika Response to Regulated Measures of Vegetation [D]. Lanzhou: Lanzhou University, 2011.
[7] Smith A T, Foggin J M. The plateau pika (Ochotonacurzoniae) is a keystone species for biodiversity on the Tibetan plateau. Animal Conservation, 1999, 2(4): 235- 240.
[8] Schimel D S. All life is chemical. BioScience, 2003, 53(5): 521- 524.
[9] Han W X, Fang J Y, Guo D L, Zhang Y. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377- 385.
[10] Wu W, He X D, Zhou Q X. Review on N: P Stoichiometry in eco-system. Journal of Desert Research, 2010, 30(2): 296- 302.
[11] Liu W, Zhang Y, Wang X, Zhao J Z, Xu Q M, Zhou L.Caching selection by plateau pika and its biological significance. Acta Theriologica Sinica, 2009, 29(2): 152- 159.
[12] Liu G S, Jiang N H, Zhang L D. Soil Physical and Chemical Analysis and Description of Soil Profile. Beijing: Standards Press of China, 1996.
[13] Li D M, Guo Z G, An L Z. Assessment on vegetation restoration capacity of several grassland ecosystems under destroyed disturbance in permafrost regions of Qinghai-Tibet Plateau. Chinese Journal of Applied Ecology, 2008, 19(10): 2182- 2188.
[14] Güsewell S. N: P ratios in terrestrial plants: variation and functional significance. New Phytologist, 2004, 164(2): 243- 266.
[15] Reich P B, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001- 11006.
[16] He J S, Wang L, Flynn D F B, Wang X P, Ma W H, Fang J Y. Leaf nitrogen: phosphorus stoichiometry across Chinese grassland biomes. Oecologia, 2008, 155(2): 301- 310.
[17] Yang K, Huang J H, Dong D, Ma W H, He J S.Canopy leaf N and P stoichiometry in grassland communities of Qinghai-Tibetan Plateau, China. Chinese Journal of Plant Ecology, 2010, 34(1): 17- 22.
[18] Jia T T, Yuan X X, Zhao H, Yang Y T, Luo K J, Guo Z G. Effects of grazing intensity on N and P content and its stoichiometry of dominant plants and soil in the northeast regions of Qinghai-Tibetan plateau. Chinese Journal of Grassland, 2013, 35(6): 80- 85.
[19] Townsend A R, Cleveland C C, Asner G P, Bustamante M M C. Controls over foliar N: P ratios in tropical rain forests. Ecology, 2007, 88(1): 107- 118.
[20] Yan Q, Lu J J, He W S. Succession character of salt marsh vegetations in Chongming Dongtan wetland. Chinese Journal of Applied Ecology,2007, 18(5): 1097- 1101.
[21] Wu T G, Chen B F, Xiao Y H, Pan Y J, Chen Y, Xiao J H. Leaf stoichiometry of trees in three forest types in Pearl River Delta, South China. Chinese Journal of Plant Ecology, 2010, 34(1): 58- 63.
[22] Elser J J, Acharya K, Kyle M, Cotner J, Makino W, Markow T, Watts T, Hobbie S, Fagan W, Schade J, Hood J, Sterner R W. Growth rate stoichiometry couplings in diverse biota. Ecology Letters, 2003, 6(10): 936- 943.
[23] Drenovsky R E, Richards J H. Critical N: P values: predicting nutrient deficiencies in desert shrublands. Plant and Soil, 2004, 259(1/2): 59- 69.
[24] Ding X H, Gong L, Wang D B, Wu X, Liu G H. Grazing effects on eco-stoichiometry of plant and soil in Hulunbeir, Inner Mongolia. Acta Ecologica Sinica, 2012, 32(15): 4722- 4730.
[25] Ma H B, Xie Y Z. Plant compensatory growth under different grazing intensities in desert steppe. Scientia Agricultura Sinica, 2008, 41(11): 3645- 3650.
[26] Oesterheld M, McNaughton S J. Effect of stress and time for recovery on the amount of compensatory growth after grazing. Oecologia, 1991, 85(3): 305- 313.
[27] Cui Y.Ecoanatomical Study onKobresiawilld. of Eastern Qinghai-Tibet Plateau [D]. Lanzhou: Northwest Normal University, 2006.
[28] Yan X B, Guo Y X, Zhou H, Wang K. Current status of research on classification and genetic diversity ofElymusspecies. Pratacultural Science, 2005, 22(7): 1- 7.
[29] Chang H L, Ren Y, Feng L T. Morphological observations on metamorphosed sepals inAnemonerivularisvar.flore-minore. Acta Phytotaxonomica Sinica, 2005, 43(3): 225- 232.
[30] Yin X R, Liang C Z, Wang L X, Wang W, Liu Z L, Liu X P. Ecological stoichiometry of plant nutrients at different restoration succession stages in typical steppe of Inner Mongolia, China. Chinese Journal of Plant Ecology, 2010, 34(1): 39- 47.
[31] Wang C T, Long R J, Wang Q J, Jing Z C, Shang Z H, Ding L M. Distribution of organic matter nitrogen and phosphorus along an altitude gradient and productivity change and their relationships with environmental factors in the Alpine meadow. Acta Prataculturae Sinica, 2005, 14(4): 15- 20.
[32] Ding X H, Luo S Z, Liu J W, Li K, Liu G H. Longitude gradient changes on plant community and soil stoichiometry characteristics of grassland in Hulunbeir. Acta Ecologica Sinica, 2012, 32(11): 3467- 3476.
[33] Wei X H, Li S, Yang P, Chen H S.Changes of soil physical and chemical property of alpineKobresiameadow around the plateau pika entrances in the process of erosion. Chinese Journal of Grassland, 2006, 28(4): 24- 29.
[34] Wang C T, Long R J, Cao G M, Wang Q L, Jing Z C, Shi J J. The relationship between soil nutrients and diversity---productivity of different type grasslands in alpine meadow. Chinese Journal of Soil Science, 2008, 39(1): 1- 8.
[35] Wei Q, Ling L, Chai C S, Zhang G Z, Yan P B, Tao J X, Xue R. Soil physical and chemical properties in forest succession process in Xinglong Mountain of Gansu. Acta Ecologica Sinica, 2012, 32(15): 4700- 4713.
[36] Wang C T, Long R J, Liu W, Wang Q L, Zhang L, Xiang Z Y. Vegetation roots and soil physical and chemical characteristics in degeneration succession of theKobresiapygmaeameadow. Ecology and Environmental Sciences, 2012, 21(3): 409- 416.
参考文献:
[1] 周雪荣, 郭正刚, 郭兴华. 高原鼠兔和高原鼢鼠在高寒草甸中的作用. 草业科学, 2010, 27(5): 38- 44.
[4] 孙飞达. 高原鼠兔洞穴密度对高寒草甸初级生产力及土壤特性的影响 [D]. 兰州: 甘肃农业大学, 2008.
[5] 韩天虎, 张卫国, 丁莲生. 高原鼢鼠栖息地的植被特征. 草业学报, 1999, 8(2): 43- 49.
[6] 张军. 高原鼠兔种群数量对植被调控措施的响应 [D]. 兰州: 兰州大学, 2011.
[10] 邬畏, 何兴东, 周启星. 生态系统氮磷比化学计量特征研究进展. 中国沙漠, 2010, 30(2): 296- 302.
[11] 刘伟, 张毓, 王溪, 赵建中, 许庆民, 周立. 高原鼠兔贮草选择及其生物学意义. 兽类学报, 2009, 29(2): 152- 159.
[12] 刘光崧, 蒋能慧, 张连第. 土壤理化分析与剖面描述. 北京: 中国标准出版社, 1996.
[13] 李东明, 郭正刚, 安黎哲. 青藏高原多年冻土区不同草地生态系统恢复能力评价. 应用生态学报, 2008, 19(10): 2182- 2188.
[17] 杨阔, 黄建辉, 董丹, 马文红, 贺金生. 青藏高原草地植物群落冠层叶片氮磷化学计量学分析. 植物生态学报, 2010, 34(1): 17- 22.
[18] 贾婷婷, 袁晓霞, 赵洪, 杨玉婷, 罗开嘉, 郭正刚. 放牧对高寒草甸优势植物和土壤氮磷含量的影响. 中国草地学报, 2013, 35(6):80- 85.
[20] 闫芊, 陆健健, 何文珊. 崇明东滩湿地高等植被演替特征. 应用生态学报, 2007, 18(5): 1097- 1101.
[21] 吴统贵, 陈步峰, 肖以华, 潘勇军, 陈勇, 萧江华. 珠江三角洲3种典型森林类型乔木叶片生态化学计量学. 植物生态学报, 2010, 34(1): 58- 63.
[24] 丁小慧, 宫立, 王东波, 伍星, 刘国华. 放牧对呼伦贝尔草地植物和土壤生态化学计量学特征的影响. 生态学报, 2012, 32(15): 4722- 4730.
[25] 马红彬, 谢应忠. 不同放牧强度下荒漠草原植物的补偿性生长. 中国农业科学, 2008, 41(11): 3645- 3650.
[27] 崔艳. 青藏高原东部嵩草属植物的生态解剖学研究 [D]. 兰州: 西北师范大学, 2006.
[28] 严学兵, 郭玉霞, 周禾, 王堃. 披碱草属植物分类和遗传多样性的研究现状. 草业科学, 2005, 22(7): 1- 7.
[29] 常鸿莉, 任毅, 冯鲁田. 小花草玉梅变态花萼片的形态学研究. 植物分类学报, 2005, 43(3): 225- 232.
[30] 银晓瑞, 梁存柱, 王立新, 王炜, 刘钟龄, 刘小平. 内蒙古典型草原不同恢复演替阶段植物养分化学计量学. 植物生态学报, 2010, 34(1): 39- 47.
[31] 王长庭, 龙瑞军, 王启基, 景增春, 尚占环, 丁路明. 高寒草甸不同海拔梯度土壤有机质氮磷的分布和生产力变化及其与环境因子的关系. 草业学报, 2005, 14(4): 15- 20.
[32] 丁小慧, 罗淑政, 刘金巍, 李魁, 刘国华. 呼伦贝尔草地植物群落与土壤化学计量学特征沿经度梯度变化. 生态学报, 2012, 32(11): 3467- 3476.
[33] 魏兴琥, 李森, 杨萍, 陈怀顺. 高原鼠兔洞口区侵蚀过程高山草甸土壤的变化. 中国草地学报, 2006, 28(4): 24- 29.
[34] 王长庭, 龙瑞军, 曹广民, 王启兰, 景增春, 施建军. 高寒草甸不同类型草地土壤养分与物种多样性——生产力关系. 土壤通报, 2008, 39(1): 1- 8.
[35] 魏强, 凌雷, 柴春山, 张广忠, 闫沛斌, 陶继新, 薛睿. 甘肃兴隆山森林演替过程中的土壤理化性质. 生态学报, 2012, 32(15): 4700- 4713.
[36] 王长庭, 王根绪, 刘伟, 王启兰, 向泽宇. 植被根系及其土壤理化特征在高寒小嵩草草甸退化演替过程中的变化. 生态环境学报, 2012, 21(3): 409- 416.
Effect of available burrow densities of plateau pika (Ochotonacurzoniae) on leaf nitrogen and phosphorus stoichiometry of dominant plants and soil in alpine meadow
LI Qianqian, ZHAO Xu, GUO Zhenggang*
StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
A field survey was conducted to determine the effect of available burrow densities of plateau pika with 10, 15, 21 and 31 per 625 m2on leaf nitrogen (N) and phosphorus (P) stoichiometry of dominant plants and soil of alpine meadow by using available burrow density substituting for activity degree of plateau pika in this study. The dominant plant includedKobresiapygmaea,ElymusnutansandAnemonerivularisvar.flore-minore. This study showed that the leaf N content ofK.pygmaea,E.nutansandA.Rivularissignificantly increased as the available burrow density increased (P<0.05). The leaf P content ofK.pygmaeaandE.Nutansfirstly increased and then significantly decreased (P<0.05), and leaf P ofA.Rivularisincreased gradually (P<0.05) with the increase of available burrow density. The leaf N∶P was different among three dominant plants, indicating that the leaf N∶P ofK.pygmaeasignificantly decreased (P<0.05), and the leaf N∶P ofE.nutansincreased gradually, but that ofA.Rivularisfirstly increased and then decreased as the available burrow density increased. This study also showed that the soil N content at 0—10 cm and at 10—20 cm layer was similar as the available burrow density increased. The soil P content at 0—10 cm layer firstly decreased and then increased, and that at 10—20 cm layer decreased with the increase of the available burrow density. The soil N∶P at 0—10 cm layer was similar and that at 10—20 cm layer increased gradually in the increasing process of available burrow density. This study suggested that the correlation relationship between leaf N, P, N∶P and soil N, P, N∶P was regulated by distribution features of plant root systems and microhabitat where plants grow.
available burrow density of plateau pika; dominant plant of alpine meadow; soil; nitrogen and phosphorus content; N∶P
国家自然科学基金(31172258); 国家科技支撑项目(2012BAD13B05); 兰州大学中央高校基本科研业务费(lzujbky- 2012- 93)
2013- 05- 07;
2013- 11- 04
10.5846/stxb201305070975
*通讯作者Corresponding author.E-mail: guozhg@lzu.edu.cn
李倩倩,赵旭,郭正刚.高原鼠兔有效洞穴密度对高寒草甸优势植物叶片和土壤氮磷化学计量特征的影响.生态学报,2014,34(5):1212- 1223.
Li Q Q, Zhao X, Guo Z G.Effect of available burrow densities of plateau pika (Ochotonacurzoniae) on leaf nitrogen and phosphorus stoichiometry of dominant plants and soil in alpine meadow.Acta Ecologica Sinica,2014,34(5):1212- 1223.

