医用测量、控制和实验室电气设备的风险管理
梁振士,刘 毅,孙京昇,刘 培
(北京市医疗器械检验所,北京101111)
医用测量、控制和实验室电气设备的风险管理
梁振士,刘 毅,孙京昇,刘 培
(北京市医疗器械检验所,北京101111)
本文立足于医用测量、控制和实验室电气设备特殊性,按照IEC61010-1标准第三版和ISO14971标准的要求,给出了该类产品涉及的风险范围、风险管理过程及实施方法。
医用测量;控制和实验室电气设备;风险管理
0 引言
医用测量、控制和实验室电气设备对应的第三版基础安全标准IEC61010:2010《测量、控制和实验室用电气设备的安全要求第1部分:通用要求》已经在美国、欧洲实施,国内正在进行该版标准的转化工作。该版标准与第二版的一个显著差异在于增加了风险评定的要求,并指出评估方法可以采用基于不同的标准,如ISO/IEC Guide51、ISO14971、SEMI S10、IEC61508、EN1050等。ISO14971提供了管理医疗器械使用相关的风险的框架,国内已将其转化为YY/T0316-2008,该标准是制造商建立风险管理原则和过程的指南。本文结合医用测量、控制和实验室电气设备特殊性和IEC61010第三版对风险管理的要求,按照IS014971规定的方法,给出对该类设备进行风险评估的相关内容和方法。
1 风险的范围
医用测量、控制和实验室电气设备在医疗过程中可能会用于对人体样本进行采集、制备和分析,或者对接触患者的物品进行清洗、消毒,还可能会控制医用设备对患者进行诊断治疗。在此过程中,设备会产生电气、机械、着火、辐射等对操作者和周围环境设施的直接的、物理方面的风险。此外,设备的误用,不准确的分析结果,不充分的消毒,不适当的控制,均可能导致对患者的损害。产生这些风险的原因可能存在于产品设计、安装和使用的各个环节中。因而医用测量、控制和实验室电气设备的风险判定应着眼于产品的整个生命周期,充分考虑对患者、操作者及周围设施的风险,包括预期使用和可合理预见的误用情况下的风险。
2 风险管理的过程
医用测量、控制和实验室电气设备风险管理的过程应符合ISO14791(YY/T0316)的要求,具体过程如图1所示。
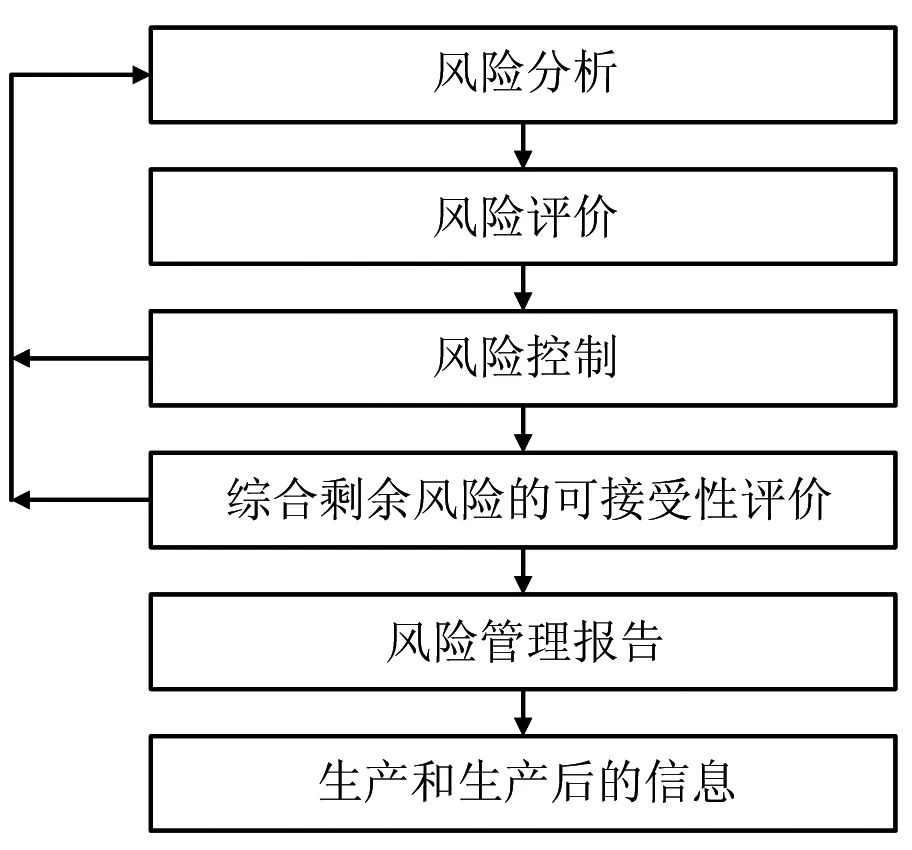
图1 风险管理过程示意图
(1)风险分析:通过现有资料,对产品的预期用途和与安全有关的特征进行分析,包括在合理可预见的误用情况下的产品特征。然后,识别出在正常和故障情况下,与产品安全相关的危害(hazard)和危害处境。在每一个危害处境下,采用定量或定性的方法对损害(harm)的发生概率和严重程度进行分析,以估计该危害处境下的一个或多个风险。
(2)风险评价:根据风险管理计划的准则,决定是否需要采取措施降低风险。
(3)风险控制:针对风险评价后需要降低风险的危害处境采取措施,以降低风险或将风险控制在规定的水平。
(4)综合剩余风险的可接受性评价:制造商在所有风险控制措施已经实施并验证后,根据风险管理计划中的准则,决定产品的综合剩余风险是否都可以被接受。综合剩余风险可接受时,制造商确认哪些信息应记入产品的随机文件,以便公示剩余风险。需要说明的是,若此时综合剩余风险被认为不可接受,制造商还可对有关资料和文献进行收集、评审,以确定预期使用收益是否超过综合剩余风险,若证据表明使用收益超过综合剩余风险,则综合剩余风险仍可被接受。
(5)风险管理过程评审:在产品即将销售前,制造商对整个风险管理过程的实施情况所做的评审,以确保风险控制计划有效实施且综合剩余风险已在可接受的水平。
(6)信息生产和生产后信息的收集与处理:制造商通过监测产品在市场上是否有新的危害出现或是否有风险变得不可接受。若有此类信息,则应对风险控制过程包括风险控制措施重新评价。
3 医用测量、控制和实验室电气设备风险管理的实施
3.1 IEC61010第三版规定的风险管理要求
作为该类产品的基础安全标准,IEC61010第三版规定了部分风险控制的要求,如随机文件的要求、机械对人体的危害、防机械应力、应用引起的危害并对风险评估过程做出要求。其中,应用引起的危害主要指合理预见的误用和人机工程学方面的因素可能引起的危害。
按照标准要求,制造商应建立风险管理的过程,并将其文件化。对于标准规定需要风险评定的危害和危害处境,逐一纳入风险管理计划进行风险管理。
3.2 医用测量、控制和实验室电气设备还应进行管理的风险
针对医用测量、控制和实验室电气设备,除应按照IEC61010规定控制其电气、机械等方面的风险外,还应关注一些安全相关的特性,当这些特性不满足医学用途时会产生安全方面的风险。例如,对IVD设备的分析、测量的准确性、一致性;消毒、灭菌设备的消毒、灭菌效果;控制设备的控制精度等。在IEC60601第三版中已经有专门的术语“基本性能(essential performance)”来定义类似特性,并将这些特性的要求列入安全标准中。IEC61010第三版中虽无此定义,但为确保产品的安全,特别是对于患者的安全,制造商应按产品的预期用途,识别出相应的特性参数,并通过有效的风险控制措施保证产品不会对患者产生不可接受的风险。
3.3 医用测量、控制和实验室电气设备风险管理过程中的要点
3.3.1 风险分析过程中应特别注意
(1)对于预期操作人员,预期使用条件(环境),预期受众(患者)群体的和预期效果进行分析和判定。
(2)针对不同的操作人员和不同使用条件(环境),识别可能的使用错误。
(3)安全相关的特性的确认,特别是当不满足医学用途要求时会产生危害的特性,如分析、测量的准确性,消毒、灭菌效果等。
(4)识别对患者的危害,对正常使用和故障情况下产生该危害的原因进行识别,识别危害处境。
(5)对危害处境产生的损害的严重程度和概率进行估计。
3.3.2 风险控制采用控制措施的顺序
(1)通过采用固有安全设计的方法尽可能地降低甚至消除风险,如改进产品设计,采用更先进的技术手段,提高系统的精密度,可靠性。
(2)如果上述方法不可行,则采用提供防护措施的方法,如设备自身增强自检或复查功能,甚至可以引入辅助环节,对结果进行确认,降低非预期(不合格)结果的流出。
(3)如果防护措施也不可行,则向使用者提供安全信息,提示或警告使用者可能存在的安全风险,指出是否需要培训或采用合适的防护装备。
4 小结
综上所述,对于医用测量、控制和实验室电气设备,既要符合IEC61010-1第三版对风险管理的要求,同时还应针对自身特点考虑对患者可能造成的危害和危害处境,按照IS014971的规定,建立风险管理过程。
[1]IEC 61010:2010,Safety requirements for electrical equipment for measurement, control, and laboratory use—Part 1:General requirements[S].
[2] ISO/IEC Guide 51:1999, Safety aspects -- Guidelines for the inclusion in standards.
[3]GB/T 20000.4-2003,标准化工作指南 第4部分:标准中涉及安全的内容 [S].
[4]ISO14971:2007, Medical devices—Application of risk management to medical devices[S].
[5]YY/T 0316-2008,医疗器械 风险管理对医疗器械的应用 [S].
[6] IEC 60513:1994, Fundamental Aspects of Safety Standards for Medical Electrical Equipment[R].
Risk Management for Electrical Equipment in Medical Practice for Measurement,Control and Laboratory Use
LIANG Zhen-shi,LIU Yi,SUN Jing-sheng,LIU Pei
(Beijing Institute of Medical Device Testing Beijing 101111)
For electrical equipment in medical practice for measurement, control and laboratory use, the manufacturer shall establish a risk management process beyond the requirements specified in IEC61010-1:2010. The scope of risks that shall be analyzed, the process and the key points of application of risk management are provided in this paper.
Electrical Equipment in Medical Practice for Measurement, Control and Laboratory Use Risk Management
2014-05-09
TH772
A
1002-2376(2014)08-0057-03

