抗肿瘤药伏立诺他药理毒理研究进展
宦 娣,余兴群,李 杰
抗肿瘤药伏立诺他药理毒理研究进展
宦 娣,余兴群,李 杰
抗肿瘤药; 伏立诺他; 组织蛋白脱乙酰酶抑制剂; 皮肤T细胞淋巴瘤
皮肤T细胞淋巴瘤(CTCL)大多恶性程度较低,病情进展缓慢,该病目前尚无法根治[1]。伏立诺他是Merck公司开发的世界上第一个抑制组蛋白脱乙酰基酶(histone deacetylase,HDAC)的新型抗癌药物,用于其他药物治疗时或治疗后仍不能治愈、或恶化、或病情反复情况下的转移性CTCL[2],对其它肿瘤也表现出良好活性,包括淋巴癌及乳腺癌等[3-4]。伏立诺他(Vorinostat)的发现是该病治疗领域的里程碑,本文将就目前已经进行的临床试验做一综述。
1 药物简介
伏立诺他化学名为N-羟基-N'-苯基辛二酰胺,分子式为C14H20N2O3,分子量264.327,是一种白色或类白色粉末,极微溶于水,微溶于乙醇、异丙醇、丙酮,易溶于二甲基亚砜,不溶于二氯甲烷。其化学结构式如图1所示:
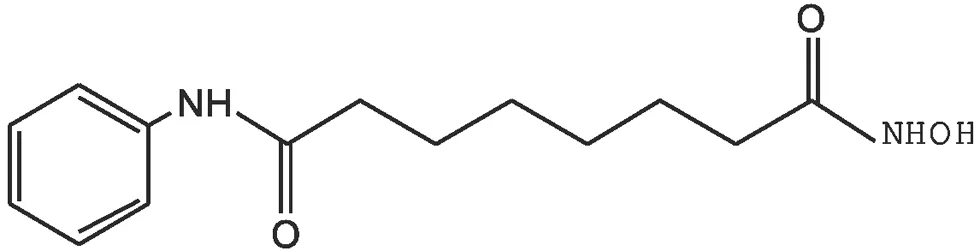
图1 伏立诺他化学结构式
2 药理作用
伏立诺他的作用原理为药物与组织蛋白去乙酰酶结合,使其失去作用而促使基因表现。它可借助于抑制HDAC1、HDAC2、HDAC3和 HDAC6促使乙酰化蛋白酶增加,造成癌细胞的转录等过程异常,而使癌细胞停止复制和生长,甚至死亡[5]。
2.1 作用机制 伏立诺他是HDAC1,HDAC2,HDAC3(Ⅰ型)和HDAC6(Ⅱ型)活性抑制剂,仅在毫摩尔浓度<86 nM时具有体外抑制作用[2],HDAC可以催化包括组蛋白和转录因子在内的蛋白质赖氨酸残留基团的乙酰化基团的除去反应。在许多肿瘤细胞中,有一些致癌因子过度表达的HDAC或变异修复的HDAC引起核小体的组蛋白的低乙酰化,组蛋白的低乙酰化伴随凝聚染色质结构和基因转录的抑制。抑制HDAC的活性,浓集组蛋白赖氨酸残基的乙酰基团导致开放的染色质结构和转录激活。体外研究发现伏立诺他引起组蛋白乙酰化的浓集,诱发细胞周期停滞和(或)一些变异细胞的编程细胞死亡。该药的抗肿瘤机制有待进一步研究。
2.2 药效学研究 HDAC抑制剂可以增加肿瘤细胞对辐射的敏感度,伏立诺他对一系列肿瘤细胞的这种作用已经在体外得到证实。A.Baschnagel等[6]采用MAD-MB-231-BR细胞试验观察伏立诺他在体内和体外对乳腺癌脑转移瘤细胞系的作用,结果显示伏立诺他不仅可在体内外增加肿瘤细胞对辐射的敏感度,还可提高乳腺癌伴脑转移患者的存活率,即通过伏立诺他合并放射线的治疗方法。Minucci S等[7]的研究表明HDAC抑制剂可以增加肿瘤细胞的表面的配体表达,从而促进肿瘤细胞被NK细胞的识别,达到消除肿瘤细胞的作用,该研究结果提示应用HDAC抑制剂联合免疫疗法可能是有效的抗肿瘤治疗方法。WT1基因在癌细胞分化和引发白血病方面起着关键的作用,Galimberti S等[8]采用定量RT-PCR法测定WT1的表达,从而判断伏立诺他对该基因的抑制作用,结果证实伏立诺他对WT1基因的表达有显著的抑制作用。
2.3 药代动力学研究 伏立诺他的药动学参数来自于在23例临床复发或顽固性的肿瘤患者。伏立诺他进食后服用吸收程度较空腹好;该药物的主要代谢途径包括葡萄苷醛酸化和氧化酶水解,主要代谢产物有O-葡萄糖醛酸苷和4-苯胺基-4-氧代丁醇酸,均无药理活性。伏立诺他主要通过代谢消除,只有不到1%的药物以原形从尿中排泄,提示肾代谢不是主要的代谢途径。
3 毒理研究
细菌回复突变实验(Ames试验)和小鼠微核实验发现,伏立诺他引起中国仓鼠卵巢细胞的染色体畸变和微核红细胞的发生几率增加。
Wise LD等[9]进行的动物试验证明,在伏立诺他50 mg·kg-1·d-1和150 mg·kg-1·d-1的剂量下,分别在大鼠和家兔体内做试验,在最高剂量时可以检测到伏立诺他对大鼠和家兔的后代发育的影响,包括存活胎儿的平均体重下降、骨骼发育不完全;在同期对照组比较,家兔出现剂量相关性的胆囊畸形的几率增加。Richon VM等[10]的研究显示该药可以透过胎盘,故孕妇禁用。
4 结语
HDAC抑制剂是新机制的抗肿瘤药物,是当前的研究热点之一,这类药物可使转化细胞出现停止、分化、凋亡或活性氧相关的细胞死亡,是很有希望的靶向抗癌药物[11]。本文就世界上第一个发现的HDAC新型抗癌药物-伏立诺他的药理作用、作用机制及药效药动学方面的研究做了综述,相信随着更多的深入研究,根治CTCL的难题终将被攻破。
[1] 乔 菊,王宝玺.皮肤T细胞淋巴瘤治疗进展[J].临床皮肤科杂志,2007,36(11):739-741.
[2] 张兴锴,孙铁民.治疗皮肤癌新药vorinostat[J].中国药物化学杂志,2007,17(4):268.
[3] Sakajiri S,Kumagai T,Kawamata N,et al.Histone deacetylase inhibitors profoundly decrease proliferation of human lymphoid cancer cell lines[J].Exp Hematol,2005,33(1):53-61.
[4] Cohen LA,Marks PA,Rifkind RA,et al.Suberoylanilide hydroxamic acid (SAHA),a histone deacetylase inhibitor,suppresses the growth of carcinogen-induced mammary tumors[J].Anticancer Res,2002,22(3):1497-1504.
[5] Gridelli C,Rossi A,Maione P.The potential role of histone deacetylase inhibitors in the treatment of non-small-cell lung cancer[J].Criti Oncology Hematology,2008,68(1):29-36.
[6] Baschnagel A,Russo A,Burgan WE,et al.Vorinostat enhances the radiosensitivity of a breast cancer brain metastatic Cell Line Grown In Vitro and as Intracerebral Xenografts[J].Mol Cancer Ther,2009,8(6):1589-1595.
[7] Minucci S,Pelicci P.Histone deacetylase inhibitors and the promise of epigenetic (and more) treatments for cancer[J].Nature Reviews Cancer,2006,6(1),38-51.
[8] Galimberti S,Canestraro M,Khan R,et al.Vorinostat and bortezomib significantly inhibit WT1 gene expression in MO7-e and P39 cell lines[J].Leukemia,2008,22(3),628-631.
[9] Wise LD,Turner KJ,Kerr JS.Assessment of developmental toxicity of vorinostat,a histone deacetylase inhibitor,in Sprague-Dawley rats and Dutch Belted rabbits[J].Birth Defects Res B Dev Reprod Toxicol,2007,80(1):57-68.
[10]Richon V M.Cancer biology:mechanism of antitumour action of vorinostat (suberoylanilide hydroxamic acid),a novel histone deacetylase inhibitor[J].British Journal of Cancer,2006,95:S2-S6.
[11]黄 艳.组蛋白去乙酰酶抑制剂应用前景[J].中国处方药,2006,4(49):57-59.
安徽省蚌埠第一人民医院 药剂科,233000
宦 娣(1983-),女,安徽蚌埠市人,药师,研究生。
R979.1
A
1008-7044(2014)04-0415-02
2013-12-23)

