湖北恩施地区天然富硒植物中硒形态的HPLC-ICP-MS分析
米秀博,邵树勋,汤 鋆,张 静
(1.中国科学院地球化学研究所矿床地球化学国家重点实验室,贵州 贵阳 550002; 2.中国科学院大学,北京 100049;3.浙江省疾病预防控制中心,浙江 杭州 310009; 4.中国科学院华南植物园,广东 广州 510650)
后生物生产层
湖北恩施地区天然富硒植物中硒形态的HPLC-ICP-MS分析
米秀博1,2,邵树勋1,汤 鋆3,张 静2,4
(1.中国科学院地球化学研究所矿床地球化学国家重点实验室,贵州 贵阳 550002; 2.中国科学院大学,北京 100049;3.浙江省疾病预防控制中心,浙江 杭州 310009; 4.中国科学院华南植物园,广东 广州 510650)
湖北恩施是爆发过世界上首例人群硒中毒的高硒背景区,蕴藏有丰富的富硒植物资源,调查发现了大量的富硒、超富集硒植物,具有很好的开发利用前景。利用高效液相色谱与电感耦合等离子体质谱联用仪(HPLC-ICP-MS)对恩施鱼塘坝硒矿区发育的醉鱼草(Buddleialindleyana)、水芹菜(Oenanthejavanica)富硒植物进行了硒形态的分析研究。结果表明,醉鱼草和水芹菜总硒含量分别高达531.4和213.1 μg·g-1,从中检测出硒代胱氨酸(Secys2)、硒代蛋氨酸(SeMet)和无机硒Se(VI)3种形态硒,其中醉鱼草的3种形态硒含量分别为14.2、26.2和221.2 μg·g-1,水芹菜的3种形态硒的含量分别为4.24、28.49和169.9 μg·g-1。说明这些富硒植物具有用于提取天然有机硒的重要开发利用价值。
富硒植物;HPLC-ICP-MS;总硒;有机硒;形态分析
硒是人体必需的微量元素,具有清除体内自由基,抗衰老、增强人体免疫力、拮抗重金属毒性及防癌、抗癌等生物功能。补硒是预防和治疗克山病、大骨节病等许多缺硒引起的疾病及防癌、抗癌的有效途径[1]。世界上有40多个国家处于缺硒状态,中国是世界上缺硒最严重的地区之一,全国低硒地区占全国总面积的72%[2]。由于低硒土壤地区出产的农作物含硒量低,不能满足人体正常生理的需要,因此,国内外对富硒食品及保健品的需求非常旺盛,可利用富硒地区的富硒植物开发生产富硒食品及补硒添加剂。不同化学形态的硒,其安全性、生物功能性存在较大差异。动植物对硒的吸收不仅与总硒的含量而且与硒的形态关系密切,同时有机硒的补硒效果优于无机硒[3]。近年来,硒与癌症的关系是国际上非常关注的科学问题,已有研究表明,甲基硒半胱氨酸(MeSeCys)、γ-谷氨酰-甲基硒代半胱氨酸(γ-glutamyl-MeSeCys)是有效的抗癌硒化合物[4-6],可利用富硒植物从中提取可能含有的MeSeCys、γ-glutamyl-MeSeCys等抗癌硒化合物。
湖北恩施是爆发过世界上首例人群硒中毒的地区,该区岩石、土壤中硒含量极高,还发现了世界上罕见的独立硒矿床,富硒岩石风化土壤生长的大量野生植物远比其他地区的植物富硒,调查发现了大量的富硒、超富集硒植物[7],是提取有机硒的重要生物资源。为了查明湖北恩施野生富硒植物中的有机硒资源,指导当地富硒产品的开发,本研究采用HPLC-ICP-MS联用技术,对恩施高硒地区发育的典型富硒植物醉鱼草(Buddleialindleyana)和水芹菜(Oenanthejavanica)中硒的形态进行分析,以期查明该区富硒植物中有机硒化合物类型及含量,进而指导当地富硒产品的开发。
1 材料与方法
1.1 采样点的选择
选择恩施地区发生过严重人畜硒中毒的恩施市鱼塘坝村和建始县安乐井村为调查采样地。鱼塘坝地理位置30°20′16″ N、109°46′39″ E,是曾暴发过世界首例人群硒中毒事件的知名硒中毒村,中国唯一的独立硒矿床就产在该地,极有利于富硒植物的生长。安乐井村地理位置30°34′41″ N、108°42′52″ E,水中硒含量高达200~400 μg·L-1[7]。调查采样重点选择石煤废渣堆,矿区石煤层间水、泉水流过的水沟流域、石煤风化土壤耕地、含矿岩石风化层表土分布区等富硒生态景观。
1.2 样品采集和预处理
醉鱼草又名一枝红花,马钱科醉鱼草属植物,为落叶灌木,植株高1~2 m,采集于鱼塘坝矿渣堆。水芹菜属伞形科水芹属多年生宿根草本水生植物,别名水芹,直立或平卧的一年生草本,采集于安乐井附近水沟。
采集的样品先用自来水清洗干净附着的泥土、灰尘之后,再用去离子水清洗3遍彻底将样品清洗干净,并在40~50 ℃条件下进行低温烘干,用植物碎样机粉碎并过0.25 mm筛,最后密封于聚乙烯塑料样品袋中并储存于4 ℃冰箱中备用。
1.3 仪器和试剂
电感耦合等离子体质谱仪(美国Thermo Fisher Scientific公司),碰撞反应池模式(CCT),H2作为碰撞气体;粉碎机;烘箱;离心机;超声仪;高效液相色谱仪(美国waters公司),配waters 717 plus自动进样设备;高效液相色谱柱与ICP-MS雾化器用0.25 mmPEEK管连接;HPLC-ICP-MS仪器参数:HPLC柱型为Hamiltion PRP-X100阴离子柱(150 mm×4.6 mm×5 μm),流动相为5 mmol·L-1柠檬酸pH 4.69,流速1.2 mL·min-1,进样量50 μL;ICP-MS射频功率为1 300 W,驻留时间20 ms,测量同位素为78Se,采用碰撞反应池模式:碰撞气8% H2/92% He,碰撞气流速6.95 mL·min-1。
试验中用水均为超纯水(Sartorius,德国,18.2 MΩ),浓硝酸(优级纯,体积分数65%~68%,国药集团),高氯酸(优级纯,70%~72%,上海桃浦化工厂);试验常用试剂:甲醇(色谱纯,德国Merck公司),柠檬酸、氨水均为分析纯;链霉蛋白酶E:(Roche,德国),4 ℃保存;Se元素标准溶液:浓度100 mg·L-1,用3% HNO3配置成含Se元素为1.0、5.0、10.0、20.0 μg·L-1的标准溶液。
硒标准品:硒代胱氨酸(SeCys2,纯度98%,Aldrich),甲基硒代半胱氨酸(MeSeCys,纯度≥95%,Sigma),硒代蛋氨酸(SeMet,纯度99%,Sigma),亚硒酸钠[Se(IV),Na2SO3,纯度≥98%,Sigma],硒酸钠[Se(VI),Na2SO4,纯度>98%,Sigma];用0.1 mol·L-1HCl稀释配置成1 mg·L-1的单标和混标标准储备溶液,4 ℃保存。
1.4 试验程序
总硒测定预处理:利用酸消解法[7]对植物样品进行预处理;称取经过处理的植物粉末样品0.05 g(精确至0.000 1 g)左右,加入8 mL硝酸和0.5 mL高氯酸,盖上器皿隔夜放置,同时做3份空白和平行样。次日在电热板上加热消解,温度为150 ℃左右。至溶液变为澄清无色并伴有白烟出现时,结束消解冷却,用超纯水定容稀释,利用ICP-MS测定总硒含量。
植物中硒形态的分离分析:在形态分析的过程中采用酶解法提取,同时以超声辅助消解,这大大缩短了提取时间;同时参照程建中测量富硒竹笋的提取方法[8],具体操作:称取0.10(精确至0.000 1 g)经处理的粉末样品放入离心管,20 mg链蛋白酶溶于3 mL超纯水加入到离心管,37 ℃超声提取30 min,然后在14 000 r·min-1离心15 min,取上清液并定容至100 mL。进行HPLC-ICP-MS测定前样品溶液过0.22 μm滤膜滤两次。结合文献[9-10]并利用上述HPLC-ICP-MS的工作条件,对100 μg·L-1的混合标样进行分离。将样品所测的硒形态总和与利用酸消解法得到的总硒含量进行对比,进而得到酶提取效率。
2 结果和讨论
2.1 总硒
以含Se元素为0、1.0、5.0、10.0和20.0 μg·L-1的标准溶液做标准曲线,以10 μg·L-1Y、In、Bi为内标进行测定,结果表明,所测元素线性良好,相关系数为0.999 4。醉鱼草和水芹菜中总硒的含量分别为531.4和213.1 μg·g-1(表1),这与已报道人工培养的富硒南瓜种子1.1 μg·g-1[11]、富硒大米0.136~0.143 μg·g-1[12]、富硒大蒜蒜头0.200~0.834 μg·g-1[13]相比,其含量高达百倍甚至千倍之多;这是由于植物发育于高硒环境下,对硒具有极强的耐受性,其富硒能力是普通植物经过短期硒处理不能达到的。所以,发育于高硒环境下的当地植物应该作为富硒产品开发的首选。

表1 富硒植物中的硒含量及其酶提取效率
注: *和**表示两个样品间差异显著(P<0.05)或极显著(P<0.01)。
Note: * and ** mean significant difference between two samples at 0.05 and 0.01 level, respectively.
2.2 硒的形态分析
5种标准样品的分离结果依次为SeCys2、MeSeCys、Se(IV)、SeMet、Se(VI),保留时间分别约为1.8、2.3、3.0、4.4、10.8 min(图1)。
通过与标准图谱(图1A)对比可以发现,在醉鱼草和水芹菜中均检测到了SeCys2、SeMet、Se(VI)(图1B、C)。根据各形态硒对应峰面积利用外标法进行硒形态含量的计算,不同植物样品酶解法的提取效率不尽相同(表1):水芹菜的提取效率超过85%,但是醉鱼草的酶提取效率只有约45%。这可能是因为提取效率不但取决于提取方法同时也与样品本身有很大关系[14-15]。
对于不同形态的硒含量,Se(VI)在醉鱼草和水芹菜中都特别高,分别为221.2和169.9 μg·g-1,且两者达到显著差异(P<0.05)(表1);这可能是由于土壤中存在Se(VI),以及富硒植物特殊的富硒机理共同作用导致了所研究样品中Se(VI)含量差异显著[13,16-19]。值得注意的是,对人们健康特别重要的有机硒含量均比较可观,在醉鱼草和水芹菜中,有机硒Secys2的含量分别是14.2和4.2 μg·g-1,二者差异极显著(P<0.01);SeMet的含量分别是26.2和28.4 μg·g-1,二者无显著差异(P>0.05)。与已报道的富硒产品富硒萝卜(Secys2为5.9 μg·g-1、SeMet为18.1 μg·g-1)[20]、富硒大蒜(Secys2为6.1 μg·g-1、SeMet为15.8 μg·g-1)[21]、富硒洋葱(Secys2为0.6 μg·g-1、 SeMet为1.2 μg·g-1)[22]对应的有机硒相比,本研究中两种植物有机硒的含量明显高。因此,如果经过处理,其会具有很高的利用价值;此外注意到,未检测到的硒化物的含量也比较高,在醉鱼草中达到一半之多,这可能是由于提取效率不足、标样有限以及试验方法的局限性等缘故而导致无法对未知硒化物进行分析,因此,对于这方面的深入研究也将会是以后工作的重点。
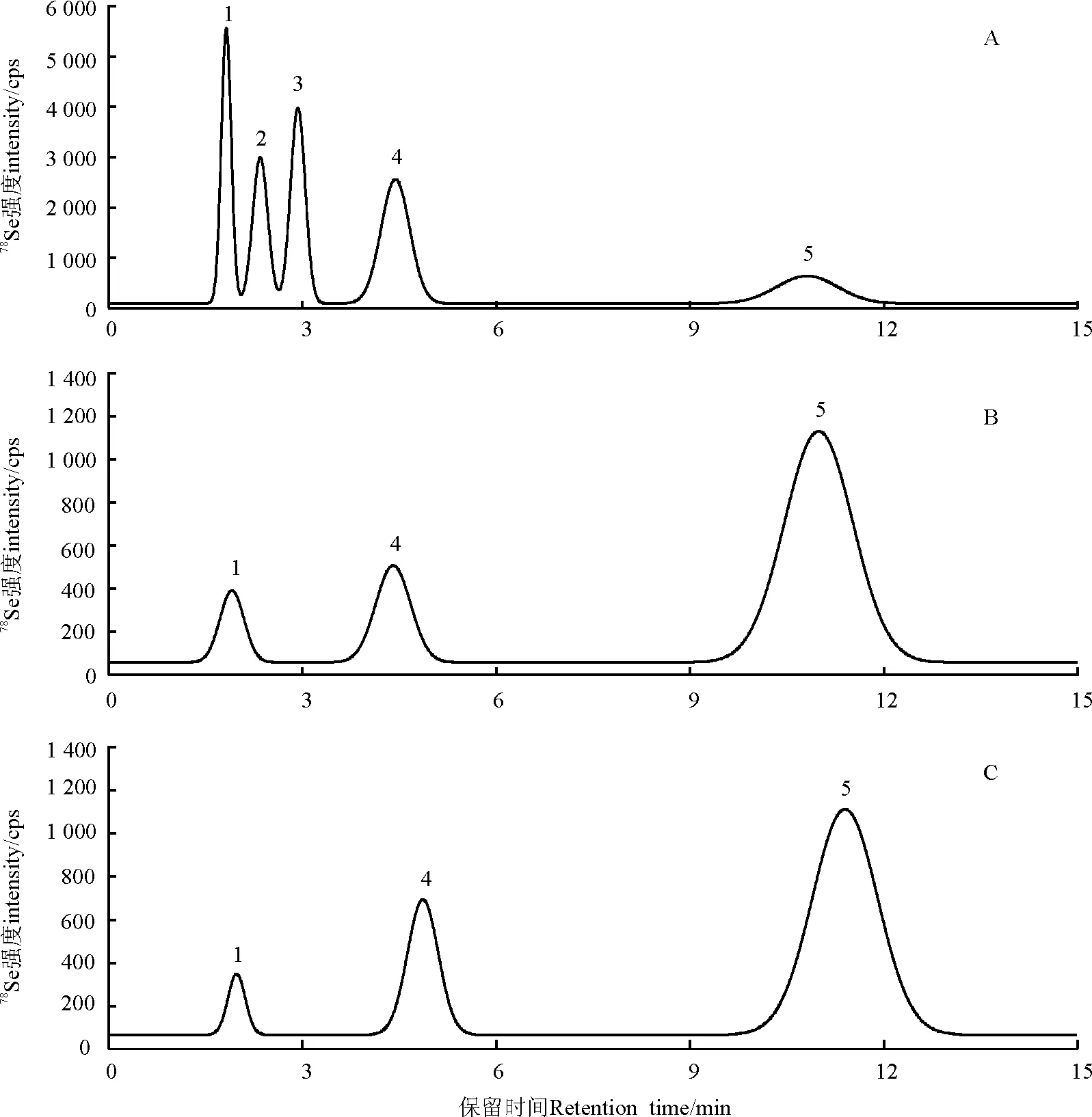
图1 标样及其样品色谱对比图
注:图中A为100 μg·L-1混标样的阴离子柱HPLC-ICP-MS标准图谱;峰1为SeCys2、峰2为MeSeCys、峰3为Se(IV)、峰4为SeMet、峰5为Se(VI),B、C分别为醉鱼草和水芹菜酶提取液的色谱图。
Note:A,a mixture of selenium species containing 100 μg·L-1separately; Peak 1,SeCys2;Peak 2,MeSeCys;Peak 3,Se(IV);Peak 4,SeMet;Peak 5,Se(VI); B,Buddleialindleyana; C,Oenanthejavanica.
3 结论
在恩施富硒地区鱼塘坝和安乐井发育的富硒的醉鱼草和水芹菜,其总硒含量分别为531.4和213.1 μg·g-1,主要的形态有硒代胱氨酸(Secys2)、硒代蛋氨酸(SeMet)和无机硒Se(VI),且有机硒Secys2、SeMet的含量分别达14.2、4.24和26.2、28.4 μg·g-1,远比一般市场上流行的富硒大米(0.136~0.143 μg·g-1)[10]、富硒茶(2.743 μg·g-1)[23]等富硒食品含量高,具有开发提取有机硒的重要价值,而且未知硒化物的深入研究将会使得这些富硒资源的应用前景更加广阔。
[1] Weeks B S,Hanna M S,Cooperstein D.Dietary selenium and selenoprotein function[J].Medical Science Monitor,2012,18(8):127-132.
[2] 彭大明,中国硒矿资源概述[J].化工矿产地质,1997,19(1):37-42.
[3] Thiry C,Ruttens A,De Temmerman L,Schneider Y J,Pussemier L.Current knowledge in species-related bioavailability of selenium in food[J].Food Chemistry,2012,130:767-784.
[4] Fairweather-Tait S J.Bioavailability of selenium[J].European Journal of Clinical Nutrition,1997,51:820-823.
[5] Medina D,Thompson H,Ganther H,Ip C.Se-methylselenocysteine:A new compound for chemoprevention of breast cancer[J].Nutrition and Cancer,2001,40(1):12-17.
[6] Sors T G,Ellis D R,Salt D E.Selenium uptake,translocation,assimilation and metabolic fate in plants[J].Photosynthesis Research,2005,86(3):373-389.
[7] 邵树勋.中国富硒植物的环境地球化学研究[D].北京:中国科学院研究生院,2007.
[8] 程建中.富硒雷竹笋和毛竹笋形态研究[D].杭州:浙江农林大学,2012.
[9] 倪张林,汤富彬,张玮,屈明华.HPLC-DRC-ICP-MS测定富硒蔬菜中的硒形态[J].分析实验室,2013,32(2):39-43.
[10] Mazej D,Osvald J,Stibilj V.Selenium species in leaves of chicory,dandelion,lamb’s lettuce and parsley[J].Food Chemistry,2008,107(1):75-83.
[11] Smrkolj P,Stibilj V,Kreft I,Kapolna E.Selenium species determination in selenium-enriched pumpkin (CucurbitapepoL.) seeds by HPLC-UV-HG-AFS[J].Analytical sciences,2005,21(12):1501-1504.
[12] Zhao Y Q,Zheng J P,Yang M W,Yang G D,Wu Y N,Fu F F.Speciation analysis of selenium in rice samples by using capillary electrophoresis-inductively coupled plasma mass spectrometry[J].Talanta,2011,84(3):983-988.
[13] 方勇,罗佩竹,胡勇,马宁,杨文建,辛志宏,赵立艳,胡秋辉.大蒜的生物富硒作用及其硒的形态分析[J].食品科学,2012.33(17):1-5.
[14] Montes-Bayon M,Molet M J D,Gonzalez E B,Sanz-Medel A.Evaluation of different sample extraction strategies for selenium determination in selenium-enriched plants (AlliumsativumandBrassicajuncea) and Se speciation by HPLC-ICP-MS[J].Talanta,2006,68(4):1287-1293.
[15] Bird S M,Uden P C,Tyson J F,Block E,Denoyer E.Speciation of selenoamino acids and organoselenium compounds in selenium-enriched yeast using high-performance liquid chromatography inductively coupled plasma mass spectrometry[J].Journal of Analytical Atomic Spectrometry,1997,12(7):785-788.
[16] Jacobs L W.Selenium in Agriculture and the Environment[M].Madison,WI:Soil Science Society of America Special Publication,1989:23.
[17] Neal R H.Selenium[A].Alloway B J.Heavy metals in soils[C].London:Blackie Academic and Professional,1995:260-283.
[18] 朱建明,凌宏文,王明仕,李社红,苏宏灿.湖北渔塘坝高硒环境中硒的分布、迁移和生物可利用性[J].土壤学报,2005,42(5):835-843.
[19] Rosenfield I,Beath O A.Selenium,Geobotany,Biochemistry,Toxicity and Nutrition[M].New York:Academic Press,1964.
[20] Ogra Y,Kitagucchi T,Ishiwata K,Suzuki N,Iwashita Y,Suzuki K T.Identification of selenohomolanthionine in selenium-enriched Japanese pungent radish[J].Journal of Analytical Atomic Spectrometry,2007,22:1390-1396.
[21] Dumont E,Ogra Y,Vanhaecke F,Suzuki K T,Cornelis R.Liquid chromatography-mass spectrometry (LC-MS):A powerful combination for selenium speciation in garlic (Alliumsativum)[J].Analytical and Bioanalytical Chemistry,2006,384(5):1196-1206.
[22] Wrobel K,Wrobel K,Kannamkumarath S S,Caruso J A,Wysocka I A,Bulska E,Swiatek J,Wierbicka M.HPLC-ICP-MS speciation of selenium in enriched onion leaves a potential dietary source of Se-methylselenocysteine[J].Food Chemistry,2004,86(4):617-623.
[23] 周跃花,杨菊香,张娜.紫外分光光度法测定紫阳富硒茶中的硒[J].西北农业学报,2009,18(4):299-232.
(责任编辑 武艳培)
Identification and characterization of selenium species in Se-enriched plants by HPLC-ICP-MS in Enshi
MI Xiu-bo1,2, SHAO Shu-xun1, TANG Jun3, ZHANG Jing2,4
(1.The State Key Laboratory of Ore Deposit Geochemistry, Institute of Geochemistry,Chinese Academy of Sciences, Guiyang 550002, China;2.University of Chinese Academy of Sciences, Beijing 10049, China;3.Zhejiang Center for Disease Control and Prevention, Hangzhou 310009, China;4.South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China)
The Yutangba Se-rich independent deposit is abundant in Se-enriched biological resources. The Se-enriched plants were collected in its natural seleniferous habitat and their Se distribution and speciation in all organs were tested using HPLC-ICP-MS. The highest Se accumulation of 531 μg·g-1was observed inBuddleialindleyanabased on total Se measurements. Speciation studies revealed that bothB.lindleyanaandOenanthejavanicahave three predominant form of Se which were SeCys2, SeMet and Se(VI) with concentration of 13.5, 24.2, 202.1 and 4.2, 25.4, 158.6 μg·g-1, respectively. The total selenium content was more than one hundred times compared with the artificial cultivation of Se-enriched products (Se-enriched garlic, Se-rich rice and Se-enriched pumpkin seeds, etc.). This will spark interest in increasing and/or modifying the Se compounds in plants.
Se-rich plant; HPLC-ICP-MS; total Se; organic selenium; speciation
SHAO Shu-xun E-mail:shaoshuxun@vip.gyig.ac.cn
10.11829j.issn.1001-0629.2013-0436
2013-08-02 接受日期:2013-10-23
国家自然科学基金(40971287)
米秀博 (1990-),男,甘肃庆阳人,硕士,主要从事环境地球化学研究。E-mail:mixiubo11@mails.ucas.ac.cn
邵树勋 (1964-),男,甘肃陇西人,副研究员,博士,主要从事环境地球化学研究。E-mail:shaoshuxun@vip.gyig.ac.cn
O613.52;TS255.7
A
1001-0629(2014)06-1173-05*1

