通心络胶囊对兔心肌梗死后心肌微循环、心功能及心电生理的影响
熊亮,黄从新,黄鹤,王晞,孔彬,蒋小波,党松
通络药物研究
通心络胶囊对兔心肌梗死后心肌微循环、心功能及心电生理的影响
熊亮,黄从新,黄鹤,王晞,孔彬,蒋小波,党松
目的探讨通心络胶囊对兔心肌梗死后心脏微循环灌注、心功能及心电生理的影响。方法选取新西兰大耳白兔 24只,随机分成假手术组、心肌梗死组及通心络组,每组8只。通过结扎左冠状动脉前降支建立心肌梗死模型,假手术组除不结扎动脉之外,其余均同心肌梗死组与通心络组。从术后第1天开始,通心络组给予通心络超微粉0.4 g·kg-1·d-1灌胃;假手术组与心肌梗死组给予等量的生理盐水灌胃,连续8周。分别在术后2、4周后,应用实时心肌超声造影检测梗死后心肌的微循环灌注情况。在术后8周,3组均利用超声心动图检测心功能,并进行在体电生理检测,测量梗死周边区的心肌内、中、外膜MAPD90、跨室壁复极离散度(TDR)、有效不应期(ERP)和室颤阈值(VFT)。结果与心肌梗死组比较,通心络组显著改善梗死相关区域的微循环灌注,心肌血流量明显提高[2周后:(7.24±1.11) dB×s-1vs.(10.66±1.23 )dB×s-1,P<0.05;4周后:(7.23±0.81) dB×s-1vs.(11.12±1.73) dB×s-1,P<0.05)。术后8周与心肌梗死组比,通心络组明显改善心肌梗死后心功能、延缓心肌梗死后心力衰竭发展进程、增加左室射血分数(FS:0.25±0.02 vs. 0.30±0.02;LVEF:0.51±0.04 vs. 0.61±0.03,P<0.05);缩短梗死周边区心肌MAPD90[内膜:(170.65±7.64)mSvs.(159.01±5.48)ms;中膜:(169.34±6.35)mSvs.(160.32±5.46)ms;外膜:(167.16±5.72)mSvs.(156.74±4.43)ms,P<0.05],缩小TDR [(7.72±2.83)mSvs.(4.95±2.26)ms,P<0.05];延长ERP[(126.56±5.87) mSvs.(135.25±5.63)ms,P<0.05],增加VFT[(28.63±6.21)V vs.(44.75±13.73)V,P<0.05]。结论通心络明显改善心肌梗死后梗死相关区微循环灌注,同时改善心肌梗死后心功能;对心肌梗死后心脏的电生理具有重要的影响,可能具有潜在的抗心律失常作用。
心肌梗死;微循环灌注;心功能;电生理;通心络胶囊;兔
随着人们工作压力增大,生活不规律,冠心病已成为危害人类健康及生命的主要疾病之一。尤其是急性冠状动脉缺血事件的发生,病死率明显增加。近年来,微创介入治疗使得急性心肌梗死后病死率有所下降,但是,幸存者中心力衰竭或各种恶性心律失常不断发生,极大地降低患者的生活质量,也是其住院率和致死率高的主要原因。因此,对心肌梗死后心力衰竭或恶性心律失常的预防显得十分重要。
传统的介入重建血供、扩张血管及心肌营养治疗在改善患者的生活质量和远期预后方面发挥了一定作用,但是仍无法解决问题。心肌梗死后心力衰竭及心律失常的发展过程,主要取决于心肌梗死后的结构重构和电重构。通心络胶囊由人参、水蛭、全蝎、土鳖虫、蜈蚣、蝉蜕、芍药、檀香、降香、乳香、酸枣仁、冰片等12种中药配制而成,治疗心绞痛和脑血管疾病疗效确切。近年研究发现,通心络胶囊具有益气通络、化瘀通络、搜风通络、流气通络等作用,不仅可以稳定粥样斑块,保护急性心肌梗死后再灌注微血管结构和功能的完整性,而且具有保护内皮细胞、抗炎、抗氧化、抗细胞凋亡、改善微循环的作用[1,2]。因此,推测其对心肌梗死后结构重构或电重构方面亦具有重要影响。
本研究通过对通心络在兔心肌梗死后心肌微循环灌注、心功能及心电生理特性等方面的影响进行深入分析,以期为今后的临床用药提供更多的指导。
1 材料与方法
1.1 材料 实验动物:选取健康新西兰大耳白兔24只,体质量2.5~3.5 kg,雌雄不限,均由武汉大学实验动物中心提供,普通饲料饲养。仪器与试剂:PhilipSIE33超声仪(美国PHILIP公司),六氟化硫微泡造影剂(意大利 Bracco 公司),LEAD2000B型多导电生理记录仪(四川成都锦江电子有限公司)。
1.2 模型建立 新西兰大耳白兔按30 mg/kg计算麻醉药戊巴比妥钠的使用剂量,用0.9%氯化钠注射液稀释后行耳缘静脉缓慢注射麻醉,固定体位。连接实验用心电监护仪,并确保导联正确连接,观察心电图形态,并开始记录。行常规气管插管,接小动物呼吸机行机械辅助呼吸,FiO2=0.6,观察并维持正常的PaO2和SaO2;调节呼吸参数,保持PaCO2为35~45 mm Hg。必要时可间断给予静脉注射肌松剂维库溴铵0.3 mg/kg,以保持动物肌肉松弛。备皮、消毒、铺巾,取胸骨左缘纵向切口,分离皮下组织及肌肉、断开肋骨、开胸暴露心脏,剪开心包膜,寻找并结扎左冠状动脉前降支,心电图监护仪I、II、aVL导联显示ST段抬高0.2 mV作为手术成功标志。随后,关胸并逐层缝合切口。术后连续3 d注射青霉素20万单位。
1.3 实验分组与用药 大耳白兔24只随机分成假手术组、心肌梗死组、通心络组,每组8只。假手术组除不结扎冠状动脉外,其余步骤均同心肌梗死组。心肌梗死术后第1天开始,通心络组给予通心络超微粉(石家庄以岭药业股份有限公司提供)0.4 g·kg-1·d-1灌胃,1次/d;假手术组和心肌梗死组则在术后给予生理盐水灌胃,1次/d,均连续8周。
1.4 观测项目
1.4.1 心肌微循环灌注检测:利用实时心肌超声造影检查技术(real-time myocardial contrast echocardiography,RT-MCE)[3],造影剂选择六氟化硫微泡造影剂,直径2~4 μm,使用前用0.9%氯化钠注射液稀释至5 ml。仪器使用PhilipSIE33 型超声仪,先选取胸骨旁乳头肌水平短轴观察超声成像,然后经耳缘静脉弹丸式注射六氟化硫微泡造影剂1 ml,并用0.9%氯化钠注射液10 ml冲刷。于心电图心室收缩末期触发Flash(目的是瞬间击碎心肌中的六氟化硫微泡造影剂),5个心动周期成像1次。所有图像均录像储存以供分析。应用PhilipSIE33配置的工作站内造影分析软件QLAB分析处理数据。系统自动得出Flash后再充盈稳定后的平台期峰值强度A(dB),其代表微血管密度,曲线斜率β(s-1)代表血流速度,A×β(dB ×s-1)代表心肌血流量[3]。ROI法获取心肌梗死区的时间—强度曲线,利用软件自带函数:Y=A×(1-eβt)+C得出拟合曲线。
1.4.2 心功能检测:术后8周使用PhilipSIE33超声仪检测心功能,包括左室舒张末内径(LVIDd)、左室收缩末内径(LVIDs)、左室收缩末容积(LVESV)、左室舒张末容积(LVEDV)、短轴缩短率(FS)、左室射血分数(LVEF)等指标。
1.4.3 在体电生理变化:用自制针状单相动作电位(MAP)电极进行在体电生理研究,连接LEAD2000B型多道电生理记录仪观测。将动物麻醉后固定,接呼吸机辅助呼吸,开胸分离粘连的瘢痕组织,良好地暴露出心脏,并以造模时的结扎线为标志,距离苍白的梗死边缘3 mm内作为梗死周边区。在周长为200 ms的S1S1连续刺激下,记录梗死周边区内、中、外膜3层的MAP,并且以动作电位复极完成90%的时限记为 MAPD90,3层心肌之间最长的MAPD90和最短的MAPD90之差记为跨室壁复极离散度(TDR)。通过程控期前刺激的方法,检测梗死周边区的有效不应期(ERP),具体为:将S1S1刺激的周长设置为200 ms(脉宽2 ms,刺激电压为2倍域强度),然后S1S2从290 ms以步长-10 ms开始反扫,直至未引起心室激动的最长S1S2间期即为ERP。最后,测定心室颤动阈值(VFT),具体为:将双极起搏电极插入左室梗死周边区域的心肌2 mm深度,开始施加短阵高强度刺激,刺激周长为100 ms,脉宽调整为10 ms,每次刺激持续时间定为30 s,从起搏电压(12V)开始,每次递增2V,如未引起室颤,则间断1 min后进行下一次刺激,以引起持续至少20 s室颤的最低电压为室颤阈值。
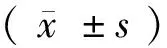
2 结 果
2.1 心肌微循环灌注检测 术后2、4周,与心肌梗死组相比,通心络组明显改善心肌梗死后梗死相关区域的心肌微循环灌注(P<0.05),但术后4周与2周比较,通心络组及心肌梗死组差异均无统计学意义(P﹥0.05)。见表1。

表1 3组术后2、4周梗死周边区实时心肌超声造影比较
注:与假手术组比较,*P<0.05,与心肌梗死组同时点比较,#P<0.05
2.2 心功能检测 术后8周,与心肌梗死组相比,通心络组心功能明显改善,LVEF增加(P<0.05)。见表2。
2.3 在体电生理变化 与心肌梗死组比较,通心络组梗死周边区心肌的内、中、外膜的MAPD90均明显缩短(P<0.05);TDR均减少(P<0.05)。梗死周边区的心肌ERP均延长(P<0.05),VFT均增加(P<0.05)。见表3。
3 讨 论
心肌梗死后结构重构、电重构是心肌梗死后心力衰竭和心律失常的主要原因,也是影响存活患者长期预后的重要因素。心肌梗死后重构的影响因素众多,包括炎性反应、细胞凋亡、细胞外基质的降解与增殖失调、交感神经的激活、RAAS的激活、细胞因子的激活、离子通道的表达及通道动力学的改变等[4~6]。近年来研究表明,通心络具有改善血管内皮功能,降低血脂,稳定粥样硬化斑块,抗氧化、扩张血管、抗血栓形成和抗氧化作用[2]。这些作用也是其临床上用来治疗心绞痛及脑血管病的重要药理基础,因此通心络可能在改善心肌梗死后的重构中发挥重要作用。

表2 3组术后8周超声心功能检测比较
注:与假手术组比较,*P<0.05, 与心肌梗死组比较,#P<0.05

表3 3组术后8周梗死周边区在体电生理的比较
注:与假手术组比较,*P<0.05,与心肌梗死组比较,#P<0.05
本研究表明,与心肌梗死组相比,兔急性心肌梗死后给予通心络干预,明显改善梗死相关区域心肌的血流灌注,改善局部的微循环。研究表明,人参中的人参皂甙Rb1能阻断同型半胱氨酸诱导的内皮功能失调、超氧化物的生成及内皮细胞NO的合成下调,保护内皮细胞和舒张血管[7]。还有研究表明芍药根部提取物也具有扩张血管的作用[8]。Xie等[2]通过在兔颈动脉处放置一个硅胶套管诱导血管外膜损伤模型,使得继发性血管收缩、血管腔面积减少、血管中层增厚,且对血清素的反应性增加等变化。研究发现通心络可以有效地减轻外膜损伤诱导的血管收缩反应,增加动脉血流量,并降低血管对血管收缩剂血清素的高反应性,使其趋于正常化。而通心络发挥这些作用可能是通过抑制RhoA/Rho激酶信号通路来实现的。
早期研究表明,RhoA/Rho激酶信号通路在调节血管收缩方面起重要作用。肌球蛋白轻链(myosin light chain,MLC)的磷酸化反应是血管平滑肌(vascular smooth muscle,VSM)收缩的重要环节之一,而该反应依赖于胞浆内钙离子活性/钙调蛋白依赖的MLC激酶与肌球蛋白磷酸酶(myosin light chain phosphatase,MLCP)的平衡[9]。研究发现Rho激酶通过使肌球蛋白轻链磷酸酶靶亚单位1(myosin light chain phosphatase target subunit 1,MYPT1)磷酸化抑制MLCP的活性,从而使得MLC激酶的活性占优势,间接表现为血管平滑肌收缩加强和对血管收缩剂的反应性增加[10]。此外,越来越多的证据表明:许多血管活性物质的信号转导途径与RhoA/Rho激酶途径有关,包括血管紧张素II和血清素在内[11]。Kandabashi等[12]的研究表明,在血管外膜慢性炎性反应刺激动物模型中,Rho激酶的表达明显上调,MLCP的活性受到明显抑制,使冠状动脉痉挛的发生更频繁。因此,通心络可能通过多种直接或间接的途径,扩张冠状动脉血管、降低血管对缩血管活性物质的敏感性,改善冠状动脉微循环的作用。
本研究表明,通心络明显改善心肌梗死后心功能,提高左室射血分数。笔者认为通心络的这一作用可能是通过多种途径改变了心肌梗死后的结构重构。除其对心肌微循环灌注的改善作用外,既往研究提示:通心络具有改善内皮功能、抑制细胞凋亡、抑制心肌纤维化和促进心肌组织血管生成作用[2],但对其潜在的作用机制不甚明了。近年来,Liang等[13]的研究表明,通心络可能是通过依赖PI-3K/Akt/HIF信号途径诱导内皮细胞NO合酶表达增加,从而调节内皮细胞的功能,提高其在缺氧条件下的耐受和抗缺氧能力。另外此研究也提示,通心络可以减轻同型半胱氨酸诱导的氧化应激对血管平滑肌细胞的损伤。也有研究表明,通心络可以通过抑制核因子-κB(nuclear factor-kappa B,NF-κB)的激活,抑制依赖NF-κB的炎性因子基因的表达、细胞增殖和细胞凋亡。进一步抑制巨噬细胞炎性因子的合成,限制巨噬细胞和中性粒细胞的迁移和吞噬作用。另外,动物实验表明,通心络明显降低血清中单核细胞趋化因子1(monocyte chemotactic protein 1,MCP1)、高敏C反应蛋白、白细胞介素-8、白细胞介素-18、基质金属蛋白酶-1(MMP-1)和P-选择素的水平[1],再次表明了通心络抗炎性反应作用。因此,通心络可能通过改善血管内皮功能、抗炎性反应、抗氧化,抑制细胞凋亡和调节细胞外基质增殖等多种途径,改善心肌梗死后的结构重构,延缓心肌梗死后心功能的恶化。
在体电生理研究方面,本研究表明,与心肌梗死组相比,通心络明显缩短梗死周边区外、中、内膜层心肌MAPD90,减少其TDR;使梗死周边区有效不应期延长,并使其室颤阈值增加。既往研究表明,心肌梗死或心肌梗死后心力衰竭的电重构涉及多种离子通道、兴奋收缩耦联、细胞间缝隙连接及肌浆网Ca2+循环的改变[14,15]。心肌梗死后重构的一个重要标记是复极化的异常,特别是APD时程延长。而心肌动作电位重构涉及的离子流机制非常复杂,包括外向K+电流(Ik)、内向Ca2+电流(ICa)及后期的内向Na+电流(INa)等多种成分,且相互影响。除了电流密度发生改变外,这些离子通道的空间分布也发生变化,尤其是在心力衰竭的情况下。这些改变可以导致心肌正常复极化发生异常,并可能导致多种心律失常的发生[16]。本研究同时提示,急性心肌梗死8周后,其心肌梗死周边区的MAPD90较假手术组显著延长,但既往也有研究报道,急性心肌梗死后早期,心肌内、中、外膜MAPD90均缩短,且随着梗死后时间的推移,在2~60 d后,MAPD90逐渐会向正常基线恢复,但很少能回到基线水平,甚至到心肌梗死60 d以后[17]。而对于梗死周边区域心肌MAPD90延长的机制,可能与心肌梗死后多离子通道的表达水平和其动力学特性有关[14,15,18],如IK内流减少,使复极化时间延长。近年来,学者发现一些MicroRNA的表达水平与钾离子通道的变化有关[19,20]。此外,越来越多的证据表明Ica,L的密度是轻中度肥大心肌APD延长的一项重要机制,但在重度心肌肥大或心力衰竭时,其密度没有变化或反而下调。这也进一步体现了心力衰竭时心肌APD延长的复杂性[21]。另外,心力衰竭时INa的重构是多变的,包括INa峰值电流的升高、不变或下降。同时也是被认为对APD影响最小的因素[22]。本研究推测通心络可能通过其改善微循环、抗细胞凋亡、抗氧化等抑制心脏重构及神经重构,或间接调节多种离子通道的密度或通道动力学,影响心肌的复极化、延长ERP及提高VFT,发挥潜在抗心律失常作用,有待今后进一步的研究。
综上,通心络明显改善心肌梗死后心脏的微循环灌注,改善心肌梗死后的心功能,延缓重构的进展,并且通心络对心肌梗死后心脏的电生理具有重要影响,具有潜在的抗心律失常作用。
1 Chen WQ,Zhong L,Zhang L, et al.Chinese medicine tongxinluo significantly lowerSserum lipid levelSand stabilizeSvulnerable plaqueSin a rabbit model[J]. J Ethnopharmacol,2009,124(1):103-110.
2 Xie LN,Zeng DY,Zhang HS, et al. Effect of tongxinluo on vasoconstriction induced by the chronic injury of the adventitia in the rat carotid artery[J]. J Ethnopharmacol, 2010 ,131(2):300-305.
3 曹桂秋,穆玉明,曾倩倩,等.结扎不同冠脉建立兔急性心肌梗死模型的特点比较[J].第三军医大学学报,2011,33(11):1148-1151.
4 Frantz S,BauersachSJ,Ertl G. Post-infarct remodelling:contribution of wound healing and inflammation[J]. Cardiovasc Res, 2009,81(3):474-481.
5 Wasson S,Reddy HK,Dohrmann ML. Current perspectiveSof electrical remodeling and itStherapeutic implications[J]. J Cardiovasc Pharmacol Ther, 2004,9(2):129-144.
6 Cutler MJ,Jeyaraj D,Rosenbaum DS. Cardiac electrical remodeling in health and disease[J]. TrendSPharmacol Sci,2011,32(3):174-180.
7 Zhou W,Chai H,Lin PH, et al. Ginsenoside Rb1 blockShomocysteine-induced endothelial dysfunction in porcine coronary arteries[J]. J Vasc Surg, 2005,41(5):861-868.
8 Ghayur MN,Gilani AH,Rasheed H, et al. Cardiovascular and airway relaxant activitieSof peony root extract[J]. Can J Physiol Pharmacol, 2008,86(11):793-803.
9 Terry S,Matter K,Nie M,et al. Rho signaling and tight junction functions[J].Physiology(Bethesda),2010,25(1):16-26.
10 Sato M,Tani E,Fujikawa H, et al. Involvement of Rho-kinase-mediated phosphorylation of myosin light chain in enhancement of cerebral vasospasm[J]. Circ Res, 2000,87(3):195-200.
11 Nobe K,Paul RJ. Distinct pathwaySof Ca2+sensitization in porcine coronary artery:effectSof Rho-related kinase and protein kinase C inhibition on force and intracellular Ca2+[J]. Circ Res, 2001,88(12):1283-1290.
12 Kandabashi T,Shimokawa H,Miyata K, et al. Inhibition of myosin phosphatase by upregulated rho-kinase playSa key role for coronary artery spasm in a porcine model with interleukin-1beta[J].Circulation, 2000,101(11):1319-1323.
13 Liang JQ,Wu K,Jia ZH ,et al. Chinese medicine Tongxinluo modulateSvascular endothelial function by inducing eNOSexpression via the PI-3K/Akt/HIF-dependent signaling pathway[J].J Ethnopharmacol, 2011,133(2):517-523.
14 Cutler MJ,Jeyaraj D,Rosenbaum DS. Cardiac electrical remodeling in health and disease[J].TrendSPharmacol Sci, 2011 ,32(3):174-180.
15 Nattel S,Maguy A,Le Bouter S, et al. Arrhythmogenic ion-channel remodeling in the heart:heart failure,myocardial infarction,and atrial fibrillation[J].Physiol Rev, 2007, 87(2):425-456.
16 Akar FG,Rosenbaum DS. Transmural electrophysiological heterogeneitieSunderlying arrhythmogenesiSin heart failure[J].Circ Res,2003,93(7):638-645.
17 Huang C,Bao M,Jiang H,et al.DifferenceSin the changing trendSof monophasic action potential duration and effective refractory period of the ventricular myocardium after myocardial infarction in vivo[J].Circ J,2004,68(12):1205-1209.
18 Wang Y,Hill JA. Electrophysiological remodeling in heart failure[J].J Mol Cell Cardiol,2010,48(4):619-632.
19 Xiao J,Luo X,Lin H,et al.MicroRNA miR-133 represseSHERG K+ channel expression contributing to QT prolongation in diabetic hearts[J].J Biol Chem, 2007,282(17):12363-12367.
20 Yang B,Lin H,Xiao J, et al. The muscle-specific microRNA miR-1 regulateScardiac arrhythmogenic potential by targeting GJA1 and KCNJ2[J].Nat Med, 2007,13(4):486-4891.
21 Hill JA. Electrical remodeling in cardiac hypertrophy[J].TrendSCardiovasc Med, 2003, 13(8):316-322.
22 Wang Y,Hill JA. Electrophysiological remodeling in heart failure[J].J Mol Cell Cardiol, 2010,48(4):619-632.
《疑难病杂志》可直接使用的英文缩略语
T(体温) R(呼吸) HR(心率) BP(血压)
SBP(收缩压) DBP(舒张压) ECG(心电图) EEG(脑电图)
Hb(血红蛋白) RBC(红细胞) WBC(白细胞) N(中性粒细胞)
L(淋巴细胞) M(单核细胞) E(嗜酸粒细胞) PLT(血小板)
ESR(红细胞沉降率) HCT(红细胞压积) TG(三酰甘油) TC(总胆固醇)
CH(胆固醇) LDL-C(低密度脂蛋白胆固醇) HDL-C(高密度脂蛋白胆固醇) SCr(血肌酐)
UA尿酸 NO(一氧化氮) BUN(血尿素氮) T3(三碘甲状腺原氨酸)
T4(甲状腺素) ALT(丙氨酸氨基转移酶) AST(天冬氨酸氨基转移酶) APTT(活化部分凝血活酶时间)
PaO2(动脉血氧分压) PaCO2(动脉血二氧化碳分压) SaO2动脉血氧饱和度 IU或U(酶活力的国际单位)
TheeffectsofTongxinluocapsuleonmyocardialmicrocirculationperfusion,cardiacfunctionandelectrophysiologyofrabbitsaftermyocardialinfarction
XIONGLiang,HUANGCongxin,HUANGHe,WANGXi,KONGBin,JIANGXiaobo,DANGSong.
DepartmentofCardiology,RenminHospital,WuhanUniversity,Wuhan430060,ChinaCorrespondingauthor:HUANGHe,E-mail:huanghe1977@hotmail.com
ObjectiveTo evulate the effectSofTongxinluo(TXL) on myocardial microcirculation perfusion,cardiac function and cardiac electrophysiology of rabbitSafter myocardial infarction.Methods24 New Zealand rabbitSwere randomly assigned into three groups:sham group (n=8),which underwent thoracotomy and pericardiotomy without coronary artery ligation,MI group (n=8) and TXL group (n=8),both of which underwent thoracotomy,pericardiotomy and the left anterior descending coronary artery waSligated to induce MI. TXL group were treated with TXL superfine powder 0.4 g·kg-1·d-1for 8 weekSafter the operation,while the sham and MI groupSwere administered with normal saline for the same time aScontrol. Myocardial microcirculation perfusion waStested by real time myocardial contrast echocardiography (RT-MCE) after 2 weekSand 4 weekSrespectively. Cardiac function waSstudied using echocardiography,and 90% of monophasic action potential duration (MAPD90) of epicardium,midmyocardium and endocardium,transmural dispersion of repolarization (TDR),effective refractory period (ERP),and ventricular fibrillation threshold (VFT) were measured at the infarct border zone (MI group and TXL group) and corresponding zone (sham group) in vovo.ResultsThe myocardial microcirculation perfusion of the infarct related zone in TXL group waSsignificantly improved than MI group,and A×β which represented the myocardial blood perfusion increased markedly [after 2 weeks:(7.24±1.11) dB×s-1vs.(10.66±1.23) dB×s-1,P<0.05; after 4weeks(7.23±0.81) dB×s-1vs.(11.12±1.73) dB×s-1,P<0.05].To compared with MI group ,cardiac function waSalso significantly improved inTXL group after 8 weekSof MI ( FS:0.25±0.02 vs. 0.3±0.02,P<0.05; LVEF:0.54±0.04 vs. 0.61±0.03,P<0.05),and TXL significantly shortened the MAPD90 of the 3 layerS[MAPD90endo:(170.65±7.64)mSvs.(159.01±5.48) ms,P<0.05;MAPD90mid:(169.34±6.35) mSvs. (160.32±5.46) ms,P<0.05;MAPD90epi:(167.16±5.72) mSvs. (156.74±4.43) ms,P<0.05),reduced the TDR [(7.72±2.83) mSvs.(4.95±2.26) ms,P<0.05],and increased the ERP [(126.56±5.87) mSvs. (135.25±5.63) ms,P<0.05] and VFT[(28.63±6.21)V vs. (44.75±13.73)V,P<0.05].ConclusionTXL significantly improved the myocardial microcirculation perfusion of the infarct related zone and cardiac function after MI. TXL also had a significant impact on cardiac electrophysiology after MI,for itSanti-arrhythmic effects.
Myocardial infarction;Microcirculation perfusion;Cardiac function;Electrophysiology;Tongxinluocapsule;Rabbit
国家重点基础研究发展计划(973计划)资助项目(No.2012CB518604)
430060 武汉大学人民医院心内科
黄鹤,E-mail:huanghe1977@hotmail.com
10.3969 / j.issn.1671-6450.2014.04.001
2014-01-24)

