梓醇促进大鼠骨髓间充质干细胞增殖过程中Wnt信号通路的变化*
傅淑平, 杨 丽, 洪 浩, 偶 晨, 张荣华△
(1南京中医药大学针药结合省部共建教育部重点实验室,江苏 南京 210023;2暨南大学药学院中药教研室, 广东 广州 510632)
梓醇(catalpol)是从玄参科植物地黄中分离出来的单一有效化学成份之一,也是中国药典指定的地黄定性指标,属于环烯醚萜类化合物[1]。我们的前期研究显示,0.05~10 mg/L梓醇培养液对骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)的增殖均有促进作用,其中1.0 mg/L梓醇培养液对细胞的增殖作用最强,但其具体作用机制并不明确[2]。近期研究表明,Wnt信号通路在BMSCs自我更新过程中具有重要的调节作用[3], 但其是否与梓醇的促干细胞增殖作用有关,尚不清楚。本研究主要在前期工作基础上,检测梓醇对BMSCs细胞周期的影响,同时观察Wnt信号通路中相关因子在此过程中的变化情况,探讨梓醇促BMSCs增殖的作用机制。
材 料 和 方 法
1 动物
清洁级(SPF)3月龄SD雌性大鼠(体重约200 g),由南京医科大学实验动物中心提供(合格证号为0004482)。
2 药物
梓醇标准品购买于北京世纪奥科生物技术有限公司,结构式见图1,纯度经HPLC检测均大于98%,称取梓醇1 mg,溶解于10 mL低糖DMEM完全培养液中,0.22μm过滤分装,配制成为100 mg/L母液,-20 ℃保存备用。
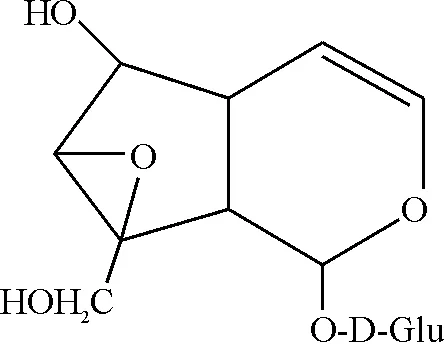
Figure 1. The chemical structure of catalpol.
3 主要试剂
低糖DMEM培养基和胎牛血清(Gibco),胰酶(Amresco),EDTA和RNase A (Sigma),碘化丙啶和Trizol (Invitrogen),RT-PCR Kit(TaKaRa),β-catenin抗体(Cell Signaling Technology),ECL化学发光试剂盒(Pierce)。
4 方法
4.1梓醇对BMSCs细胞周期的影响 取生长良好的第3代BMSCs以5×107cells/L密度接种在培养瓶中,将细胞分为空白对照组与梓醇处理组,待细胞贴壁后,吸出培养液,换成无血清培养基,24 h细胞周期同步化后,各组分别加入DMEM培养液及1.0 mg / L梓醇培养液培养细胞,6 d后,待细胞汇合至90%左右,消化细胞,PBS洗2次,1 200 r/min离心4 min,制成单细胞悬液,移入离心管。加入预冷的70%无水乙醇2 mL快速混匀,固定细胞24 h,去除乙醇,用0.1 mol/L PBS洗涤2次,每次加洗液2.5 mL左右,1 200 r/min离心4 min,调整细胞浓度为1×109cells/L。加200 μL RNaseA (1 g/L),37 ℃水浴30 min,立即放入冰浴中,再加PI染色液(50 mg/L),避光反应30 min,FACScan流式细胞仪检测分析细胞周期。以增殖指数(proliferation index,PI)表示细胞增殖活性,PI=(S+G2/M)/(G0/G1+S+G2/M)×100%。
4.2梓醇对Wnt3a、Wnt5a及Wnt11 mRNA表达的影响 取生长良好的细胞,以1×108cells/L密度接种到25 cm2的培养瓶中,待细胞周期同步化后,按2.1所述进行分组并培养6 d,细胞汇合至90%以上时,消化各组细胞,提取细胞总RNA,采用real-time PCR技术检测各组细胞中Wnt3a、Wnt5a、Wnt11、β-catenin及GAPDH表达情况,引物序列见表1。参照大连宝生物有限公司的TaKaRa SYBRR ExScriptTMRT-PCR Kit说明书合成第1链cDNA,反应体系10 μL(冰上操作),上述反应液混匀后于PCR扩增仪上42 ℃反应15 min,95 ℃反应2 min。随后取2 μL cDNA样本按照10倍梯度稀释成4~6个浓度梯度的cDNA,并以此构建目的基因及看家基因的标准曲线。利用梯度样本cDNA的Ct值作为横坐标,样本的起始拷贝数的对数作为纵坐标,分别建立目的基因和看家基因的标准曲线,并设置2~4个不加模板cDNA(以灭菌蒸馏水代替)的PCR管作为空白对照管。在相同条件下检测样本目的基因和看家基因的Ct值,利用标准曲线计算该样本的目的基因和看家基因的起始拷贝数。反应结束后,由电脑自动生成荧光扩增曲线、标准曲线以及熔解曲线。使用最大二阶倒数法进行分析。

表1 引物序列
4.3梓醇对β-catenin mRNA 及蛋白表达的影响 实验分组及培养方法同2.1,细胞培养6 d后,消化各组细胞,根据Trizol试剂使用说明同时提取细胞总RNA及总蛋白,检测各实验组β-catenin mRNA及蛋白表达情况。其中β-catenin mRNA表达情况按2.2所述方法进行检测,引物序列见表1。β-catenin蛋白表达利用Western blotting技术进行检测,GAPDH蛋白作为内参对各组数据进行均一化。具体操作如下:取20 μg总蛋白变性后,进行SDS-PAGE垂直电泳,30 mA,2 h;随后将蛋白转到PVDF膜上,250 mA,2 h;将膜取出放入含5%脱脂奶粉的TBS/T封闭液中封闭1 h,然后分别放入Ⅰ抗β-catenin(1∶1 000)、GAPDH(1∶2 000)中孵育,4 ℃过夜;经TBS/T清洗后,再加入Ⅱ抗常温反应2 h,随后加入ECL化学发光试剂,利用化学发光仪检测目的条带,并用ImageJ图像分析软件对各组条带进行分析。
5 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 18.0软件处理,采用t检验进行统计分析, 以P<0.05为差异有统计学意义。
结 果
1 梓醇对BMSCs细胞周期的影响
从图2及表2可知,空白对照组BMSCs有(8.90±0.46)%的细胞处于S和G2/M期,经药物干预后,梓醇处理组有(17.93±1.68)%的细胞处于S和G2/M期,梓醇处理组PI值高于空白对照组(P<0.01)。

Figure 2. The effect of catalpol on cell cycle of BMSCs. A: control group; B: catalpol group.

表2 各实验组BMSCs增殖指数
2 梓醇对Wnt3a、Wnt5a及Wnt11 mRNA表达的影响
如图3所示,不同Wnt蛋白在BMSCs的mRNA表达水平不尽相同,Wnt3a表达水平较低,而Wnt5a表达水平明显高于Wnt3a与Wnt11。与空白对照组相比较,梓醇干预后,Wnt5a mRNA表达水平提高了11.73倍,Wnt11 mRNA表达水平提高了7.18倍,差异均有统计学意义(P<0.01);但Wnt3a mRNA表达水平并无明显改变。
3 梓醇对β-catenin mRNA及蛋白表达的影响
与空白对照组相比较,梓醇干预后,β-catenin/GAPDH mRNA相对表达量由0.79增加到1.04,其表达水平提高了1.3倍, 差异有统计学意义(P<0.01),见图4A。除此之外,Western blotting结果显示,梓醇可明显提高BMSCs内β-catenin蛋白表达水平,差异有统计学意义(P<0.01),见图4B。

Figure 3. The effect of catalpol on the mRNA expression of Wnt3a, Wnt5a and Wnt11 in BMSCs.Mean±SD. n=6. **P<0.01 vs control group.

Figure 4. The effect of catalpol on the mRNA (A) and protein (B) expression of β-catenin.Mean±SD.n=6. **P<0.01 vs control.
讨 论
细胞周期与细胞增殖的关系非常密切,通常情况下大部分的BMSCs处于静息期,但是一旦进入了细胞周期,G1和G2期明显缩短,细胞在体外就会出现高速率的扩增;且细胞进入不同的细胞周期阶段时,细胞中DNA会随着细胞周期的各期而发生变化,因此当细胞受到某些因素刺激,可使DNA 含量发生变化,从而引起细胞周期发生改变[4]。细胞增殖指数则是指S期与G2/M期DNA含量之和与S期、G2/M及G0/G1期DNA含量之和的比,它是反映细胞增殖的重要指标之一。本研究在前期证实梓醇对BMSCs增殖有促进作用后,进一步观察其对细胞周期的影响,结果表明BMSCs在未作处理时,大部分细胞处于相对不活跃的静止期即G0/G1期,PI值约为8.90%,与文献报道BMSCs的PI值在10%左右相一致[5];而经过梓醇干预后,所培养的BMSCs S期与G2/M期DNA含量增加到17.93%,提示梓醇可通过促进大鼠BMSCs进入细胞周期,增加其增殖指数,从而达到促进细胞增殖的作用。
Wnts是一种富含半胱氨酸的分泌型糖蛋白,Wnt信号通路参与多种细胞过程的调节,如细胞生长、分化、功能及死亡;Wnt信号通路可分为经典Wnt信号通路和非经典的Wnt信号通路。经典Wnt信号通路又称为Wnt/β-catenin信号通路,主要是激活核内靶基因的表达;当无Wnt信号时,胞内游离的β-catenin与APC、Axin、GSK-3β结合,形成“降解复合物”,GSK-3β使β-catenin磷酸化,被SCF复合物识别,分解其多肽链,从而水解,无法进入核内发挥作用;而当有Wnt信号如Wnt3a、Wnt1、Wnt8、Wnt10b等存在情况下,Wnt蛋白与其受体Frizzled及LRP6结合,并激活其下游瀑布级联反应,抑制β-catenin降解,使β-catenin在胞内稳定的积累,并促使其进入核内激活下游靶基因的转录。一些不产生β-catenin积累信号的Wnt,包括Wnt5a、Wnt11在内的多种Wnt蛋白则通过其它方式转导信号,称为非经典Wnt信号[6-8]。研究表明,Wnt信号通路可以促进某些细胞如造血干细胞[9]、神经干细胞[10]、肿瘤细胞等[11]的自我更新和增殖。从多孔钙支架中释放出来的Wnt3a可以使移植的hMSCs获得有丝分裂原的刺激,增加β-catenin稳定性,对MSCs增殖与存活具有促进作用[12]。在未分化的MSCs扩增期间,予以Wnt3a干预,可以出现细胞数目增加,细胞增殖加速及细胞凋亡下降的结果[13]。通过抑制GSK-3β活性,增加β-catenin在胞内的积累,可有效抑制细胞凋亡[14]。另有研究表明,除了Wnt3a、Wnt1介导的经典Wnt信号可能增加β-catenin在胞内的蓄积、促进细胞增殖与存活外,Wnt5a所介导的非经典的Wnt信号通路亦可抑制未分化双能C2C12细胞、成骨细胞前体细胞及骨髓来源的OB-6成骨细胞因血清饥饿所诱导的细胞凋亡,同时还可以促进这些细胞的增殖、募集和分化,以增加细胞的存活时间[15]。由此我们也可以看出,Wnt信号的经典与非经典通路均参与了MSCs的增殖过程。为探讨梓醇促BMSCs增殖作用与Wnt信号通路的活化是否存在相关性。本实验通过运用real-time PCR和Western blotting技术分别检测了各实验组中Wnt3a、Wnt5a、Wnt11、β-catenin mRNA表达及β-catenin蛋白含量变化情况,结果显示:经梓醇干预后,BMSCs中Wnt5a、Wnt11及β-catenin mRNA表达均明显升高,Wnt3a表达量无变化;但β-catenin蛋白合成明显高于空白组,说明梓醇虽然没有表现出对Wnt3a mRNA表达的增强作用,但其明显增加了β-catenin mRNA的表达量和β-catenin蛋白合成量,说明梓醇可能通过调节其它Wnt蛋白,比如Wnt1、Wnt7a等,促进胞内β-catenin的累积,激活经典Wnt信号,从而促进BMSCs增殖;另外,细胞内Wnt5a和Wnt11 mRNA表达在梓醇干预下亦明显上升,而且其提高的幅度远远高于β-catenin mRNA,提示非经典Wnt信号通路的活化也可能参与了梓醇促BMSCs增殖的过程。
综上所述,我们认为梓醇可能通过Wnt3a以外的Wnt蛋白激活的经典Wnt信号通路和由Wnt5a、Wnt11激活的非经典Wnt信号通路促使BMSCs进入细胞周期,达到促进细胞增殖的作用。但具体哪一种Wnt蛋白是梓醇促BMSCs增殖过程中Wnt经典信号通路激活的启动点?Wnt5a和Wnt11激活了哪一条非经典Wnt信号通路?经典与非经典Wnt信号通路在这一过程中的具体地位孰轻孰重?尚有待于更为深入的研究。
[参 考 文 献]
[1] 国家药典委员会. 中华人民共和国药典2000年版一部[M]. 北京:化学工业出版社, 2000: 94.
[2] 傅淑平, 张荣华. 不同浓度梓醇对SD大鼠骨髓间充质干细胞增殖及骨向分化的影响[J]. 时珍国医国药, 2012, 23(10): 2398-2400.
[3] Mei G, Xia L, Zhou J, et al. Neuropeptide SP activates the WNT signal transduction pathway and enhances the proliferation of bone marrow stromal stem cells[J].Cell Biol Int, 2013, 37(11):1225-1232.
[4] Javazon EH, Colter DC, Schwarz EJ, et al.Rat marrow stromal cells are more sensitive to plating density and expand more rapidly from single-cell- derived colonies than human marrow stromal cells[J]. Stem Cells, 2001, 19(3):219-225.
[5] 雷俊霞, 李浩威, 黄春浓, 等. 长期传代的大鼠骨髓间质干细胞的生物学特性分析[J]. 中国病理生理杂志, 2003,19(10): 1325-1330.
[6] MacDonald BT, Semenov MV, He X. SnapShot: Wnt/β-catenin signaling[J]. Cell, 2007, 131(6):1204.e1-1204.e2.
[7] Chen W, ten Berge D, Brown J, et al. Dishevelled 2 recruits beta-arrestin 2 to mediate Wnt5A-stimulated endocytosis of Frizzled 4 [J]. Science, 2003, 301(5638):1391-1394.
[8] 周 静, 袁伟杰, 谢院生, 等. siRNA 沉默WT1对小鼠足细胞Wnt/β-catenin和nephrin表达的影响[J]. 中国病理生理杂志, 2013, 29(2):219-224.
[9] Willert K, Brown JD, Danenberg E, et al. Wnt proteins are lipid-modified and can act as stem cell growth factors [J]. Nature,2003, 423(6938): 448-452.
[10] Chen A, Walsh CA. Regulation of cerebral cortical size by control of cell cycle exit in neural precorcurs [J]. Science, 2002, 297(5580): 365-369.
[11] 刘 瑞, 郝春媛, 邓秀玲, 等. 神经细胞黏附分子通过非Wnt依赖的β-catenin途径促进小鼠黑色素瘤细胞增殖[J]. 中国病理生理杂志, 2013, 29(9): 1645-1650.
[12] Boer JD, Siddappa R, Gaspar C, et al. Wnt signaling inhibits osteogenic differentiation of human mesenchymal stem cells [J]. Bone, 2004, 34(5):818-826.
[13] Boland GM, Perkins G, Hall DJ, et al. Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells [J]. J Cell Biochem, 2004, 93(6): 1210-1230.
[14] Kennell JA, MacDougald OA. Wnt signaling inhibits adipogenesis through beta-catenin-dependent and-independent mechanism [J]. J Biol Chem, 2005, 280(25): 24004-24010.
[15] Almeida M, Han L, Bellido T, et al. Wnt proteins prevent apoptosis of both uncommitted osteoblast progenitors and differentiated osteoblasts by beta-catenin-dependent and-independent signaling cascades involving Src/ERK and phosphatidylinositol 3-kinase/AKT [J]. J Biol Chem, 2005, 280(50): 41342-41351.

