MUC1 mRNA体外负载树突状细胞诱导细胞毒性T细胞对非小细胞肺癌的杀伤作用*
巴俊慧, 吴本权, △, 王艳红, 刘 慧, 杨 洋, 石云锋, 罗进梅, 张天托
(中山大学附属第三医院 1呼吸内科, 2内科ICU,广东 广州 510630)
肺癌是目前最常见同时也是死亡率最高的恶性肿瘤[1],其中约86%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。尽管在肿瘤的全身化疗及靶向治疗方面取得很大进展,但由于肺癌尤其是NSCLC的预后极差,约半数病人会复发,且对化疗的有效率小于25%,因此迫切需要探索新的治疗手段[3]。免疫治疗作为一种新型肿瘤治疗模式日益受到人们的重视[4]。树突状细胞(dendritic cells, DCs)是目前已知的人体内最有效的抗原提呈细胞,可以活化静息性T淋巴细胞使其成为抗原特异性细胞毒性T细胞(cytotoxic T-lymphocytes,CTLs),在激发抗肿瘤免疫中处于中心环节的地位。近年来,以DCs为基础的免疫治疗方法已成为研究的重要方向[5]。本研究采用构建pcDNA3.1(+)-黏蛋白1(mucin 1,MUC1)质粒,经体外转录为MUC1 mRNA,通过电穿孔法转染DCs,观察转染后的DCs对NSCLC的特异性抗肿瘤效应。
材 料 和 方 法
1 细胞和材料
人肺腺癌A549细胞株来自中山大学附属第三医院中心实验室,人白血病K562细胞株由中山大学附属第三医院血液病实验室惠赠。健康人新鲜外周血浓缩白细胞由广州市血液中心提供。
RPMI-1640培养基(Gbico);胎牛血清(Excell);人淋巴细胞分离液(天津灏洋生物制品公司);CD14+磁珠分选抗体(德国美天旎公司);细胞因子rh-IL-4、rhGM-CSF和TNF-α(Peprotech);单克隆抗体CD11c、HLA-DR、CD80、CD83和CD86(eBioscience);RNAiso plus、real-time试剂盒、BamH I/XhoI限制性内切酶、逆转录试剂盒、PCR Primestar酶(TaKaRa)和人IFN-γ ELISA试剂盒(北京达科为公司);LDH试剂盒(南京建成生物工程研究所);体外转录试剂盒(Thermo Scientific)。
2 方法
2.1DCs的体外培养 将新鲜采集的健康人外周血浓缩白细胞用淋巴细胞分离液密度梯度离心法分离提取获得外周血单个核细胞,继而用CD14+抗体磁珠分选CD14+单个核细胞,加入含10%胎牛血清、IL-4(15 μg/L)及GM-CSF(20 μg/L)的RPMI-1640培养基中进行培养,隔天补足细胞因子并观察细胞形态。培养至第5 d时,在培养基中加入TNF-α(15 μg/L),继续培养24 h,诱导成为成熟的树突状细胞(mature dendritic cells,mDCs)。流式细胞术检测细胞表型HLA-DR、CD80、CD83和CD86,同时检测未加TNF-α刺激的DCs。收集磁珠阴选细胞作为同种同体T细胞来源冻存备用。
2.2MUC1基因的克隆及体外转录 根据GenBank内MUC1基因的核苷酸序列,结合pcDNA3.1(+)载体酶切位点,体外构建MUC1-pcDNA3.1(+)质粒,其上下游酶切位点分别为BamH I和XhoI。Xhol限制性内切酶将其线性化,以之为模板进行体外转录为MUC1 mRNA,纯化定量。
2.3电穿孔法转染树突细胞 取成熟的DCs分为2组,一组用无血清RPMI-1640重悬至密度5×109/L,取0.4 mL加入4 mm电转杯,然后加入10 μg MUC1 mRNA,在250 V、500 μs的条件下转染,电击后将电转杯置于4 ℃、10 min后重悬于含10%胎牛血清的RPMI-1640培养基,37 ℃、5% CO2条件下继续培养24 h。另一组未进行电转染的DCs作为未转染组DCs进行对照。
2.4定量PCR检测转染后DCs内MUC1 mRNA的表达 分别收集未转染组DCs和转染后12 h、24 h、48 h、72 h的DCs。用Trizol提取各组DCs的总RNA,逆转录为cDNA,以之为模板采用荧光定量PCR检测MUC1 mRNA表达。
2.5T细胞增殖实验 将上述2组DCs作为刺激细胞,分别以1×108/L、5×107/L 、2.5×107/L及1×107/L的密度种于96孔板,每个密度设6个复孔。复苏同种同体淋巴细胞作为效应细胞,调整细胞密度至5×108/L,加入各孔,为实验组。另设只加入刺激细胞孔和只加入效应细胞孔。培养5 d后,每孔加MTT溶液,孵育4 h后用酶标仪于490 nm处测A值。T细胞增殖率(%)=[实验组A-(效应细胞A+刺激细胞A)]/效应细胞A×100%。
2.6CD8+T细胞的水平 取转染组DCs,调细胞密度为5×108/L,同种同体淋巴细胞调密度为5×109/L,各取400 μL于24孔板共培养,并于第1天、3天、5天加入IL-2 2×105U/L,未转染组DCs按照上述方法与淋巴细胞共培养及单独培养的T细胞作为对照组, 第7天取细胞进行流式细胞术分析CD8+T细胞的水平。
2.7细胞毒性实验 按2.6中方法共培养细胞,在第7天再次加入转染组DCs。如此反复刺激3次后,以诱导的CTLs作为实验组效应细胞,未转染组DCs按照上述方法与淋巴细胞同培养后作为对照组效应细胞。将处于对数生长期的A549作为靶细胞,将K562细胞和转染MUC1 mRNA的DCs作为对照组靶细胞。效应细胞和靶细胞按照40∶1加入96孔板,每组设3个复孔,孵育5 h。同时设只加入靶细胞的自然释放孔和只加入靶细胞后再加入Triton X-100裂解细胞的最大释放孔。按照LDH试剂盒操作说明测定A值。杀伤率(%)=[(实验孔A-自然释放孔A)/(最大释放孔A-自然释放孔A)]×100%。
2.8ELISA法检测IFN-γ的含量 收集2.7中经过反复刺激后实验组和对照组细胞培养上清进行适当稀释后,按照IFN-γ ELISA试剂盒操作说明分别检测上清中IFN-γ水平,每组设3个复孔。
3 统计学处理
采用SPSS 17.0软件处理,数据以均数±标准差(mean±SD)表示,两组间数据比较采用t检验,多组间采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 DCs形态学观察及表型鉴定
CD14+磁珠抗体分选纯化后的CD14+单个核细胞加入细胞因子IL-4和GM-CSF置于5% CO2、37 ℃温箱5 d后,镜下观察可见未成熟树突细胞呈悬浮状,少量突起并可见细胞集落,见图1。第5天再加入TNF-α刺激成熟,第7天镜下观察发现细胞有典型树突状突起,形状不规则,见图1。未成熟DCs表面成熟标记CD80、CD83和CD86的表达低,而成熟DCs表面CD80、CD83和CD86表达明显增高,2组DCs的HLA-DR表达无显著差异,见图2。
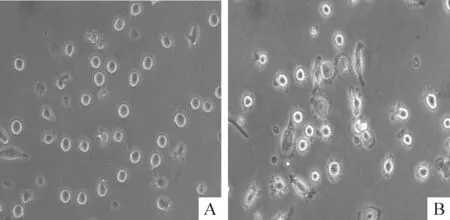
Figure 1. Immature DCs and mature DCs under microscope (×400).A: immature DCs; B: mature DCs.

Figure 2. The typical phenotypes of immature DCs and mature DCs.
2 Real-time PCR检测转染后MUC1 mRNA的表达
转染后的DCs MUC1 mRNA的表达明显增高,且具有时间依赖性。转染后12 h相对未转染组的表达量为(12.56±3.55)倍,24 h的相对表达量为(22.03±2.96)倍,48 h的相对表达量为(13.56±3.33)倍,72 h的表达量为(5.61±1.91)倍。结果显示,转染后MUC1 mRNA的相对表达量具有时间依赖性,且在24 h达到峰值,随后2 d,表达逐渐下降(P<0.05),见图3。
3 DCs刺激T细胞增殖能力
MTT法检测增殖结果表明,在DCs与T细胞的比例达到1∶10时,转染组与未转染组刺激增殖能力均达到最高,转染组DCs的刺激能力[(82.13±12.60)%]明显高于未转染组[(50.71±11.73)%](P<0.05)。当DCs与T细胞比例为1∶20时,转染组的刺激能力[(65.77±6.26)%]也明显高于未转染组[(43.21±11.94)%](P<0.05)。而当DCs与T细胞比例为1∶5和1∶50时,2组DCs都可以刺激增殖,但是无显著差异(P>0.05),见图4。

Figure 3. The mRNA expression of MUC1 in the DCs with or without MUC1 mRNA transfection.Mean±SD.n=6.*P<0.05 vs 0 h.
4 不同处理组T细胞CD8+的表达水平
流式细胞术鉴定3组T细胞CD8+的表达率,转染组诱导的T细胞CD8+阳性比例为(39.79±5.45)%,未转染组为(27.36±3.13)%,单独T淋巴细胞组为(22.76±4.59)%。转染组诱导水平与其它2组诱导水平比较P<0.05,见图5。
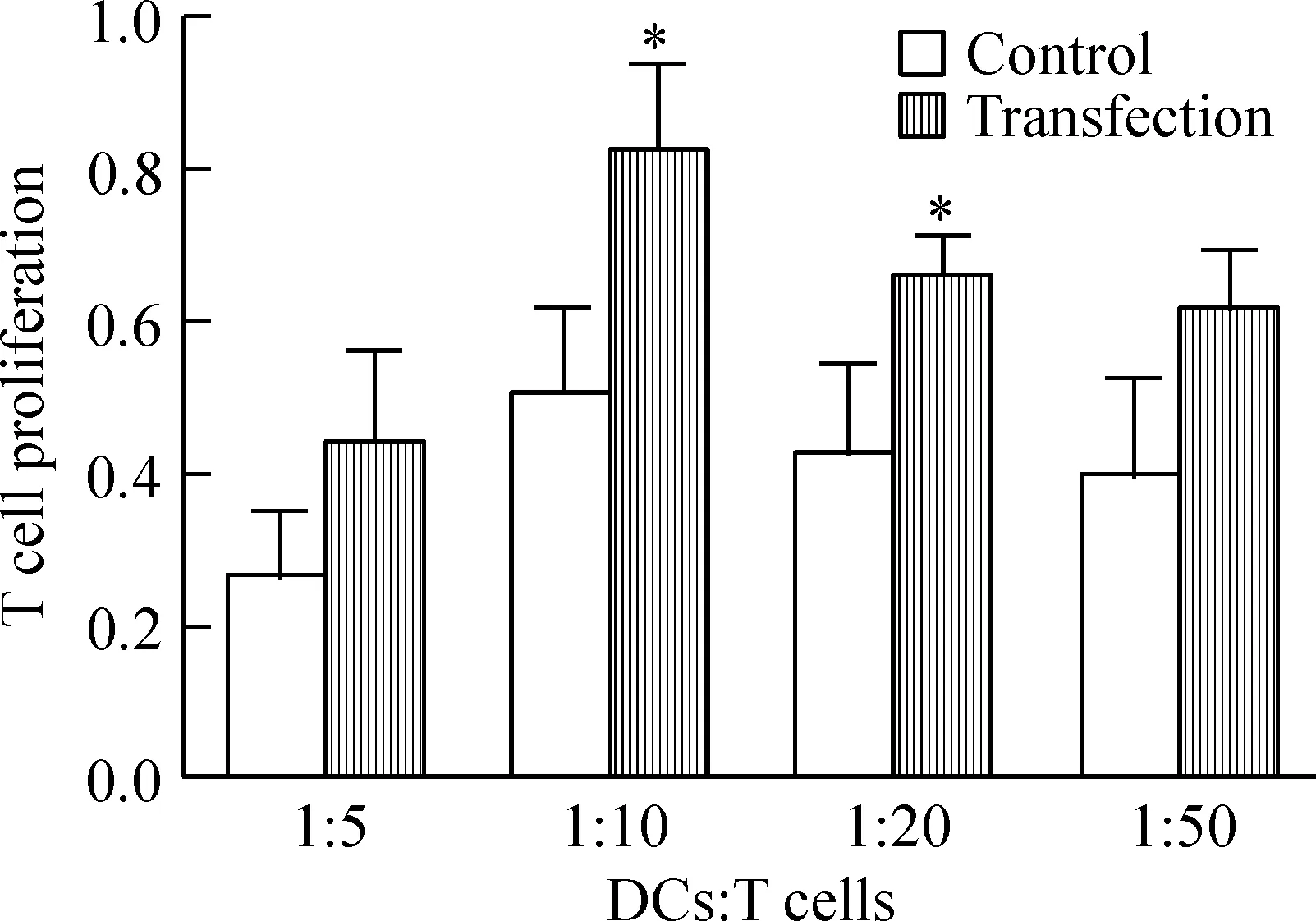
Figure 4. The stimulatory capacity of DCs with or without MUC1 mRNA transfection on T cell proliferation.Mean±SD. n=6.*P<0.05 vs control group.
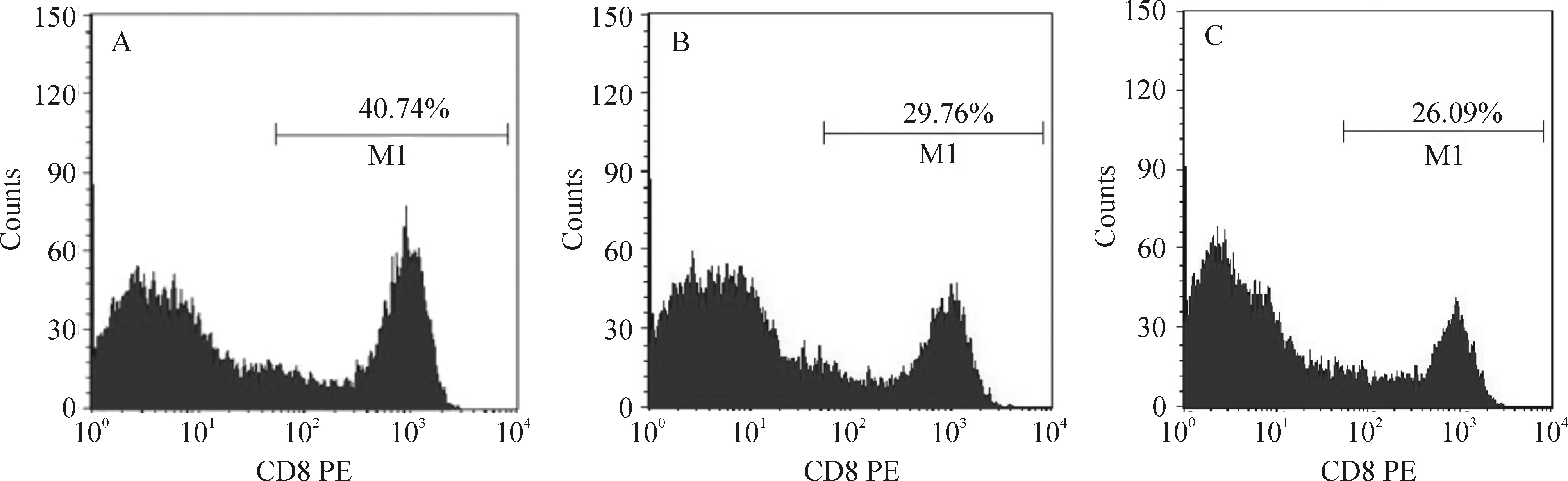
Figure 5. The CD8+ phenotypes of T lymphocytes stimulated with different DCs.A: T cells+transfected DCs; B: T cells+untransfected DCs; C: T cells alone.
5 2组IFN-γ分泌水平
ELISA法检测两组DCs与T细胞共培养后的IFN-γ分泌水平,转染组[(126.73±10.47)ng/L]高于未转染组[(72.20±6.83)ng/L](P<0.05),见图6。
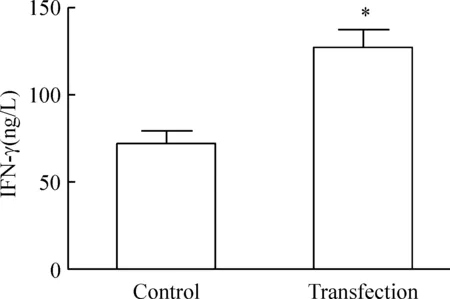
Figure 6. IFN-γ levels in the culture supernatants of T-lymphocytes stimulated with different DCs.Mean±SD. n=6.*P<0.05 vs control group.
6 转染DCs诱导T细胞的特异性细胞毒效应
转染组DCs诱导的T细胞在任何效靶比时都对表达MUC1蛋白的靶细胞有杀伤作用,对于不表达MUC1蛋白的K562细胞杀伤作用明显弱于A549细胞。未转染组DCs诱导的T细胞和空白对照组T细胞对A549细胞都有一定杀伤作用,但是均弱于转染组,见表1。

表1 效应T细胞的杀伤作用比较
讨 论
随着对肿瘤生物学发生发展机制的深入研究,肿瘤的免疫治疗成为手术、化疗和放疗三大常规治疗外的第4种方法。肿瘤的免疫治疗主要分为两类:一种是将患者自体抗原特异性T细胞在体外扩增后回输患者体内;另一种是通过疫苗的方式,即提供一种抗原与佐剂一起引发的治疗性T细胞,能诱导免疫记忆,以控制肿瘤复发。DCs作为一种“天然佐剂”因而成为最适合的抗原输送者[5]。但是肿瘤患者体内分离的DCs在功能上是有缺陷的,不能对肿瘤细胞进行有效地识别。大量研究表明,DCs能同时控制免疫激活和免疫耐受,所以成为免疫系统的中心[6]。通过将负载在DCs上的肿瘤信息传递给T细胞,打破其对于肿瘤的免疫耐受是制备以DCs为基础的肿瘤疫苗的理论基础[7]。而DCs的活性和功能是DCs疫苗发挥功能的关键[8]。
随着体外诱导DCs的技术不断成熟从而可以获取大量的DCs,那么如何选择有效的抗原及负载方式成为关键问题。Dukes大学的研究人员首先应用肿瘤细胞RNA转染DCs。RNA转染只需进入胞浆,转染效率高,没有整合入宿主染色体的风险,省略了复杂的转录机制[9]。近年来不断有研究表明,编码肿瘤相关抗原或者肿瘤特异性抗原或者包含全部肿瘤信息的mRNA转染DCs,可以诱导抗原特异性或针对多个抗原表位的T细胞免疫效应反应[4, 9-11]。
正常情况下,MUC1是一种高度糖基化的跨膜分子,表达于乳腺、卵巢、呼吸道和胃肠道等腺上皮分泌细胞的顶端表面。在恶性肿瘤细胞中,MUC1异常丰富地表达于整个上皮细胞表面,极性分布消失、新的糖链表位形成和正常被隐蔽的表位暴露,使其具有很高的免疫原性,可以被免疫系统识别[12-13]。在肺癌患者尤其是非小细胞肺癌(大约80%~100%)患者外周血中MUC1的表达高于其它肿瘤标记物,即使是一些隐蔽的肺癌细胞也可被检测到[14]。MUC1的这些特性使其成为一种具有前景的肺癌免疫治疗靶分子。因而,本实验提出一种主要针对非小细胞肺癌的以MUC1为靶点的DCs RNA疫苗的基础研究,以期更有效地发挥其免疫激活和对肺癌细胞的杀伤作用。
由于人体外周血中DCs数量很少,只有不到有核细胞的0.1%。本实验采用外周血浓缩白细胞分离纯化的CD14+单个核细胞,在IL-4和GM-CSF的联合作用下可诱导成未成熟的DCs。CD80和CD86是T细胞表面CD28分子和细胞毒性T细胞相关抗原-4(CTLA-4)的配体,具有协同刺激分子的作用[15],而CD83是树突状细胞的特异性标志,参与抗原呈递和淋巴细胞活化[16]。未成熟DCs表面低表达CD80、CD83和CD86。TNF-α不仅可以促进细胞增殖,阻止细胞向粒系分化,还能促进DCs成熟。流式细胞术结果表明在加入TNF-α后,DCs表面CD80、CD83和CD86明显升高。大量的研究已证实电转染是一种安全、有效的转染方法。本研究中将MUC1 mRNA电转染DCs后,通过实时荧光定量PCR检测MUC1 mRNA水平上的表达量,结果表明MUC1的表达随时间而变化。在转染后24 h出现表达的峰值,而在48 h和72 h后,可能由于RNA的降解,MUC1的表达出现较明显的降低。实验中可通过分析转染后的DCs刺激T细胞的增殖能力,被诱导的T细胞表面的CD8+表达评价其向CTL方向分化的水平,CTL分泌的IFN-γ和对表达目的蛋白的细胞的杀伤作用等方面来判断抗肿瘤效应[17]。mDCs在接受微生物或者抗原刺激活化后刺激T细胞增殖,促进Th0细胞向Th1方向分化,分泌IL-2、IFN-γ、TNF-β等介导细胞免疫,同时IFN-γ抑制Th0向主要介导体液免疫的Th2方向分化。而naive CD8+T细胞必须在Th1的辅助下识别被提呈的抗原,不断增殖分化为CTLs,发挥细胞毒作用[18]。DCs以抗原肽——MHC复合物的形式将抗原信息提呈给T细胞,在一些黏附分子、共刺激分子等第2信号的共同作用下,T细胞克隆增殖。所以T细胞的增殖能力是评价DCs抗原呈递功能的指标,观察抗原特异性反应的强弱。研究结果表明,转染组和未转染组DCs均可使T细胞增殖。国外有研究认为在DCs与T细胞的比例在1∶20时,刺激增殖的能力最强[19]。本研究中DCs与T细胞比例达到1∶10时,2组的刺激增殖能力均达到最高,表明实际上DCs与T细胞的相互作用可以在一个较宽的范围内进行[19]。而当DCs与T细胞比例为1∶5时,刺激增殖能力却不是最高,甚至低于比例为1∶20时,分析可能存在T细胞过度激活而引起的细胞凋亡[20]。CTLs是主要的杀伤肿瘤的免疫效应细胞,活化的DCs及Th1细胞能够分泌IFN-γ、TNF-α等细胞因子,激活调节CTLs的功能,打破实体瘤患者机体免疫抑制状态。本研究中采用流式细胞术来鉴定naive CD8+T细胞向CTLs细胞分化水平,细胞因子水平分析IFN-γ的分泌,细胞毒实验来鉴定CTLs的特异性杀伤作用。虽然FACS结果显示转染组DCs诱导T细胞表达的CD8+水平未特别明显高于其它两组对照,但是转染组刺激增殖的T细胞数量是明显增多的。所以就 CD8+T细胞总数而言,转染组是明显多于未转染组。本实验中,诱导的MUC1特异性CTLs 对白血病细胞K562的杀伤作用很弱,但是可识别并裂解表达MUC1的肺腺癌细胞A549和转染了MUC1 mRNA的DCs。说明转染MUC1 mRNA的DCs不仅引发了特异性的CTLs,而且可以作为监测癌症患者体内MUC1特异性CTLs存在的一般方法。而CTLs对于A549细胞的杀伤作用强于转染的DCs。考虑可能是肺癌细胞能更有效地刺激特异性CTLs的克隆增殖。与未转染的DCs共培养的T细胞和单独培养的T细胞对于A549细胞的杀伤作用都不明显。体外实验中,由于效应T细胞与靶细胞的作用比例较高,可以产生明显的杀伤作用,而在机体内由于效/靶比例可能较低,则CTL的杀伤作用也随之减弱。但也同时提示可以通过提高肿瘤局部环境效应T细胞的数量来达到特异性杀伤肿瘤细胞的目的。实验中也证实共培养的MUC1 mRNA转染的DCs和T细胞明显提高CD8+T细胞介导的IFN-γ的分泌水平,这些分泌的IFN-γ也能促进细胞杀伤作用。
本实验首次将体外转录的肺腺癌相关抗原MUC1 mRNA通过电转染DCs与同种同体T淋巴细胞共培养,证实这种共培养的免疫效应细胞能增强抗肿瘤免疫,为临床的非小细胞肺癌的免疫治疗提供理论和实验依据。同时肿瘤负载DCs的治疗模式也为其它肿瘤的生物治疗提供了参考价值,建立一种个体化的以DCs为基础的肿瘤治疗模式。
[参 考 文 献]
[1] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008∶GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12):2893-2917.
[2] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1):9-29.
[3] Kakimi K, Nakajima J, Wada H. Active specific immunotherapy and cell-transfer therapy for the treatment of non-small cell lung cancer[J]. Lung Cancer, 2009, 65(1):1-8.
[4] Van Nuffel AM, Benteyn D, Wilgenhof S, et al. Dendritic cells loaded with mRNA encoding full-length tumor antigens prime CD4+and CD8+T cells in melanoma patients[J]. Mol Ther, 2012, 20(5):1063-1074.
[5] Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells[J]. Nat Rev Cancer, 2012, 12(4):265-277.
[6] Bodey B, Bodey BJ, Siegel SE, et al. Failure of cancer vaccines: the significant limitations of this approach to immunotherapy[J]. Anticancer Res, 2000, 20(4):2665-2676.
[7] Garcia-Lora A, Algarra I, Collado A, et al. Tumour immunology, vaccination and escape strategies[J]. Eur J Immunogenet, 2003, 30(3):177-183.
[8] 傅永强, 张在云, 李旭升, 等. 白细胞介素18干预诱导的树突状细胞表型和活性研究[J]. 中国病理生理杂志, 2008, 24(7):1414-1417.
[9] Chen J, Li HY, Wang D, et al. Human dendritic cells transfected with amplified MUC1 mRNA stimulate cytotoxic T lymphocyte responses against pancreatic cancerinvitro[J]. J Gastroenterol Hepatol, 2011, 26(10):1509-1518.
[10] Ponsaerts P, Van Tendeloo VF, Berneman ZN. Cancer immunotherapy using RNA-loaded dendritic cells[J]. Clin Exp Immunol, 2003, 134(3):378-384.
[11] Van Camp K, Cools N, Stein B, et al. Efficient mRNA electroporation of peripheral blood mononuclear cells to detect memory T cell responses for immunomonitoring purposes[J]. J Immunol Methods, 2010, 354(1-2):1-10.
[12] Acres B, Limacher JM. MUC1 as a target antigen for cancer immunotherapy[J]. Expert Rev Vaccines, 2005, 4(4):493-502.
[13] Roulois D, Gregoire M, Fonteneau JF. MUC1-specific cytotoxic T lymphocytes in cancer therapy: induction and challenge[J]. Biomed Res Int, 2013, 2013:871936.
[14] Saintigny P, Coulon S, Kambouchner M, et al. Real-time RT-PCR detection of CK19, CK7 and MUC1 mRNA for diagnosis of lymph node micrometastases in non small cell lung carcinoma[J]. Int J Cancer, 2005, 115(5):777-782.
[15] Bhatia S, Edidin M, Almo SC, et al. B7-1 and B7-2: similar costimulatory ligands with different biochemical, oligomeric and signaling properties[J]. Immunol Lett, 2006, 104(1-2):70-75.
[16] Prechtel AT, Steinkasserer A. CD83: an update on functions and prospects of the maturation marker of dendritic cells[J]. Arch Dermatol Res, 2007, 299(2):59-69.
[17] 杨 蕾. 癌胚抗原mRNA及SW480细胞总RNA负载成熟树突状细胞体外诱导的特异性抗肿瘤作用[D]. 长春: 吉林大学, 2009.
[18] 何广胜, 周 玲, 吴德沛. Th1和Th2细胞的分化调节机制[J]. 中华血液学杂志, 2005, 26(2):125-128.
[19] Figdor CG, de Vries IJ, Lesterhuis WJ, et al. Dendritic cell immunotherapy: mapping the way[J]. Nat Med, 2004, 10(5):475-480.
[20] Langenkamp A, Casorati G, Garavaglia C, et al. T cell priming by dendritic cells: thresholds for proliferation, differentiation and death and intraclonal functional diversification[J]. Eur J Immunol, 2002, 32(7):2046-2054.

