巨桉根系分解对菊苣生长及光合特性的影响
吴秀华, 泮永祥,胡庭兴,*,段晓宇,赵 敏, 胡红玲,陈 洪,曾凡明
(1. 四川农业大学林学院, 雅安 625014; 2. 四川农业大学风景园林学院, 雅安 625014;3. 济南园林开发建设集团有限公司, 济南 250002)
巨桉根系分解对菊苣生长及光合特性的影响
吴秀华1, 泮永祥1,胡庭兴1,*,段晓宇2,赵 敏3, 胡红玲1,陈 洪1,曾凡明1
(1. 四川农业大学林学院, 雅安 625014; 2. 四川农业大学风景园林学院, 雅安 625014;3. 济南园林开发建设集团有限公司, 济南 250002)
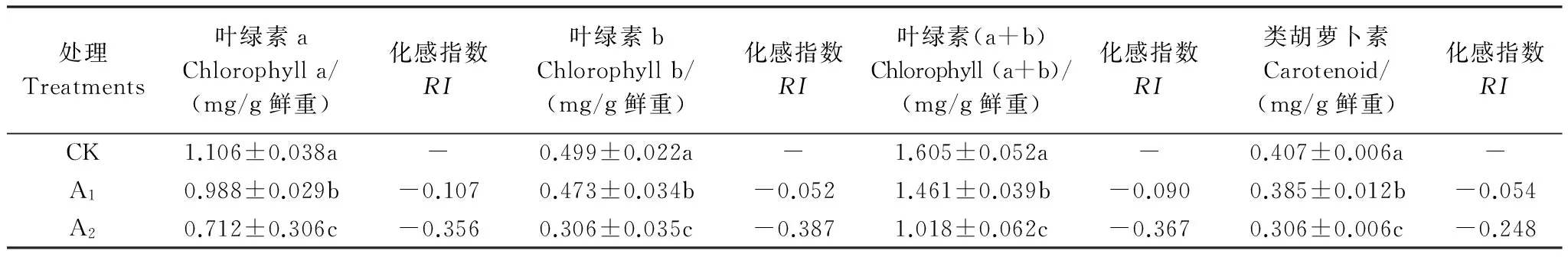
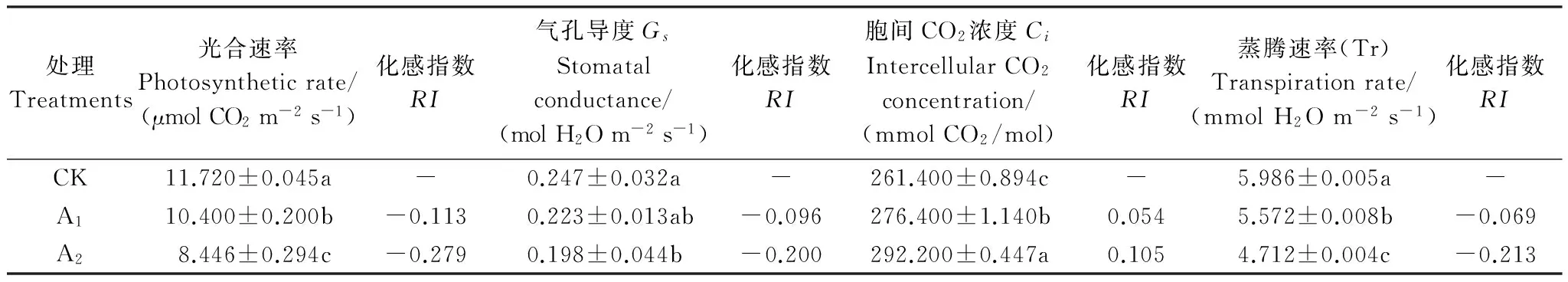
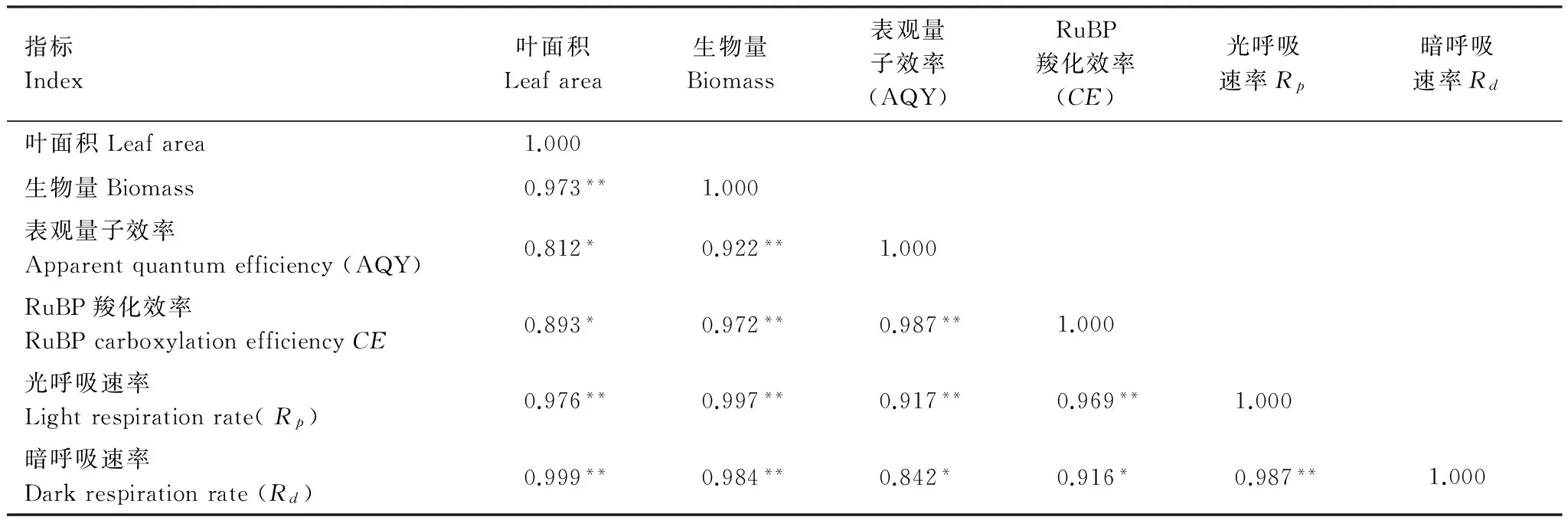
巨桉是我国退耕还林过程中采用的重要速生树种之一,被广泛用于人工造林。采用盆栽试验,研究了巨桉根系分解初期对菊苣幼苗生长和光合生理特性的影响。试验设置A1(50 g/盆)、A2(100 g/盆)和对照(CK)3个根系水平,将各处理的根系分别与10 kg土壤混合后装盆,播种菊苣。待A2处理植株的第3片真叶完全展开后测定菊苣光合生理指标及相关生长指标。结果表明:在巨桉根系分解初期,明显抑制了菊苣高生长、根生长、生物量积累、叶面积扩展及光合色素的合成,且随着根系添加量的增加抑制作用加大;菊苣叶片胞间CO2浓度(Ci)增加,而净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)均显著低于对照;随土壤中根系含量的增加,除CO2补偿点(CCP)呈增加趋势外,其他光响应和CO2响应的特征参数均呈明显的下降趋势,并与对照差异显著;各生长指标除与胞间CO2浓度呈现出负相关外,与其它光合特征参数、光合色素以及相应的响应曲线参数之间均呈现出显著或极显著的正相关关系;通过GC-MS检测表明,巨桉根系中含有2,6-二叔丁基对甲酚、N-甲基苯乙胺等多种具有化感潜力化学物质,在其分解过程中,这些化感物质逐步释放并作用于受体植物,抑制其光合色素合成和光合作用,降低其环境适应能力,从而抑制菊苣的生长。
巨桉;根系;菊苣;化感; 化感物质;光合作用
近年来,由于生态恢复和经济发展的需要,我国大量引进外来速生树种,其中桉树因其具有速生、丰产、优质、适应性强、用途广泛等特点,而被广泛引种栽植[1]。桉树在产生巨大经济价值的同时,也引起了一系列的生态环境问题,如土壤退化、土地生产力下降、生物多样性减弱等[2],因此受到人们的广泛关注。有研究表明桉树会释放某些化学物质以抑制林内伴生植物的生长,从而导致林内群落结构简单,林下灌木和草本植物稀少,进而引起较为严重的水土流失[3- 5]。
巨桉(Eucalyptusgrandis)属桃金娘科(Myrtaceae)桉树属(Eucalyptus)常绿乔木,原产澳大利亚东部沿海,因其具有适应性强、经济价值高等特点而被广泛用于人工造林[6- 7]。随着巨桉人工林的快速发展,其对生态环境的影响受到广泛关注。据报道,巨桉凋落物、根系分泌物及栽植土壤中含有烷烃、芳香酸酯和烯烃类等9类主要有机物质[8],其中酚类、萜类和酯类是有化感效应的有机组分,因此大面积种植巨桉人工纯林可能导致林下生物多样性下降,进而影响生态环境的良性循环。此外在巨桉这种短经营周期工业原料人工林更新采伐后会在土壤中留下大量根系凋落物,而这种根系在其分解过程中,是否会对采伐迹地上种植的短周期作物如牧草、蔬菜以及粮食作物等产生影响也是人们关注的议题之一。菊苣(Cichoriumintybus)为菊科菊苣属多年生草本,是一种高产优质的饲用牧草,兼有菜用、药用、食用和蜜源用等多方面的开发潜力[9]。若在巨桉人工林采伐后迹地闲置待整理期间以及下一代人工林更新初期进行复合种植,将有利于缓解巨桉人工林发展过程中的生态问题并增加林农的经济收入,对提高林地利用效益具有重要作用。因此,探讨巨桉对菊苣化感作用的强弱、作用机制具有较强的现实意义。
目前,已有研究通过盆栽试验的方法,探讨了巨桉凋落叶在土壤里分解过程中对受体植物牧草生长的影响[10- 11],而对林木根系在土壤中分解是否对受体植物能产生影响,影响的强弱及其作用规律等还鲜见报道。本研究拟通过盆栽试验,模拟自然状态下,土壤中巨桉根系在其分解过程中对菊苣生长的影响,探讨巨桉根系可能产生的化感作用及其作用规律,以期丰富对巨桉人工林生态问题的研究内容,同时为桉树人工林的合理经营提供基础数据与技术参考。
1 研究地区与研究方法
1.1 研究地概况
试验地设于四川省雅安市四川农业大学科研园区内,海拔580 m。该地区属亚热带湿润气候,阴雨较多,光照不足,多年平均气温16.2 ℃,≥10 ℃的积温5231 ℃,7月平均最高气温29.9 ℃,1月平均最低气温3.7 ℃,年均日照时数1039.6 h,无霜期298 d,多年平均降雨量1774.3 mm,空气平均湿度79%。
1.2 试验设计
供试土壤为盆栽巨桉幼树2 a后,去除活体巨桉幼树根系及凋落物的土壤,基本理化性质为:pH值 8.24,全氮0.516 g/kg,全磷0.502 g/kg,全钾4.386 g/kg,速效磷11.654 mg/kg,速效钾12.032 mg/kg。试验用土壤先过1 cm筛,然后用多菌灵进行消毒,晾晒1周,混匀后装入口径27 cm,底径17 cm,高22 cm的聚乙烯塑料盆中,每盆装土10 kg。供试根系为盆栽2年生巨桉幼树,采用收获法取出直径小于5 mm的根系,并计算各盆鲜根占土壤的重量比例,然后将其剪成长度1—1.5 cm小段,以便与土壤混合。供试菊苣种子在播种前用0.05% KMnO4溶液消毒20 min,洗净,用温水浸种2 h。
采用单因素随机试验设计,按照各盆鲜根占土壤的重量比例设置基本量A1(50 g/盆)、1倍基本量A2(100 g/盆) 2个根系添加水平,并以0 g/盆为对照(CK),每个根系添加水平设置10个重复,共40盆。2010年3月2日,将预先称量的根系与土壤混合均匀,然后一次性浇透水,之后隔天浇水,用HH2土壤水分速测仪(ML2x,GBR)监测并控制土壤含水量,保持盆内土壤湿度为田间持水量的80%(土壤容积含水量约18%),1周后(2011年3月10日)播种菊苣。播种前先在盆土表面覆土(厚度0.5 cm,过1 cm筛),其上均匀播撒种子,然后再覆盖1 cm厚的土壤,浇透水以利于发芽。待各处理全部出芽后进行一次间苗,进行常规田间管理,第1片真叶完全展开后第2次间苗。待A2处理的第3片真叶完全展开后,选择晴天(2010年5月17日和19日)测定其光合生理特征参数,然后取样测定菊苣各项生长指标。
此外为获得巨桉根系中化学物质的种类及含量,将试验所用根系风干粉碎,以正己烷做浸提剂,超声波清洗仪提取,浓缩得到样品,采用气相色谱-质谱法(GC-MS)测定巨桉根系原样中主要化学成分及相对含量。
1.3 测定指标及方法
1.3.1 叶片光合生理特征参数的测定
采用LI- 6400便携式光合测定仪(LI-COR Inc., USA),人工控制CO2浓度400 μmol CO2/mol,温度25 ℃,光照强度1200 μmol m-2s-1,测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),每次测定重复3次。
应用LI- 6400的红蓝光源和液化CO2钢瓶注入系统,并设定叶片温度为(25±1) ℃,空气湿度为70%,测定光合-光响应曲线(Pn-PAR)和光合-CO2响应曲线(Pn-Ci)。Pn-PAR曲线:设置CO2浓度为400 μmol CO2/mol,由高到低设定光强为2000、1600、1200、800、600、400、200、150、100、50和0 μmol m-2s-1,运用自动测量程序测定;Pn-Ci曲线:设定PAR为1200 μmol m-2s-1,采用Li- 6400- 01液化CO2钢瓶提供不同的CO2体积分数,设定CO2浓度梯度为0、50、75、100、150、200、400、600、800、1200和1600 μmol CO2/mol,运用自动测量程序测定。测定时选取完整无病害的植株,每个处理测定3株,每株选取1个相同叶位(从中央数的第3片完全展开叶的中间部位)叶片,分别挂牌标记,测定时保持叶片自然生长角度不变。各光合生理参数测定选择在9:00—11:00之间进行。
1.3.2 生物量、叶面积及色素含量的测定
将各处理植株整体取出,随机选取各处理有代表性的植株,测定株高和根长后,将其置于烘箱中105 ℃下杀青,80 ℃下烘干后测定其地上、地下部分干质量(每个处理设置重复3次,每个重复选取10株植物),并计算出根冠比(地下部分干质量/地上部分干质量);采集各处理同一部位成熟叶片,用LI- 3100便携式激光叶面积仪(-COR,USA)测定其叶面积;将测定光合参数的叶片带回实验室,用“丙酮-乙醇混合液提取法”提取色素,并采用723PC型分光光度计测定色素含量[12]。
1.3.3 根系化学成分测定化感
(1)化学物质的提取 将巨桉根系碎至30目取20 g于具塞锥形瓶,加正己烷40 mL淹没样品,超声波浸提20 min,过滤浸提液于磨口锥心瓶中;再加入20 mL正己烷于样品瓶,超声波浸提10 min,过滤浸提液。所得滤液混合并于25 ℃低压真空旋转浓缩至5 mL,用0.45 μm微孔滤膜过滤,作GC-MS检测。
(2)GC-MS的检测条件 HP 6890气相色谱仪(HP,USA)、HP 5973质量选择检测器(HP,USA)、Agilent Chemstation分析软件。色谱柱30 cm×0.25 mm ×0.25m,HP-5MS;进样口分流比为5∶1;进样体积为1L;载气流速1.0 mL/min (He);离子源EI。箱温度程序:起始温度为60 ℃(1 min),以5 ℃/min 升温至270 ℃,保持20 min,然后以10 ℃/min升温至300 ℃;进样温度为270 ℃;离子源温度为230 ℃,接口温度为280 ℃;电离电压70 eV;四极杆温度150 ℃。
1.4 数据处理
采用Photosyn Assistant 1.1.2光合分析软件对光合响应曲线进行拟合。采用直角双曲线模式进行光合-CO2响应曲线拟合。其表达式为:
Pn=(CE×Ci×Pnmax) / (CE×Ci+Pnmax) -Rp
式中,CE为植物RuBP表观羧化效率;Ci为胞间CO2浓度;Pn max为一定光强下饱和CO2时的最大表观光合速率;Rp为植物的光呼吸速率。将CO2浓度为200 μmol CO2/mol以下的Pn-Ci响应曲线进行直线回归, 其斜率即为羧化效率。
采用非直角双曲线模型拟合光响应曲线,并计算光响应特征参数,模型表达式为:
Pn= {αI+Pnmax-Sqrt [ (αI+Pnmax)2- 4×K×α×I×Pnmax]}/(2 ×K) -Rd
式中,Pn为净光合速率;α为表观量子效率(AQY);Pnmax为最大净光合速率;I为光合有效辐射(PAR);K为光响应曲线的曲角;Rd为暗呼吸速率。将光强为200μmol m-2s-1以下的Pn-PAR响应曲线进行直线回归, 其斜率即为表观量子效率,该方程与最大净光合速率的交点即为光饱和点(LSP),与x轴的交点即为光补偿点(LCP)。
化感作用敏感指数(RI)采用 Willamson 和 Richardson[13]的方法计算,即
RI= 1-C/T(T≥C)
或
RI=T/C-1 (T 式中,C为对照值,T为处理值,当RI>0时,表示促进作用;当RI<0时,表示抑制作用。RI绝对值的大小代表化感作用强度。 采用 SPSS16.0统计分析软件(SPSS Inc, USA) 对数据进行相关分析、单因素方差分析(One-way ANOVA),并用最小显著差数法(LSD法)进行多重比较。显著性水平设定为α= 0.05。 2.1 巨桉根系分解对菊苣形态生长的影响 随着土壤中巨桉根系施用量的增加,菊苣各项生长指标均呈降低趋势(表1)。与对照(CK)相比,各根系处理的株高、根长、叶面积和总生物量均显著降低,其中A2处理下的各指标分别下降了42.1%、24.9%、47.0和60.8%(RI<0);根冠比大小顺序为CK>A2>A1,各处理与CK差异不显著,地上与地下部分对化感物质的敏感性并没有显著差异。这表明巨桉根系在分解初期能明显抑制菊苣生物量的积累和叶片的伸展,且随着根系施加量的增加,抑制作用逐渐加大。 表1 巨桉根系分解对菊苣幼苗生长指标的影响 同列不同小写字母表示处理间差异显著 (P< 0.05) 2.2 巨桉根系分解对菊苣光合色素含量及光合特征参数的影响 2.2.1 对菊苣叶片光合色素含量的影响 随着巨桉根系量的增加,菊苣幼苗叶片各种光合色素含量均显著降低(表2)。与CK相比,A2处理的叶片叶绿素a+b [Chl(a+b)]、叶绿素a (Chl a)、叶绿素b (Chl b)分别降低了36.7%、35.6%和38.7%(RI<0);对比发现,巨桉根系化感作用对Chl a 的抑制大于Chl b;类胡萝卜素(Car)的变化趋势与叶绿素一致,各处理抑制作用显著,且随着根系量的加大,抑制作用增强,A2处理比CK下降了24.8%。 表2 巨桉根系分解对菊苣幼苗色素含量的影响 同列不同小写字母表示处理间差异显著(P< 0.05) 2.2.2 对菊苣叶片净光合速率(Pn)和气体交换参数的影响 由表3可以看出,随着土壤中巨桉根系量的增大,菊苣Pn、Tr和Gs均呈降低趋势,且各处理与CK差异显著,均表现为负效应(RI<0),其中A2处理负效应最强,各指标分别比CK减少27.9%、21.3%和20.0%;而Ci则呈现增加趋势,且各处理间差异达显著水平。 表3 巨桉根系分解初期对菊苣幼苗光合速率和气体交换参数的影响 Table 3 Effect of decomposing root ofEucalyptusgrandison photosynthetic rate and gas exchange parameters ofCichoriumintybusseedlings 处理Treatments光合速率Photosyntheticrate/(μmolCO2m-2s-1)化感指数RI气孔导度GsStomatalconductance/(molH2Om-2s-1)化感指数RI胞间CO2浓度CiIntercellularCO2concentration/(mmolCO2/mol)化感指数RI蒸腾速率(Tr)Transpirationrate/(mmolH2Om-2s-1)化感指数RICK11.720±0.045a-0.247±0.032a-261.400±0.894c-5.986±0.005a-A110.400±0.200b-0.1130.223±0.013ab-0.096276.400±1.140b0.0545.572±0.008b-0.069A28.446±0.294c-0.2790.198±0.044b-0.200292.200±0.447a0.1054.712±0.004c-0.213 同列不同小写字母表示处理间差异显著(P< 0.05) 2.3 不同巨桉根系添加量对菊苣Pn-Ci曲线和Pn-PAR曲线的影响 2.3.1 对菊苣Pn-Ci曲线的影响 由图1可知,各处理菊苣的Pn-Ci响应曲线之间存在明显的梯度关系,在低CO2浓度区域内(0—400 μmol CO2/mol),随着CO2浓度的增强,各根系施用量处理下菊苣叶片净光合速率迅速上升;随巨桉根系施用量的增大,响应曲线的增幅逐渐减小,曲线渐变平缓,当CO2浓度大于800 μmol CO2/mol时,各凋落叶处理之间Pn差异显著,表现为CK> A1> A2,表明随着根系施用量的增加,在较高CO2浓度状态下的净光合速率均受到了抑制。 图1 根系不同添加量处理下的菊苣叶片光合- CO2响应和光合-光响应曲线Fig.1 Light response curve and CO2 response curve of photosynthesis in Cichorium intybus leaves under different root treatments 由表4可知,随巨桉根系施用量的增加,除CCP呈增加的趋势外,CE、Pnmax、CSP及Rp均呈现明显的下降趋势并且各处理与CK差异显著。CE反映了植物在给定条件下对CO2的同化能力,CE值大,则表示在较低的CO2浓度下有较高的光合速率[14],与CK相比,A1处理的CE无差异,而A1、A2处理下的Pnmax、CSP及Rp均呈显著差异,同时处理间也呈显著差异,在A2时CE、Pnmax、CSP及Rp分别比CK减少了33.9%、5.5%、5.5%和13.6%;CCP在各处理间的变化顺序为:A2>A1>CK,A2比CK增加了41.4%。 由图1A可知,各处理菊苣的Pn-Ci响应曲线之间存在明显的梯度关系,在低CO2浓度区域内(0—400 μmol CO2/mol),随着CO2浓度的增强,各根系施用量处理下菊苣叶片净光合速率迅速上升;随巨桉根系施用量的增大,响应曲线的增幅逐渐减小,曲线渐变平缓,当CO2浓度大于800 μmol CO2/mol时,各凋落叶处理之间Pn差异显著,表现为CK> A1> A2,表明随着根系施用量的增加,在较高CO2浓度状态下的净光合速率均受到了抑制。 由表4可知,随巨桉根系施用量的增加,除CCP呈增加的趋势外,CE、Pnmax、CSP及Rp均呈现明显的下降趋势并且各处理与CK差异显著。CE反映了植物在给定条件下对CO2的同化能力,CE值大,则表示在较低的CO2浓度下有较高的光合速率[14],与CK相比,A1处理的CE无差异,而A1、A2处理下的Pnmax、CSP及Rp均呈显著差异,同时处理间也呈显著差异,在A2时CE、Pnmax、CSP及Rp分别比CK减少了33.9%、5.5%、5.5%和13.6%;CCP在各处理间的变化顺序为:A2>A1>CK,A2比CK增加了41.4%。 表4 不同根系量处理的菊苣CO2响应特征参数 同列不同小写字母表示处理间差异显著(P< 0.05) 2.3.2 对菊苣Pn-PAR曲线的影响 从图1B可以看出,随着光合有效辐射PAR的增强,在低光强(<200 μmol m-2s-1)时,各巨桉根系施用量下菊苣叶片Pn迅速上升,但处理之间差异不显著;随着光合有效辐射的继续升高,增加逐渐缓和并呈稳定趋势;当PAR>400 μmol m-2s-1时,各巨桉根系处理间的Pn差异显著,表现为CK> A1> A2。 表5 不同根系处理的菊苣幼苗叶片光响应特征参数 同列不同小写字母表示处理间差异显著(P< 0.05) 在一定环境条件下,叶片的最大光合速率表示了叶片的最大光合作用能力[15],表观量子利用效率反映了叶片对光能的利用情况,尤其是对弱光的利用能力[16]。本研究中,A1、A2处理的菊苣幼苗叶片AQY、Pnmax、LSP、LCP、Rd均显著低于CK并呈下降趋势;与CK相比,A2处理的AQY降低了25.6%,A1和A2的Pnmax分别降低了36.1%和51.8%,A2处理的LSP、LCP与Rd值最小,分别降低了38.6%、68.6%和74.6%(表5)。 2.3.3 菊苣的主要生长指标与响应曲线参数之间的相关性分析 如表6所示,菊苣生物量和叶面积与响应曲线主要参数AQY、CE之间呈显著或极显著正相关;生物量与Rd(R=0.999)呈极显著正相关;叶面积与Rp(R=0.976)呈极显著正相关;各主要响应曲线参数之间表现出正相关,其中AQY与Rp(R=0.917)和CE(R=0.987)呈极显著正相关。由此看出,AQY、CE、Rp及Rd与色素等非气孔因素共同作用影响植物的光合作用,进而对植物生长产生明显影响。 表6 菊苣主要生长指标与响应曲线参数之间的相关系数 2.4 巨桉根系分解过程中主要化学成分分析 通过Agilent Chemstation化学工作站检索Nist标准质谱图库确认化学成分,并通过该站数据处理系统,对匹配指数(Qual)90以上的化合物进行鉴定,并通过峰面积归一化计算各组分相对百分含量(表7)。结果表明巨桉根系中的主要有2,6-二叔丁基对甲酚、1-甲基,1-乙基-环己烷、十八烷、二十烷、二十二烷、正二十三烷、二十四烷、二十五烷、二十七烷、二十八烷、正三十烷、β-谷甾醇、N-甲基苯乙胺、六甲基环三硅氧烷等14种有机成分。这些物质中,烷类最多,占63.8%,其次是β-谷甾醇,占31.2%,在这些化学成分中,2,6-二叔丁基对甲酚、N-甲基苯乙胺,正二十三烷等均具有化感潜力。 表7 巨桉根系中的主要有机组分 “相对含量”指各组分在GC-MS分析中出峰面积占总峰面积的比例 植物生长既要从土壤中摄取营养,又要对土壤产生一定的影响,植物根系的生理特性和根-土界面的物理和化学环境是影响植物生长的主要因素之一[17- 18]。根系作为植物与土壤的接触面,在从土壤中吸收水分、养分的同时,通过分泌和死根腐解的方式向根周围释放出各种化合物,产生根际效应,进而调控或影响邻近植物的生长发育[19]。大量研究表明植物可以通过根系分泌和死根分解的方式向土壤中释放糖类、养分元素以及分子量较小、结构简单的次生代谢物,这些物质进入土壤环境后,影响植物种子萌发、植株的生长发育[20- 22]以及土壤微生物活性。本研究通过对巨桉根系分析鉴定出14种有机化合物,这与高丹等[23]、王晗光等[8]、汪金刚等[24]对巨桉根系化学成分分析得出的具体种类及数量存在一定差异,这可能是由于巨桉根系来源地不同、林龄不同等原因造成的[25]。高丹等[23]和王晗光等[8]的表明,巨桉根系及根际土壤存在的化感物质主要是芳香族和烷烃,这些物质可能具有抑制种子萌发、幼苗生长、杂草生长[26- 27]等化感作用,本研究结果亦显示A1、A2处理菊苣的株高、根长、叶面积和生物量均受到显著抑制。 光合作用是植物极为重要的代谢过程,它的强弱对植物生长、产量及其抗逆性均具有十分重要的作用,因而光合作用常作为判断植物生长和抗逆性强弱的指标[28]。本研究结果显示处理A1、A2的气孔导度(Gs)较小,气孔限制值较高,不利于水分和气体扩散,从而导致蒸腾速率(Tr)下降,表明巨桉根系分解初期抑制了菊苣叶片气孔开放和水分蒸腾,这与陈有根等[29]和Mersie[30]的研究结果一致。此外,巨桉根系处理显著抑制了菊苣叶片光合色素的积累,许多研究均得到了相似的结果,如香草酸、阿魏酸、肉桂酸、苯甲酸等10多种化感物质处理大豆(Glycinemax),可使其叶绿素含量显著下降[31- 32];周凯等[33]对菊花(Dendranthemamorifolium)、贾黎明等[34]对油松(Pinustabulaeformis)和郁继华等[35]对茄子(Solanummelongena)的研究亦表明化感物质能使得光合色素显著降低。本研究中,A1、A2处理还显著抑制了菊苣叶片表观量子效率(AQY)、RuBP羧化效率(CE)、暗呼吸速率(Rd)及光呼吸速率(Rp),表明化感物质降低了植物对光能及CO2的利用能力,而处理A1、A2的光补偿点(LCP)与光饱和点(LSP)的差值以及CO2补偿点(CCP)与CO2饱和点(CSP)之间的差值均低于CK,也说明化感物质可能降低了植物对环境中CO2浓度和光环境改变的适应能力。本研究结果表明化感物质可以通过影响受体Gs、Ci和Tr等气孔因素直接影响光合作用,同时也可以通过对光合色素、CE和 AQY等非气孔因素产生影响而间接影响光合作用,即当叶绿素含量下降、光合酶活性降低、必然导致菊苣光合能力下降,光合产物减少,进而导致菊苣生物量显著降低。 综上,巨桉根系分解释放的化感物质进入植株体后破坏了植株光合机构和光合生理活性,造成其体内与光合作用有关的许多活性成分含量降低或遭到破坏,同时抑制了气孔开放。这些因素降低了菊苣的光合能力,进而限制叶面积增长和高生长,最终影响生物量积累。 [1] Wen Y G, Liu S R, Chen F. The ecological problems and sustainable management ofEucalyptusindustrial plantation. Journal of Guangxi Academy of Sciences, 2005, 21(1): 13- 18. [2] Liu X X, Xie L L, Chen Q B, Wang Z H. A review of allelopathic researches onEucalyptus. Chinese Journal of Tropical Agriculture, 2004, 24(2): 54- 61. [3] del Moral R, Muller C H. The allelopathic effects ofEucalyptuscamaldulensis. American Midland Naturalist, 1970, 83(1): 254- 282. [4] May F E, Ash J E. An assessment of the allelopathic potential ofEucalyptus. Australian Journal of Botany, 1990, 38(3): 245- 254. [5] Wang Z H, Duan C Q, Qi L C, Zhang S B, Xu D H. A preliminary investigation of ecological issues arising in the man-made forest ofEucalyptusin China. Chinese Journal of Ecology, 1998, 17(6): 64- 68. [6] Wang H R, ZhengY Q, Zang D Q, Zhang Z, Huang Y X. Species introduction ofmonocalyptusto southwestern China and its biogeographic implications. Scientia Silvae Sinicae, 1999, 35(2): 2- 6. [7] Zhang J, Yang W Q. Ecosystem Researches on Eucalypt (Eucalyptusgrandis) Short-Term Rotation Plantation. Chengdu: Sichuan Science and Technology Press, 2008. [8] Wang H G, Zhang J, Yang W S, Hang Q M, Zou P. A research on the allelopathic substances in root system and root system soil ofEucalyptusGrandis. Journal of Sichuan Normal University: Natural Science, 2006, 29(3): 368- 371. [9] Luo Y, Bai S Q, Peng Y, Zhang Y. Research progress on germplasm resources ofCichoriumintybus. Pratacultural Science, 2010, 27(7): 123- 132. [10] Chen H, Hu T X, Yang W Q, Wu X H, Yin L, Li B, Mi X H, Zeng F M, Gong P. Effects ofEucalyptusgrandisleaf litter on growth and resistance physiology ofElymussibiricusin the initial decomposition process of litter in soil. Acta Prataculturae Sinica, 2011, 20(5): 57- 65. [11] Wu X H, Hu T X, Yang W Q, Chen H, Hu H L, Tu L H, Pan Y X, Zeng F M. Effects ofEucalyptusgrandisleaf litter decomposition on the growth and photosynthetic characteristics ofCichoriumintybus. Chinese Journal of Applied Ecology, 2012, 23(1): 1- 8. [12] Liu Y W. Study on rapid determination of chlorophyll content of leaves. Chinese Journal of Spectroscopy Laboratory, 2002, 19(4): 478- 481. [13] Williamson G B, Rich A D. Bioassays for allelopathy: Measuring treatment responses with independent controls. Journal of Chemical Ecology, 1998, 14(1): 181- 187. [14] Tong F P, Xu Y P, Song Q A, Long Y Z, Yi A Q, Li G. The variance rule of character parameters responding to light and CO2ofslashpine′s half-sib. Journal of Nanjing Forestry University: Natural Sciences, 2009, 33(1): 54- 58. [15] Lu P L, Luo Y, Liu J D, Yu Q. Characteristic parameters of light response curves of photosynthesis of winter wheat in north China. Quarterly Journal of Applied Meteorology, 2000, 11(2): 236- 241. [16] Jian H Y, Zou S Q. The photosynthetic characteristics in leaves of carpetgrass-Axonopuscompressus. Guihaia, 2003, 23(2): 181- 184. [18] Shao L W, Sun H Y, Chen S Y, Zhang X Y. An overview of root hydraulic lift in root-soil systems. Chinese Journal of Eco-Agriculture, 2011, 19(5): 1080- 1085. [19] Tu S X, Wu J. A review on research methods of root exudates. Ecology and Environment, 2010, 19(9): 2493- 2500. [20] Zhou B L, Chen Z X, Du L, Xie Y H, Ye X L. Allelopathy of the root exudates from different resistant eggplants to verticillium wilt (VerticilliumdahliaeKleb.). Acta Ecologica Sinica, 2011, 31(14): 3964- 3972. [21] Xie X M, Liao M, Yang J. Effects of pyrene on low molecule weight organic compounds in the root exudates of ryegrass (LoliumperenneL.). Acta Ecologica Sinica, 2011, 31(24): 7564- 7570. [22] Zhou Y L, Wang Y, Li J Y, Xue Y J. Allelopathy ofGarlicroot exudates. Chinese Journal of Applied Ecology, 2011, 22(5): 1368- 1372. [23] Gao D, Hu T X, Wan X, Tang T Y, Chen L H. Allelopathic constituents from litterfall ofEucalyptusgrandis. Journal of Zhejiang Forestry College, 2008, 25(2): 191- 194. [24] Wang J G, Zhang J, Li X W. The study on spatial distribution of allelochemicals in the soil ofEucalyptusgrandisplantation. Journal of Sichuan Agricultural University, 2007, 25(2): 121- 126. [25] Wang H G, Zhang J, Yang W S, Wang X X, Cheng L. A comparative research on the allopathic ofEucalyputsgrandisin different woodland. Journal of Hebei Normal University: Natural Science Edition, 2009, 33(1): 94- 99. [26] Zhou Y L, Cheng Z H, Meng H W. Allelopathy of garlic root exudates on different receiver vegetables. Chinese Journal of Applied Ecology, 2007, 18(1): 81- 86. [27] He H B, Wang H B, Chen X X, Lin W X, Jia X L, Fang C X, Gan Q F, Ni N N, Wu W X. Allelopathic effects of aqueous extracts from different parts and root exudates of rice onbarnyardgrass. Chinese Journal of Eco-Agriculture, 2007, 15(2): 14- 17. [28] Hui H X, Xu X, Li Q R. Exogenous betaine improves photosynthesis ofLyciumbarbarumunder salt stress. Acta Botanica Boreali-occidentalia Sinica, 2003, 23(12): 2137- 2422. [29] Chen Y G, Zhu S D, Tao H, Zhu S Q, Wang D L. Effects ofGarlicroot aqueous extracts on the characteristics of photosynthesis and chlorophyll fluorescence ofMelonin continuous cropping soil. Chinese Agricultural Science Bulletin, 2008, 24(12): 339- 343. [30] Mersie W, Singh M. Phenolic acids affect photosynthesis and protein synthesis by isolated leaf cells of volvet-leaf. Journal of Chemical Ecology, 1993, 19(7): 1293- 1301. [31] Einhellig F A. Mechanism of action of allelochemicals in allelopathy. ACS Symposium Series, 1995, 582: 96- 116. [32] Patterson D T. Effects of allelopathic chemicals on growth and physiological responses of soybean (Glycinemax). Weed Science, 1981, 29: 53- 59. [33] Zhou K, Guo W M, Wang Z F, Hao F G. Autotoxicity of aquatic extracts fromChrysanthemumand rhizosphere soil on photosynthesis in the same plant species. Chinese Journal of Eco-Agriculture, 2009, 17(2): 318- 322. [34] Jia L M, Zhai M P, Fen C J. Effects of allelopathic substances on the growth and photosynthesis ofPinustabulaeformisseedlings. Journal of Beijing Forestry University, 2003, 25(4): 6- 10. [35] Yu J H, Zhang Y Liu C X, Li J J. Effects of two kinds of allelochemicals on photosynthesis and chlorophyll fluorescence parameters ofSolanummelongenaL. seedlings. Chinese Journal of Applied Ecology, 2006, 17(9): 1629- 1632. 参考文献: [1] 温远光, 刘世荣, 陈放. 桉树工业人工林的生态问题与可持续经营. 广西科学院学报, 2005, 21(1): 13- 18. [2] 刘小香, 谢龙莲, 陈秋波, 王真辉. 桉树化感作用研究进展. 热带农业科学, 2004, 24(2): 54- 61. [5] 王震洪, 段昌群, 起联春, 张世彪, 徐以宏. 我国桉树林发展中的生态问题探讨. 生态学杂志, 1998, 17(6): 64- 68. [6] 王豁然, 郑勇奇, 臧道群, 张泽, 黄永祥. 单蒴盖亚科属桉树引种及其生物地理学意义. 林业科学, 1999, 35(2): 2- 6. [7] 张健, 杨万勤. 短轮伐期巨桉人工林生态系统. 成都: 四川科学技术出版社, 2008. [8] 王晗光, 张健, 杨婉身, 黄乾明, 邹平. 巨桉根系和根系土壤化感物质的研究. 四川师范大学学报: 自然科学版. 2006, 29(3): 368- 371. [9] 罗燕, 白史且, 彭燕, 张玉. 菊苣种质资源研究进展. 草业科学, 2010, 27(7): 123- 132. [10] 陈洪, 胡庭兴, 杨万勤, 吴秀华, 尹丽, 李彬, 米小华, 曾凡明, 弓平. 巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响. 草业科学, 2011, 20(5): 57- 65. [11] 吴秀华, 胡庭兴, 杨万勤, 陈洪, 胡红玲, 涂利华, 泮永祥, 曾凡明. 巨桉凋落叶分解对菊苣生长及光合特性的影响. 应用生态学报, 2012, 23(1): 1- 8. [12] 刘洋文. 快速测定植物叶片叶绿素含量方法的探讨. 光谱实验室, 2002, 19(4): 478- 481. [14] 童方平, 徐艳平, 宋庆安, 龙应忠, 易霭琴, 李贵. 湿地松优良半同胞家系光和CO2响应曲线特征参数的变异规律. 南京林业大学学报: 自然科学版, 2009, 33(1): 54- 58. [15] 陆佩玲, 罗毅, 刘建栋, 于强. 华北地区冬小麦光合作用的光响应曲线的特征参数. 应用气象学报, 2000, 11(2): 236- 241. [16] 蹇洪英, 邹寿青. 地毯草的光合特性研究. 广西植物, 2003, 23(2): 181- 184. [17] 宋海星, 李生秀. 根系的吸收作用及土壤水分对硝态氮、铵态氮分布的影响. 中国农业科学, 2005, 38(1): 96- 101. [18] 邵立威, 孙宏勇, 陈素英, 张喜英. 根土系统中的根系水力提升研究综述. 中国生态农业学报, 2011, 19(5): 1080- 1085. [19] 涂书新, 吴佳. 植物根系分泌物研究方法评述. 生态环境学报, 2010, 19(9): 2493- 2500. [20] 周宝利, 陈志霞, 杜亮, 谢玉宏, 叶雪凌. 不同抗病性茄子根系分泌物对黄萎菌的化感作用. 生态学报, 2011, 31(14): 3964- 3972. [21] 谢晓梅, 廖敏, 杨静. 芘对黑麦草根系几种低分子量有机分泌物的影响. 生态学报, 2011, 31(24): 7564- 7570. [22] 周艳丽, 王艳, 李金英, 薛艳杰. 大蒜根系分泌物的化感作用. 应用生态学报, 2011, 22(5): 1368- 1372. [23] 高丹, 胡庭兴, 万雪, 唐天云, 陈良华. 巨桉枯落物化感物质的研究. 浙江林学院学报, 2008, 25(2): 191- 194. [24] 汪金刚, 张健, 李贤伟. 巨桉人工林土壤化感物质的空间分布特征的研究. 四川农业大学学报, 2007, 25(2): 121- 126. [25] 王晗光, 张健, 杨婉身, 王显祥, 程琍. 不同林地巨桉的化感物质比较研究. 河北师范大学学报: 自然科学版, 2009, 33(1): 94- 99. [26] 周艳丽, 程智慧, 孟焕文. 大蒜根系分泌物对不同受体蔬菜的化感作用. 应用生态学报, 2007, 18(1): 81- 86. [27] 何海斌, 王海斌, 陈祥旭, 林文雄, 贾小丽, 方长旬, 甘邱锋, 倪尼娜, 吴文祥. 化感水稻苗期不同器官水浸提液及根系分泌物对稗草的化感作用. 中国生态农业学报, 2007, 15(2): 14- 17. [28] 惠红霞, 许兴, 李前荣. 外源甜菜碱对盐胁迫下枸杞光合功能的改善. 西北植物学报, 2003, 23(12): 2137- 2422. [29] 陈友根, 朱世东, 陶鸿, 朱舜球, 王冬良. 大蒜根系水浸液处理对连作甜瓜光合及荧光特性的影响. 中国农学通报, 2008, 24(12): 339- 343. [33] 周凯, 郭维明, 王智芳, 郝峰鸽. 菊花不同部位及根际土壤水浸液处理对光合作用的自毒作用研究. 中国生态农业学报, 2009, 17(2): 318- 322. [34] 贾黎明, 翟明普, 冯长红. 化感作用物对油松幼苗生长及光合作用的影响. 北京林业大学学报, 2003, 25(4): 6- 10. [35] 郁继华, 张韵, 牛彩霞, 李建建. 两种化感物质对茄子幼苗光合作用及叶绿素荧光参数的影响. 应用生态学报, 2006, 17(9): 1629- 1632. Effects of decomposingEucalyptusgrandisroot on the growth and photosynthetic characteristics ofCichoriumintybus WU Xiuhua1, PAN Yongxiang1, HU Tingxing1,*, DUAN Xiaoyu2, ZHAO Min3, HU Hongling1, CHEN Hong1, ZENG Fanming1 1CollegeofForestry,SichuanAgriculturalUniversity,Ya′an625014,China2CollegeofLandscapeArchitecture,SichuanAgriculturalUniversity,Ya′an625014,China3JinanGardenDevelopmentandConstructionGroupCompanyLimited,Jinan250002,China In resent years, a large number of fast-growing exotic species had been introduced to south China for restoration and recon-struction of degraded ecosystem and economic development.Eucalyptusgrandis, one of important tree species, was widely used in the Project of Returning Farmland to Forest and also used in afforestation in mountainous area. With the rapid development ofE.grandisplantation, It has been not only brought tremendous economic benefits but also caused a series of ecological and environmental problems, such as soil degradation, the loss of soil nutrients, the decrease of soil productivity and the biological diversity shrinking, so its develop-ment has been attracted a great deal of controversy. It was reported thatE.grandiscould release certain chemical substances to inhibit the growth of the plants near and/or under the crown ofE.grandisplantations. It is of great practical significance to explore the allelopathic effects and mechanisms ofE.grandislitter(fallen leaves and dead roots) on some crops which were often intercropped withE.grandisin the system of agroforestry.Cichoriumintybuswas a kind of high-quality forage grass which was very common in south China, thus it was selected in this study.A pot experiment was conducted to study the effects ofE.grandisroot on the growth and the photosynthesis ofC.intybusduring its early stage of decomposition. Each pot contained 10 kg soil mixed with different amounts ofE.grandisroot (50 g/pot, A1; 100 g/pot, A2; and 0 g/pot, CK), and sowed withC.intybus. The growth indicators and the photosynthetic characteristics ofC.intybuswere measured after the third leaf of seedling fully expanded in treatment A2. The results were as follows. At the early stage ofE.grandisroot decomposition, the height, root and leaf area growth, biomass accumulation, and the content of photosynthetic pigment ofC.intybuswere significantly inhibited, and the inhibition effect was getting stronger with the increasing amount ofE.grandisroot addition; The intercellular CO2concentration(Ci) ofC.intybuswas increased by root addition, while net photosynthetic rate(Pn), stomatal conduct-ance(Gs) and transpiration rate(Tr) were significantly lower than those of the control; With the increase of root addition, all parameters of light response and CO2response ofC.intybusshowed an obviously downward trend except CO2compensation point, and there existed significant differences between the treatments of root additions and the control; The growth indexes showed a negative correlation with the intercellular CO2concentration, while it showed significant or extremely significant positive correlation with other photosynthetic parameters, photosynthetic pigments, and the corresponding parameters of the response curve; Detection wtith GC-MS showed thatE.grandis, roots contained chemical substances which had allelopathic potential, such as 2,6-Bis(1,1-dimethylethyl)-4-methylphenol and Benzeneeth-anamine, N-methl. It was indicated that, whenE.grandisroot decomposed, the allelopathic substances released gradually and acted on receptor plants, inhibited the synthesis of photosynthetic pigments and the photosynthesis of the receptors, decreased the adaptation ability of receptors to environment and accordingly, inhibited the growth ofC.intybus. Eucalyptusgrandis; root;Cichoriumintybus; allelopathy; allelopathic substance; photosynthesis 国家“十二五”科技支撑计划(2011BAC09B05); 四川省农作物育种攻关项目(2011NZ0098- 10); 四川省教育厅重点项目(09ZA079) 2012- 12- 25; 网络出版日期:2014- 03- 04 10.5846/stxb201212251866 *通讯作者Corresponding author.E-mail: hutx001@yahoo.com.cn 吴秀华, 泮永祥,胡庭兴,段晓宇,赵敏, 胡红玲,陈洪,曾凡明.巨桉根系分解对菊苣生长及光合特性的影响.生态学报,2014,34(16):4508- 4517. Wu X H, Pan Y X, Hu T X, Duan X Y, Zhao M, Hu H L, Chen H, Zeng F M.Effects of decomposingEucalyptusgrandisroot on the growth and photosynthetic characteristics ofCichoriumintybus.Acta Ecologica Sinica,2014,34(16):4508- 4517.2 结果与分析





3 讨论


