肝癌患者血浆PEDF和VEGF表达水平及其 与预后关系的探讨
朱莉丽,杨凯,刘亚
论著·临床
肝癌患者血浆PEDF和VEGF表达水平及其 与预后关系的探讨
朱莉丽,杨凯,刘亚
目的观察肝癌患者血浆色素上皮衍生因子(PEDF)及血管内皮生长因子(VEGF)表达水平并探讨其与预后的关系。方法采用ELISA法检测肝癌患者43例(肝癌组)、肝脏良性疾病患者20例(良性肝病组)及健康对照者20例(健康对照组)血浆PEDF和VEGF水平;肝癌患者平均随访(12.02±0.23)个月,记录短期主要不良终点事件(SMAE)发生情况。结果血浆PEDF水平肝癌组较良性肝病组及健康对照组明显降低(P<0.01),VEGF水平明显升高(P<0.01),而良性肝病组与健康对照组比较差异无统计学意义(P>0.05)。肝癌患者随访结束后,高PEDF/VEGF比值(≥3)亚组22例发生SMAE 3例(13.64%),低PEDF/VEGF比值(<3)亚组21例发生SMAE 7例(33.33%),Kaplan-Meier生存曲线显示2组差异有统计学意义(P=0.039)。另外,与未发生SMAE的肝癌患者(33例)比较,发生SMAE者(10例)有更低的PEDF/VEGF比值(2.14±0.76 vs. 3.49±1.12,P<0.01)。结论PEDF和VEGF参与肝癌的病理生理过程,低表达的PEDF及高表达的VEGF反映肝癌发生、发展及转移情况,两者比值可能成为预测肝癌转移及预后的有效指标。
肝癌;色素上皮衍生因子;血管内皮生长因子;预后;关系
肝癌(hepatocellular carcinoma, HCC)是最常见的恶性实体肿瘤之一[1],新生血管形成是其发生、发展和转移过程中极为关键的步骤[2]。当肿瘤生长至1 mm3以上时即需要肿瘤内血管生成,否则肿瘤静止于休眠状态而不会发生转移,一旦进入血管生长期肿瘤的转移潜能即迅速出现[3]。在众多血管新生调控因子中,色素上皮衍生因子(PEDF)与血管内皮生长因子(VEGF)发挥重要作用。PEDF抑制VEGF引起的血管内皮细胞迁移,选择性地抑制新生血管的形成,具有很强的抗血管生成作用[4,5]。因此,本研究应用ELISA法检测肝癌、良性肝脏疾病及健康对照3组人群血浆PEDF及VEGF水平,探讨其与肝癌侵袭转移及预后的关系。
1 资料与方法
1.1 临床资料 选择2008年5月—2013年5月诊治的肝癌患者43例,均符合肝癌诊断标准[6],根据临床症状、体征、超声或CT检查及肿瘤标记物等生化指标确诊,作为肝癌组,其中男29例,女14例;年龄26~68(57.3±8.7)岁;鳞癌21例,腺癌11例,腺鳞癌6例,小细胞肺癌5例;病程1~4(2.2±1.0)年,不伴有其他系统肿瘤。入选同期我院诊治的良性肝脏疾病患者20例为良性肝病组,其中男14例,女6例,年龄25~66(55.8±9.2)岁;慢性肝炎18例,肝硬化13例,肝囊肿9例。另外,随机选择同期健康查体者20例作为健康对照组,男16例,女4例;年龄24~61(49.7±10.5)岁,排除可能引起血浆PEDF改变的其他疾病,如其他系统肿瘤、糖尿病视网膜病、酒精性肝病、银屑病等。3组研究对象性别、年龄比较差异无统计学意义(P﹥0.05),具有可比性。试验过程中血标本采集经医院伦理委员会批准,研究对象均签署知情同意书。
1.2 血浆PEDF和VEGF含量检测 (1)血浆标本采集: 3组研究对象分别于清晨空腹抽取肘静脉血4 ml(EDTA抗凝),以3 000 r/min离心15 min,微量移液器取上清,-80℃保存待测。(2)PEDF与VEGF检测:血浆PEDF和VEGF含量检测采用ELISA法,试剂盒均购自深圳晶美生物工程有限公司,灵敏度分别为0.2 ng/ml、5 pg/ml,批内及批间变异均<9.5%。试验操作严格按照试剂盒说明书进行,每份标本检测2孔,取平均值。酶标仪450 nm处进行检测,5 min内测定各孔吸光度值(OD),根据标准曲线分别计算出PEDF及VEGF水平。
1.3 预后随访 通过门诊、住院或电话随访肝癌患者短期不良终点事件(short-term major adverse events,SMAE)发生情况,包括肝癌转移或复发、严重并发症或死亡等,死亡患者记录死亡时间及死亡原因。

2 结 果
2.1 血浆PEDF及VEGF水平 健康对照组、良性肝病组和肝癌组血浆PEDF水平分别为(12.25±2.19)μg/ml、(11.16±2.09)μg/ml 、(6.10±1.24)μg/ml。与健康对照组及良性肝病组比较,肝癌组患者血浆PEDF明显降低(P<0.01),良性肝病组与健康对照组比较差异无统计学意义(P﹥0.05)。见图1。3组研究对象血浆VEGF水平分别为(61.88±15.87)μg/ml、(63.47±13.94 )μg/ml和(194.80±14.60)μg/ml,与健康对照组及良性对照组比较,肝癌组患者血浆VEGF水平明显升高(P<0.01)。见图2。

注:与健康对照组比较,*P<0.01;与良性肝病组比较,#P<0.01

注:与健康对照组比较,*P<0.01;与良性肝病组比较,#P<0.01
2.2 肝癌患者PEDF/VEGF比值与近期预后的关系 根据PEDF/VEGF比值将所有肝癌患者分为高PEDF/VEGF比值(≥3)亚组22例和低PEDF/VEGF比值(<3)亚组21例,结果显示:高PEDF/VEGF比值亚组发生SMAE 3例(13.64%),低PEDF/VEGF比值亚组发生SMAE 7例(33.33%),2亚组比较差异有统计学意义(P=0.039)。见图3。
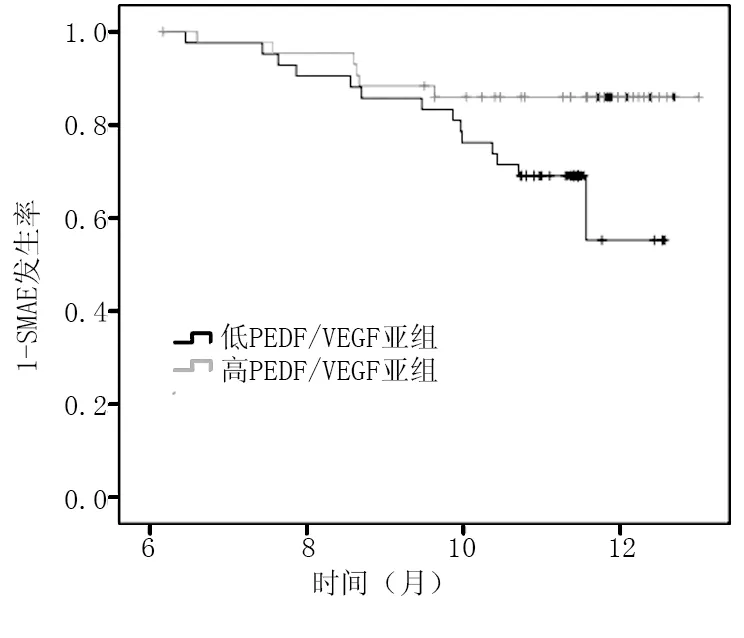
图3 不同PEDF/VEGF比值亚组肝癌患者生存曲线
2.3 SMAE比较 43例患者均完成随访工作。平均随访(12.02±0.23)个月后,记录患者SMAE发生情况。43例肝癌患者共发生SMAE 10例,包括死亡1例,肝癌破裂出血1例,骨转移2例,胸水2例,复发4例;与未发生SMAE者(33例)相比,发生SMAE者(10例)血浆PEDF/VEGF比值明显降低(3.49±1.12 vs. 2.14±0.76),差异有统计学意义(P<0.01)。
3 讨 论
肝癌是一种多血质的实体肿瘤,其发生、发展和转归很大程度上依赖于新生血管形成。PEDF是目前最有效的天然血管抑制剂之一,具有强烈的血管生成抑制作用[7]。其作用机制包括:激活Fas/FasL系统诱导内皮细胞凋亡[8],抑制毛细管道形成,抑制内皮细胞迁移[9],抑制VEGF表达和修饰VEGFR1[10]。另外,PEDF和细胞外基质复合作用,抑制血管新生,诱导内皮细胞凋亡。有研究表明,低氧条件HCC细胞株分泌PEDF受抑制,而新生血管刺激因子——VEGF却明显增高[11]。VEGF是一种以亚基内及亚基间二硫键交联形成的同源双聚体糖蛋白,与其受体Flt-1和KDR特异性结合后,发挥多种功能,如促血管内皮细胞分裂增殖,增加血管通透性,调节内皮细胞凋亡的传导路径,对抗其凋亡过程等[12]。因此,生理情况下血浆中微量的PEDF与VEGF一般不参与新生血管形成,两者共同作用维持正常的血管密度和通透性。
本结果显示,与良性肝病患者及健康对照者比较,HCC患者血浆PEDF水平明显降低,VEGF含量显著升高,差异有统计学意义(P<0.05),表明肝癌发生时,促血管新生的VEGF与拮抗血管新生的PEDF平衡失调,致病理性新生血管大量产生,加剧肿瘤生长及转移。进一步研究发现,PEDF/VEGF比值越低者,其近期肝癌转移、复发等不良事件发生率越高。其机制可能为肿瘤迅速增长致间质压力增加,引起毛细血管受压闭合和连续性肿瘤坏死,缺氧负反馈调节机制抑制抗血管新生因子PEDF表达,而启动促血管生成因子VEGF大量表达,重建肿瘤的血供系统,为肿瘤生长、转移提供充足养分,进而形成了肿瘤生长转移和血管生成的恶性循环。
综上所述,血浆PEDF和VEGF在肝癌发生、生长和转移过程中起重要作用,两者可作为肝癌诊断和判断预后的新肿瘤标记物。此外,肿瘤新生血管是目前重组人PEDF或VEGF拮抗剂等多种抗血管新生药物的作用靶点,可能为肿瘤治疗提供更广阔的前景。
1 杨显富,龙先德.原发性肝癌复发转移的研究进展综述[J].河南外科学杂志,2012,18(2):80-83.
2 Zhao YJ,Ju Q,Li GC.Tumor markers for hepatocellular carcinoma[J]. Molecular and Clinical Oncology, 2013, 1(4): 593-598.
3 Wu XZ.New strategy of antiangiogenic therapy for hepatocellular carcinoma minireview[J]. Neoplasma, 2008, 55(6): 472-481.
4 Yamagishi SI,Matsui T,Kawaguchi T,et al.Pathophysiological role of pigment epithelium-derived factor (PEDF) in hepatic disorders[J]. Current Medicinal Chemistry, 2010, 17(19): 1995-2000.
5 Wang Q,Zhang Z,Ding T,et al.Mesenchymal stem cells over-expressing PEDF decreased the angiogenesis of gliomas[J].Biosci Rep,2012, 33(2): e00019.
6 杨秉辉,夏景林.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
7 Tombran-Tink J,Barnstable CJ.PEDF: a multifaceted neurotrophic factor[J]. Nature Reviews Neuroscience, 2003, 4(8): 628-636.
8 Mirochnik Y,Aurora A,Schulze-Hoepfner FT,et al.Short pigment epithelial-derived factor-derived peptide inhibits angiogenesis and tumor growth[J]. Clinical Cancer Research, 2009, 15(5): 1655-1663.
9 Konson A,Pradeep S,D'acunto CW,et al.Pigment epithelium-derived factor and its phosphomimetic mutant induce JNK-dependent apoptosis and p38-mediated migration arrest[J]. Journal of Biological Chemistry, 2011, 286(5): 3540-3551.
10 Tsuchiya T,Nakahama K,Asakawa Y,et al.The reduction in pigment epithelial-derived factor is a sign of malignancy in ovarian cancer expressing low-level of vascular endothelial growth factor[J]. Bynecol Endocrinol, 2009, 25(2):104-109.
11 Matsumoto K.Antiangiogenic property of pigment epithelium derived factor in hepatocellular carcinoma[J]. Hepatology, 2003, 38(4-1):402A-403A.12 Yamagishi S,Matsui T.Pigment epithelium-derived factor(PEDF)and cardiometabolic disorders[J].Curr Pharm Des,2013.Epub ahead of print.
Therelationshipbetweenplasmalevelsofpigmentepithelialderivedfactorandvascularendothelialgrowthfactorinthepatientswithhepatocellularcarcinomaandprognosis
ZHULili,YANGKai,LIUYa.
DepartmentofGeneralSurgery,BeijingHaidianHospital,Beijing100080,China
YANGKai,E-mail:zlilii@126.com
ObjectiveTo observe the expression of pigment epithelium derived factor (PEDF) and vascular endothelial growth factor (VEGF) in liver cancer patients, and to explore its relationship with the prognosis.MethodsELISA was used to detect 43 cases of patients with hepatocellular carcinoma (HCC group), 20 patients with benign liver disease (benign liver disease group) and 20 cases of healthy controls' (healthy control group) levels of plasma PEDF and VEGF levels, patients with hepatocellular carcinoma with average follow-up (12.02 ± 0.23) months, the main short recording adverse events (SMAE) occurrence were recorded.ResultsThe levels of plasma PEDF of liver cancer group decreased than in benign liver disease group and healthy control group (P<0.01), VEGF level increased significantly (P<0.01), and benign disease group and the healthy control group had no significant difference (P>0.05). At the end of the follow-up of patients with hepatocellular carcinoma, high ratio of PEDF/VEGF subgroup (22 cases, PEDF/VEGF≥3) SMAE occurred in 3 patients (13.64%), low PEDF/VEGF ratio subgroup (21 cases, PEDF/VEGF < 3) SMAE occurred in 7 patients (33.33%), Kaplan-Meier survival curve showed statistically significant differences between the 2 groups (P=0.039). In addition, compared with without the occurrence of SMAE in patients with hepatocellular carcinoma (33 cases), patients with occurrence of SMAE (10 cases) with lower PEDF/VEGF ratio (2.14 ± 0.76 vs. 3.49 ± 1.12,P<0.01).ConclusionPEDF and VEGF have role in the pathophysiology of hepatocellular carcinoma, low expression of PEDF and high expression of VEGF reflects the development and metastasis of HCC, the ratio between the two may be an effective index to predict the metastasis and prognosis of hepatocellular carcinoma.
Hepatocellular carcinoma;Pigment epithelium derived factor;Vascular endothelial growth factor;Prognosis;Correlation
100080 北京市海淀医院/北京大学第三医院海淀院区普外科
杨凯,E-mail:zlilii@126.com
10.3969/j.issn.1671-6450.2014.06.017
2014-03-12)

