乙基纤维素骨架缓释片处方工艺对水溶性药物释放的影响因素研究
王秀丽,党晓芳,廖 艳,赵保胜 (北京中医药大学,北京 100102)
骨架型缓释片是目前临床上使用较多的口服缓释制剂种类之一。按其所采用的骨架材料不同,可分为不溶性骨架缓释片、蜡质骨架缓释片、亲水凝胶骨架缓释片和混合材料骨架缓释片等。其中,不溶性骨架缓释片,是以不溶于水或水溶性极小的高分子聚合物、无毒塑料为骨架材料制成的片剂,其药物释放主要分为三步:消化液渗入骨架孔内、药物溶解和药物自骨架孔道释出。
乙基纤维素(EC)是纤维素链中的部分羟基被乙氧基取代的纤维素衍生物,是应用最广泛的水不溶性纤维素衍生物之一,可以应用于骨架缓释片的制备,但目前将其单独作为不溶性骨架缓释片的骨架而进行的研究和应用很少[1,2],多是在混合材料骨架缓释片中作为阻滞剂、包衣剂等得以应用。本实验以盐酸维拉帕米为模型药物,研究EC作为骨架缓释片的骨架时,其处方工艺对水溶性药物释放的影响因素。
1 试药与仪器
EC M70 (国药集团化学试剂有限公司);EC 7FP、100(上海卡乐康包衣技术有限公司);EC 100(泰安泰瑞纤维素有限公司);微晶纤维素101、硬脂酸镁、微粉硅胶(上海昌为医药辅料技术有限公司);盐酸维拉帕米(北京世纪博康医药科技有限公司)。
Sartorius电子天平BS124S型(北京赛多利斯仪器系统有限公司);DHG-9070A电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);信源ZP10型压片机(上海信源制药设备公司);HC-97片剂硬度检测仪(德国Kraemer-ELEKTRONIK公司);ZRS-8G智能释放实验仪(天大天发科技有限公司);WFZ UV-280H型紫外可见分光光度计(尤尼柯上海仪器有限公司)。
2 实验方法
2.1盐酸维拉帕米缓释片的释放度测定
2.1.1紫外分光光度法标准曲线制备 精密称取干燥至恒重的盐酸维拉帕米12.0 mg,置100 ml容量瓶中,加去离子水定容,制得储备液。精密吸取上述溶液1.0、2.0、3.0、4.0、5.0 ml,置10 ml容量瓶中,用去离子水稀释至刻度,分别取溶液约3 ml于比色皿中,在229 nm处测定吸光度(A)。以吸收度与对应的样品含量线性回归,得标准曲线方程:C=33.3A+0.008,r=0.999。
2.1.2释放度的测定 取缓释片,按2010版中国药典释放度测定法 (附录 XD 第一法),采用溶出度测定法(附录VC 第二法)的装置测定。释放介质(蒸馏水)900 ml,温度(37±0.5) ℃,转速50 r/min,在2、6、12 h分别取溶液5 ml(同时补加等量介质),精密量取释放液1 ml置于10 ml容量瓶中,加去离子水定容至刻度,经0.8 μm微孔滤膜过滤,取续滤液约3 ml于比色皿中,在229 nm处测定吸光度(A),根据标准曲线计算缓释片的累积释放度。
2.2EC处方工艺对药物释放的影响因素研究
2.2.1制备方法的影响 湿法制粒、压片(EC内加):分别按照处方用量精密称取盐酸维拉帕米以及各种辅料,将微粉硅胶、硬脂酸镁以外的原辅料,通过等量递增法在研钵中混合均匀。加入95%乙醇制备软材,20目筛制粒,颗粒于烘箱(60℃)烘干,18目筛整粒。整粒后加入助流剂微粉硅胶和润滑剂硬脂酸镁,混合均匀,压片,片剂硬度(7±1) kg。
部分湿法制粒、压片(EC外加):分别按照处方用量精密称取盐酸维拉帕米以及各种辅料,将EC、微粉硅胶、硬脂酸镁以外的原辅料,通过等量递增法在研钵中混合均匀。加入95%乙醇制备软材,20目筛制粒,颗粒于烘箱(60 ℃)烘干,18目筛整粒。整粒后加入EC、助流剂微粉硅胶和润滑剂硬脂酸镁,混合均匀,压片,片剂硬度(7±1) kg。
全粉末压片:分别按照处方用量精密称取盐酸维拉帕米以及各种辅料,通过等量递增法在研钵中混合均匀,压片,片剂硬度(12±1) kg。
2.2.2EC用量以及与主药比例的影响 分别按照湿法制粒、压片和部分湿法制粒、压片的方法,采用EC M70为骨架材料,制备缓释片。其中全粉末压片片剂硬度为(27±1)kg,湿法制粒压片硬度为(7±1) kg,测定累积释放度,考察缓释片EC用量以及与主药比例对药物释放的影响。
2.2.3全粉末压片制备方法中硬度的影响 按照全粉末压片的方法,分别制备硬度为12、18、24、27、30 kg的缓释片,考察片剂硬度对药物释放的影响。
2.2.4片剂比表面积的影响 按照“2.2.2”所用方法,选择直径φ9 mm和φ12 mm的圆型和胶囊型3种冲模,制成不同比表面积的缓释片,比表面积大小依次为胶囊型>φ9 mm圆型>φ12 mm圆型(比表面积=表面积/片重)。其中全粉末压片片剂硬度为(27±1) kg,湿法制粒压片片剂硬度为(7±1) kg,测定累积释放度,考察缓释片比表面积对药物释放的影响。
2.2.5全粉末压片制备方法中EC黏度的影响 按照全粉末压片法,选用两种不同黏度的 EC(100,70 M)作为骨架材料压片,片剂硬度为(27±1) kg,测定累积释放度,考察EC黏度对药物释放的影响。
2.2.6全粉末压片制备中EC粒径的影响 按照全粉末压片法,选用两种不同粒径黏度的EC(7FP,70 M)作为骨架材料,压片,片剂硬度为(27±1) kg,测定累积释放度,考察EC粒径对药物释放的影响。
2.2.7EC厂家因素的影响 按照全粉末压片法,选用黏度为100,分别由上海卡乐康包衣技术有限公司和泰安泰瑞纤维素有限公司生产的EC,作为骨架材料压片,片剂硬度为(13±1) kg,测定累积释放度,考察EC粒径对药物释放的影响。
3 结果与讨论
3.1制备方法的影响 因为EC溶解后黏度大,在湿法制粒时软材呈现非常黏腻的状态,易黏附到筛网上;且制备的颗粒干燥后硬度大,增加了制粒和整粒的困难,不仅影响药物释放,也影响片剂外观;制得缓释片的累积释放度不同批次之间的重现性和同一批次之间的平行性,均不好。考虑到完全湿法制粒软材黏度大的现象比较突出,故考察EC外加的方法。该法制备颗粒硬度和均匀度适中,片剂外观光滑,但颗粒与外加的EC之间容易出现分层、偏析。不同于湿法制粒压片需要经过称量、混合、制软材、制粒、干燥、整粒、总混、压片等烦琐过程,全粉末压片只需称量、混合、压片三道程序,工艺简单、操作方便、值得推广,而且EC为颗粒状水不溶性高分子辅料,不易粉碎,适合于全粉末压片,故本研究亦考察了全粉末压片的制备方法,同时也因为EC在湿法制粒时黏度过大影响平行性、均匀性、重现性,所以笔者在后续单因素试验中,更注重全粉末压片处方因素的考察。
实验结果显示,在相同处方时,EC外加的缓释效果优于EC内加,2、6、12 h累积释放度分别依次为33.2%、59.4%、85.9%和41.8%、73.1%、92.3%;而全粉末压片在较低压力时(硬度<10 kg)难以成型。片剂硬度12 kg时,投入释放仪后快速崩解、无骨架存在;当处方相同时,全粉末压片制得的缓释片的释药速度明显快于湿法制粒压片制得的缓释片,2 h时累积释放度分别为59.3%和41.8%,因为经过润湿剂润湿、黏合制粒后,对扩散孔道的形成有影响,使药物释放减慢。
对全粉末压片,物料必须满足流动性、均一性以及可压性的要求,即休止角≤40°、流速>3 ml/s,物料含量差异 RSD<3.5%,可压性好。所以必须考虑物料间的密度差或粒径差引起的物料混合的均匀性及物料相容性,以及高含量药物处方中药物的可压性、流动性、填充性等问题。如果这些要求能够满足,并可以在规定的范围内进行释放、储存,则重现性最理想、操作最方便的全粉末压片工艺是值得选择的。本研究试验结果表明,文中所选各型号的EC,除EC 100(泰安泰瑞)外,均有较好的可压性,流动性,以及与主药和其他辅料的相容性、填充性,尤以EC M70为佳,同时其控释效果也最为理想。
3.2EC用量以及与主药比例的影响[3]采用不同制备方法时,EC用量对释药速率均有显著影响,即随着EC用量的增加而释药速率减慢。全粉末压片制得的缓释片,当EC用量从75%(主药∶EC=1∶3)降至70%(主药∶EC=1∶2.8)时,2 h累积释放度从24%增加到30.6%,增加了6.6%,而当EC用量从70%(主药∶EC=1∶2.8)降至66.6%(主药∶EC=1∶2)时,2 h累积释放度从30.6%增加到46.4%,增加了15.8%;湿法制粒压片制得的缓释片,当EC用量从50%(主药∶EC=1∶1)降至45%时,2 h累积释放度从50%增加到82.7%,增加了32.7%,而当EC用量从45%(主药∶EC=1∶0.9)减少至30%(主药∶EC=1∶0.6)时,2 h累积释放度从82.7%增加到91.9%,只增加9.2%,说明主药与EC的比例也对释放具有显著的影响。
EC缓释骨架片在水溶性药物释放过程中将形成孔隙。载药量较低时,骨架的孔隙率也较低,导致药物被骨架EC包裹,药物释放不彻底;随着主药含量的增加,主药颗粒形成连续网络,主药异常扩散(即不同于常规的Ficks扩散或Higuchi扩散);当药物含量增大到超过乙基纤维素颗粒能在片剂中形成连续的骨架时,乙基纤维素在释放过程中将不能保持完整而破碎崩解。所以,主药和EC含量均直接影响主药释放速度。
3.3全粉末压片中硬度的影响[3]硬度对全粉末压片制备的盐酸维拉帕米缓释片的释放度有显著影响。当骨架片硬度为12、18、24 kg时,2 h累积释放度依次为99.0%、69.8%、46.5%,骨架无法有效控制水溶性药物盐酸维拉帕米的释放;当骨架片硬度达到27 kg和30 kg时,2、6、12 h的释放度分别为30.6%、60%、86.5%和28.9%、56.9%、84.7%,均符合2010版中国药典中规定的20%~45%、45%~70%和70%以上的要求,且硬度为27 kg时,在保证缓释效果的同时可以更好地释放药物,故在以后的研究中全粉末压片时片剂硬度选定在27 kg左右。当骨架片硬度达到27和30 kg时,药物释放曲线和药物在水中释放模型拟合方程分别见图1和表1。从表1中各拟合模型结果可知,各模型间释放度与时间均有较好的相关性,以具有最大r值为标准,EC为骨架的盐酸维拉帕米缓释片的最佳拟合模型为Higuchi模型。
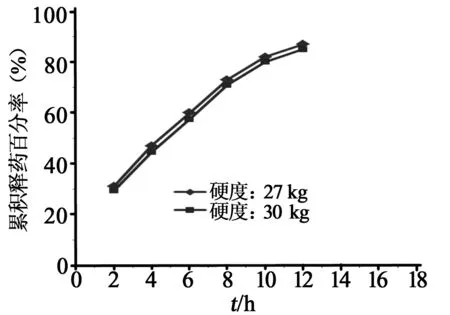
图1 不同硬度的盐酸维拉帕米缓释片体外释放曲线
表1不同硬度的盐酸维拉帕米缓释片在水中释放模型拟合方程

拟合模型硬度(kg)拟合方程r零级模型27Mt/M∞=0.06 1t+0.254 40.984 930Mt/M∞=0.062 5t+0.2270.988 4一级模型27ln(1-Mt/M∞)=-0.233t+0.207 40.990 930ln(1-Mt/M∞)=-0.226 7t+0.229 70.989 2Higuchi模型27Mt/M∞=0.304t1/2-0.094 80.997 530Mt/M∞=0.3104t1/2-0.127 90.997 4
压片力增大,片剂硬度增加,会导致骨架片密度、孔道弯曲率增大和孔隙率减小,从而减小释药速率,所以随着硬度的增加释放速度明显降低;随着压片力增加,孔隙率的可减小空间越来越低,以致当压片力增加到一定程度时,随着硬度的增加,主药释放速度的降低幅度减小。
EC作为不溶于水的缓释性载体,内部存在着错综复杂的孔道,药物就是经过这些极细的孔道缓慢向体液扩散释出。孔隙率是影响不溶性骨架片药物释放的一个十分重要的因素,由压片形成的初始孔隙率和药物释放后产生的释放孔隙率两部分组成。压片的压力直接影响初始孔隙率,主药的溶解度和含量则影响释放孔隙率,而制备方法对初始孔隙率和释放孔隙率均有影响。笔者在研究了制备方法、药物和EC含量对释放度的影响后,进一步研究了压力对药物释放的影响。
在处方固定的条件下,压片力(片剂硬度)是影响全粉末压片法制备的不溶性骨架片药物释放速度的重要因素之一。当压片力过小时,初始孔隙率过大,可溶性药物迅速释放后,随着释放孔隙率的增加,导致骨架在释放过程中散开;相反,当压片力大于此范围时,初始孔隙率太小,药物释放过慢呈异常扩散机制。因此,压片力应选在适合的范围内,当然,这与药物的溶解度、直径、粒度范围和密度等因素有关。
3.4片剂比表面积的影响 全粉末压片和湿法制粒压片两种制备方法所制得的片剂,其释药速度均随着比表面积的增大而增大。全粉末压片制得胶囊型、φ9 mm圆型、φ12 mm圆型缓释片,2 h累积释放度依次为64.8%、59.3%、54.1%,湿法制粒压片制得胶囊型、φ9 mm圆型、φ12 mm圆型缓释片2 h累积释放度依次为40.2%、41.8%、36%。因为骨架缓释片的药物释放主要分为三步:消化液渗入骨架孔内、药物溶解和药物自骨架孔道释出。随着比表面积增加,消化液渗入骨架孔内和药物自骨架孔道释出的面积增大,路径缩短,有助于药物的释放。
3.5全粉末压片对EC黏度的影响 EC黏度的差异对缓释片的释放速度有显著影响。在处方及工艺相同的情况下,2、6、12 h的累积释放度,EC 70M缓释片依次为24%、51.6%、76.1%;EC 100(上海卡乐康)缓释片依次为36.4%、74.5%、82.7%。释放曲线见图2,药物在水中释放模型拟合方程见表2,以具有最大的r值为标准,EC70M为骨架的盐酸维拉帕米缓释片的最佳拟合模型为Higuchi模型,EC100为骨架的盐酸维拉帕米缓释片的最佳拟合模型为一级模型。
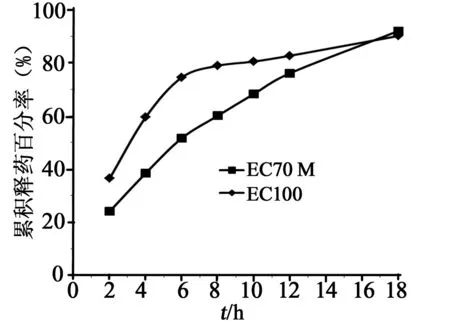
图2 不同黏度EC制备的盐酸维拉帕米缓释片体外释放曲线。
3.6全粉末压片中EC粒径的影响 EC粒径不仅对全粉末流动性引起的差异明显,而且对药物的累积释放度亦有显著影响,且粒径越大,释药速率越快。药物释放曲线见图3,处方及工艺相同的情况下,EC7FP缓释片2、6、12 h累积释放度依次为14.6%、33.2%、52.3%;EC70M缓释片2、6、12 h 累积释放度依次为24%、51.6%、76.1%。而且EC粒径对药物后期释放的影响比对前期释放影响大。药物释放速率随EC粒径的减小而变慢,因为较小颗粒更有利于片剂骨架的形成。
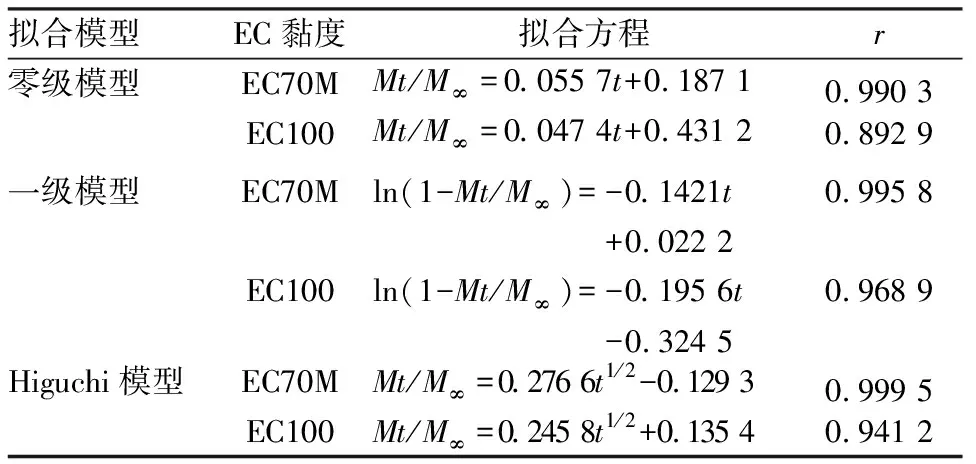
表2 不同黏度EC制备的盐酸维拉帕米缓释片在水中释放模型拟合方程
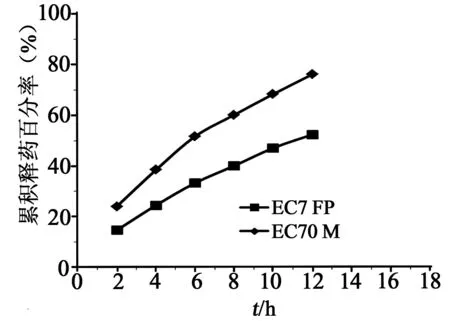
图3 不同粒径EC制备的盐酸维拉帕米缓释片体外释放曲线
3.7EC厂家因素的影响 由不同厂家生产的相同型号的EC,对药物的累积释放度的影响差别显著。体外释放曲线见图4,2、6、12 h的累积释放度如下:EC 100(上海卡乐康)缓释片分别为42.3%、64.8%、95.1%,EC 100(泰安泰瑞)缓释片分别为33.3%、58.9%、80.8%;同时两者的流动性和可压性也区别明显,EC 100(泰安泰瑞)缓释片硬度无法达到27 kg。不同厂家生产的EC为骨架的盐酸维拉帕米缓释片在水中释放模型拟合方程见表3,以具有最大的r值为标准,两者的最佳拟合模型均为一级模型。
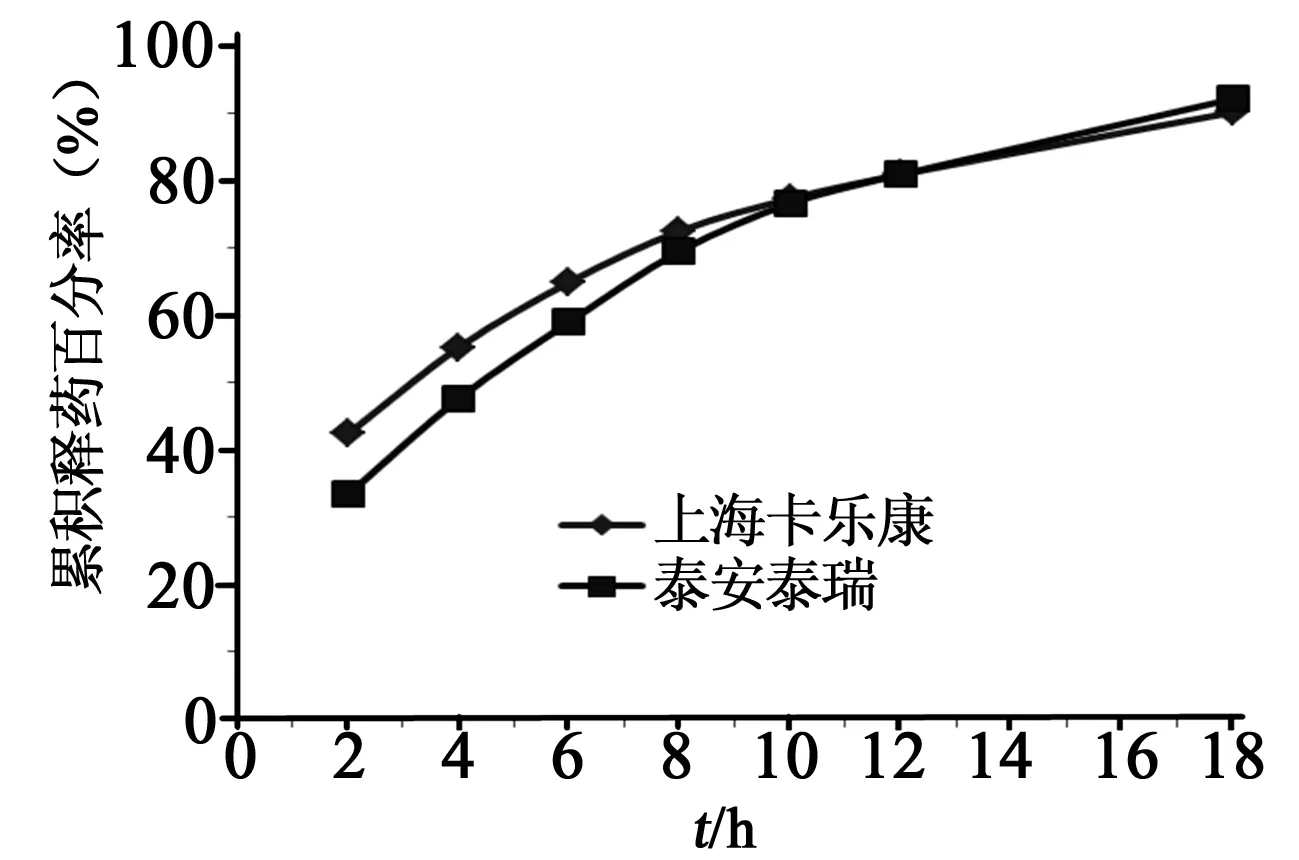
图4 不同厂家EC制备的盐酸维拉帕米缓释片体外释放曲线
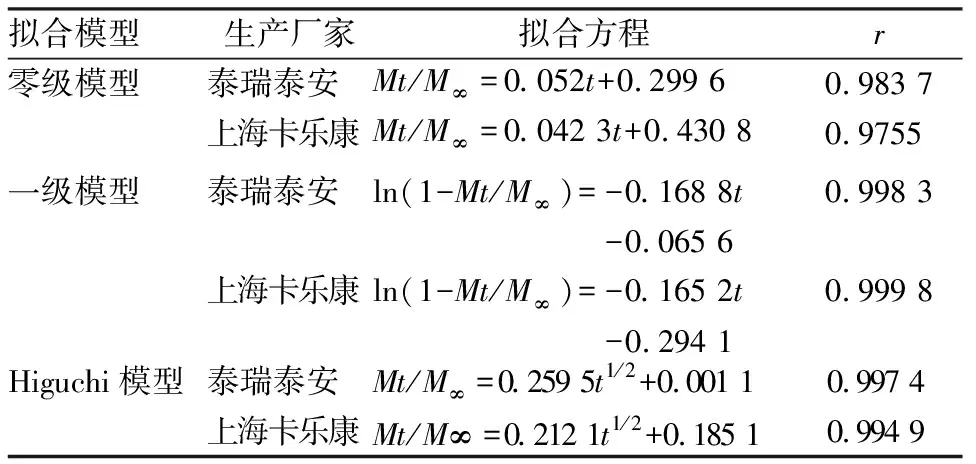
表3 不同厂家EC制备的盐酸维拉帕米缓释片在水中释放模型拟合方程
3.8湿法制粒压片中润湿剂用量的影响 制粒过程控制是湿法制粒压片的关键,以润湿剂种类(浓度)、润湿剂加入方式、润湿剂用量、制粒时间(终点判断)、含水量控制等因素为制粒过程控制的关键点。在湿法制粒制备工艺中,粘合剂用量和搅浆速度对中、高压力范围的片剂抗张强度起正作用;原料粒度对中高压力范围压制片剂的抗张强度起负作用;粘合剂浓度及加入速度则对低压片力范围压制片剂的抗张强度起负作用,高压片力范围则起正作用[3]。但是,本文中选用的骨架EC,因为润湿后黏度大而不利于制粒,所以本文以全粉末压片为研究重点,没有进行润湿剂种类(浓度)的筛选,直接选用了黏度较小的95%乙醇;因为本文的研究均为小样品量操作(每个试验处方为20片量),润湿剂加入方式、制粒时间(终点判断)的研究误差会比较大,所以没有进行。
3.9其他 当处方中只有主药和EC以及微粉硅胶、硬脂酸镁时,可压性并不理想,加入微晶纤维素后,可压性会明显好转,同时,微晶纤维素对药物的累积释放度也有一定的促进作用。
4 总结
EC无毒,一般不溶于水,热稳定性好,燃烧时灰份极低,很少有黏着感或发涩;有极强的抗生物性能、代谢惰性,防老化性能好,对化学品稳定,长期储存不变质;有优良的耐吸湿性、耐碱性、耐弱酸性、耐盐、耐低温。这些优点体现了EC作为缓释片骨架的优势;同时,作为流动性粉末,EC在操作简便的全粉末压片制备方法中有很好的推广价值。但EC在阳光下或紫外光下易发生氧化降解,在强碱性环境和受热条件下易变色,所以EC骨架缓释片的制备、运输和储存过程中,应加强保护措施。
本文从处方工艺、尤其是处方的角度,研究了EC作为骨架缓释片时对水溶性模型药物盐酸维拉帕米释放的影响,为EC作为水溶性药物的缓释片骨架的药物研发进行了初步摸索。
【参考文献】
[1] Pather S.I, Russell I, Syce JA,etal. Sustained release theophylline tablets by direct compression part 1: formulation and in vitro testing[J]. Int J Pharm, 1998, 164:1.
[2] 吕竹芬, 谭载友, 张 蜀, 等. 美沙拉嗪缓释片的处方筛选及体外释放度研究[J].中国现代应用药学杂志, 2000, 17(6):461.
[3] 王 晋, 张汝华. 用渗滤理论研究乙基纤维素骨架片的最适压片力范围[J].药学学报, 2000, 35(7):531.
[4] 王 晋, 张汝华, 马晓光, 等. 高速搅拌制粒工艺与片剂抗张强度的关系[J].中国医药工业杂志, 1999, 30(9):391.

