亚硫酸氢盐在SPORL法预处理稻草中的作用
李 洲 王高升,* 王 霞 肖 林 夏蕊蕊
(1.天津科技大学天津市制浆造纸重点实验室,天津,300457;2. 山东龙力生物科技股份有限公司,山东省秸秆生物炼制技术重点实验室,山东德州,251200)
面对日益严重的能源危机,利用来源丰富、廉价且可再生的植物纤维原料生产燃料乙醇是一条解决能源问题的有效途径[1]。植物纤维原料主要由纤维素、半纤维素和木素等组成,利用纤维素水解得到的葡萄糖发酵生产乙醇是目前制备纤维素乙醇的主流技术。由于木素和半纤维素对纤维素的包裹以及纤维素本身的复杂结构,对植物纤维直接进行酶水解时,其水解程度很低,一般只有10%~20%。只有经过有效预处理,破坏植物纤维的复杂结构,增加纤维素酶对纤维素的可及度,才能使植物纤维原料被充分利用。因此,预处理是利用植物纤维原料生产燃料乙醇的关键技术。研究开发高效、低成本的预处理技术是植物纤维原料生产燃料乙醇的主要方向之一。目前,开发了许多预处理技术,并取得了一些成果。这些预处理技术可分为物理法、化学法、物理化学法和生物法,基本原理都是去除木素和半纤维素,破坏原料的物理结构,降低纤维素结晶度和聚合度。研究较多的方法有蒸汽爆破法(Steam Explosion)[2]、 稀酸法(Dilute Acid)[3]、 有机溶剂法(Organosolv)[4]、 氨气爆破法(AFEX)[5]、 碱法(Alkaline)[6]、 热水法(Hot Water)[7-8]、 替代溶剂预处理(Alternative Solvents Pretreatment)[9-11]、 生物预处理(Fungal Pretreatment)[12]等。这些方法都存在各自的缺点,主要有以下几个方面:①氨气爆破法、稀酸法、热水法对原料的适应性差,通常对木素含量低的农业废弃物有效,但对木素含量高的针叶木效果不理想;②稀酸法、蒸汽爆破法会产生发酵抑制物,如糠醛含量高;③石灰法和真菌预处理的处理时间长;④蒸汽爆破法大规模生产时存在障碍,如缺少适合大规模生产的设备;⑤替代溶剂预处理的原材料价格高;⑥稀酸法的反应器需要特种耐腐蚀金属材料;⑦经热水法、氨气爆破法预处理后,半纤维素水解为寡糖,需要利用酶或酸将寡糖进一步水解成单糖。
SPORL(Sulfite Pretreatment to Overcome Recalcitrance of Lignocellulose)法预处理是近年来开发出的一种预处理方法,主要利用酸性亚硫酸氢盐对植物纤维原料进行预处理,以克服植物纤维原料对酶的抗性。目前的研究表明,SPORL法对于多种生物质原料(如云杉、红松、桉木、杨木、麦草、棉秆和玉米秸秆等)有很好的适应性,提高了纤维素酶水解效率[13-19]。
我国是世界第一秸秆大国,我国秸秆总产量占全球秸秆总产量的17.3%,每年可收集到的纤维秸秆资源量为3.0亿~3.3亿t,其中约1.0亿t为稻草[20]。近年来,由于秸秆产量的增加,农村产业结构和能源结构的改变,各类替代物品的应用,以及秸秆分布零散、体积大、收集运输成本高、综合利用经济性差和产业化程度低等原因,秸秆出现了地区性、季节性和结构性过剩,大量秸秆资源浪费严重。目前,我国的稻草、玉米秸秆和麦草都有不同程度的过剩问题,尤其是稻草过剩最多。稻草是我国主要农作物秸秆,年产量占全国秸秆总产量的25%,主要分布于我国南方地区和东北地区。由于稻草硅含量较高,导致其在造纸工业中的应用较少。本实验采用SPORL法预处理稻草,考察亚硫酸氢盐用量对稻草酶水解效果的影响,为进一步研究SPORL法预处理机理和充分利用稻草资源打下基础。
1 实 验
1.1材料
实验所用稻草产自江苏省常州市,使用时先将稻草切成2~3 cm的草段,过筛以去除杂质。纤维素酶由青岛蔚蓝生物股份有限公司提供,滤纸酶活为165.2 U/g。实验所用盐酸四环素、亚硫酸氢钠、间苯三酚、冰醋酸、浓硫酸、盐酸等均为分析纯。
1.2实验方法
1.2.1SPORL法预处理
称取100 g绝干稻草并与预处理药液混合均匀后置于1 L反应罐内,密封并装入电热蒸煮锅(ZQS1电热蒸煮锅,陕西科技大学机械厂)内,每次实验可以同时装载4个1 L反应罐。在预定温度、时间、固液比等条件下进行SPORL法预处理。预处理完毕,分离固相与液相,液相离心后用pH计测定pH值,并收集到试剂瓶中用于后续分析;固相(预处理稻草)经疏解分散、洗净并甩干后,贮于密封袋中,在4℃下冷藏储存备用。
1.2.2预处理稻草酶水解
称取2 g绝干预处理稻草并置于100 mL三角瓶中,加入50 mL HAc-NaAc缓冲液(pH值4.8、浓度0.1 mol/L),纤维素酶用量为7.5 U/g(对绝干预处理稻草),同时加入0.4 mL质量浓度为10 g/L的盐酸四环素溶液,补加蒸馏水至100 mL。酶水解温度50℃、摇床转速200 r/min,在酶水解72 h时取400 μL水解液于离心管中,煮沸使纤维素酶失活,然后用微量高速离心机在10000 r/min的转速下离心10 min,取上清液测定葡萄糖浓度。
1.2.3测定方法
按照GB/T2677.2—2011、GB/T2677.8—1994、GB/T10337—2008、GB/T742—2008分别测定水分、酸不溶木素含量、酸溶木素含量及灰分;采用山东省科学院生物研究所生产的SBA-40D型生物传感分析仪测定葡萄糖含量;聚戊糖含量的测定见文献[21];预处理前后稻草纤维素与聚戊糖含量的测定见文献[22]。
1.2.4相关计算
某成分的保留率是指预处理后原料中某成分(如纤维素、木素、半纤维素等)的保留量对预处理前原料中该成分含量的百分比;酶水解转化率指预处理后原料经过酶水解后得到的葡萄糖对预处理后原料中葡聚糖的百分比;葡萄糖得率是指预处理后原料经酶水解后得到的葡萄糖与原料中葡聚糖的百分比。计算公式如下:
式中,W、W1、W2、W3分别表示预处理原料得率、成分保留率、酶水解转化率、葡萄糖得率;X、X1分别表示预处理前后原料成分含量;C表示酶水解液葡萄糖浓度;m、m1分别表示预处理前后原料葡萄糖含量;0.1表示水解液体积为0.1 L;0.9表示葡萄糖和葡聚糖的换算系数;2表示所取预处理原料绝干质量为2 g。
2 结果与讨论
实验所用稻草的主要化学成分如表1所示。与玉米秸秆、麦草等农业废弃物相比,稻草的纤维素和木素含量低,而灰分高。不同的化学成分含量会对预处理效果产生影响。本实验在预处理温度、时间和固液比一定的条件下重点研究了亚硫酸氢盐用量对稻草主要化学成分的去除和酶水解效率的影响。

表1 稻草主要化学成分 %
注 纤维素含量通过葡聚糖含量反映。
2.1对预处理过程中亚硫酸氢盐用量的探讨
2.1.1亚硫酸氢盐用量对稻草预处理得率的影响
在固液比1∶4、温度170℃、保温时间30 min、硫酸用量1.84%条件下对稻草进行预处理,研究亚硫酸氢钠用量对稻草预处理得率的影响,结果如图1所示。从图1可以看出,随亚硫酸氢钠用量的增加,稻草预处理得率呈先下降后上升趋势;在亚硫酸氢钠用量为1.5%~4.5% 范围内,稻草预处理得率由39.6%降到37.3%;当亚硫酸氢钠用量继续增加至12.0%时,稻草预处理得率为42.5%,比最低点增加了5.2个百分点。由于稻草主要由纤维素、半纤维素、木素等成分构成,它们在预处理过程中的溶出将直接影响预处理得率的变化规律。下面将结合稻草预处理后化学成分的变化对这种现象加以解释。
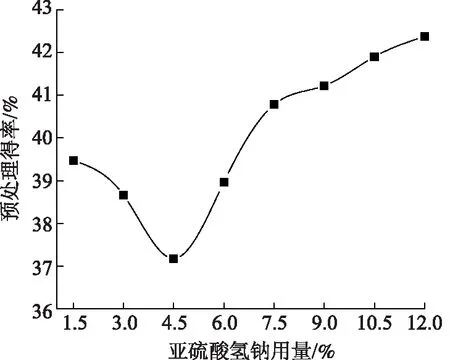
图1 亚硫酸氢钠用量对稻草预处理得率的影响

图2 亚硫酸氢钠用量对预处理稻草化学成分的影响
2.1.2亚硫酸氢盐用量对预处理稻草化学成分的影响
亚硫酸氢钠用量对预处理稻草化学成分的影响如图2所示。由图2(a)可以看出,随亚硫酸氢钠用量的增加,预处理稻草纤维素含量逐渐增加;当亚硫酸氢钠用量大于7.5%时,预处理稻草纤维素含量保持稳定。当亚硫酸氢钠用量小于4.5%时,纤维素保留率基本没有变化;但当亚硫酸氢钠用量由4.5%增至7.5%时,纤维素保留率快速上升;继续增加亚硫酸氢钠用量,纤维素保留率基本稳定。在亚硫酸氢钠用量7.5%条件下,预处理稻草纤维素含量和纤维素保留率均达到一个较高值,此时,纤维素保留率达到80%以上。继续增加亚硫酸氢钠用量至12.0%,预处理稻草纤维素含量和纤维素保留率变化缓慢。这表明存在一个合适的亚硫酸氢钠用量,该用量有助于纤维素在酸性条件下的保留,避免纤维素发生酸催化水解。SHI Yan[23]研究认为,亚硫酸氢钠在酸性条件下会与六碳糖醛基形成加合物,从而阻止六碳糖进一步降解。至于亚硫酸氢钠在酸性条件下如何阻止纤维素进一步发生水解反应,有待进一步研究。
由图2(b)可以看出,当亚硫酸氢钠用量小于3.0%时,预处理稻草聚戊糖的含量和保留率降低幅度较大,此后,随亚硫酸氢钠用量的增加,聚戊糖的含量和保留率基本保持稳定,聚戊糖的保留率约为17%。这可能是因为本实验是在高温酸性条件下进行的,绝大部分容易水解的半纤维素已被溶出,亚硫酸氢钠对残存的较难水解的半纤维素去除作用不明显。
由图2(c)可以看出,随亚硫酸氢钠用量的增加,预处理稻草木素的含量和保留率均逐渐下降。当亚硫酸氢钠用量为12.0%时,几乎一半的木素被脱除。这说明亚硫酸氢钠有助于木素脱除,主要原因是木素和亚硫酸氢根离子发生磺化反应并生成亲水性的木素磺酸盐而溶出[24]。亚硫酸氢钠用量的增加使体系中亚硫酸氢根离子增多,为木素磺化反应提供了有利条件,促进了木素溶出。因此,预处理稻草木素的含量和保留率随亚硫酸氢钠用量的增加而呈明显下降的趋势。
从图2(d)可以看出,随亚硫酸氢钠用量的增加,预处理稻草灰分及灰分保留率均呈先下降后上升最终趋于稳定的趋势。当亚硫酸氢钠用量为3.0%时,预处理稻草灰分及灰分保留率最低。继续增加亚硫酸氢钠用量,预处理稻草灰分及灰分保留率增大;但当亚硫酸氢钠用量大于7.5%时,预处理稻草灰分保留率保持稳定,此时约57%的灰分溶出。
考察了稻草预处理过程中各成分的变化规律后,就可以较好地解释预处理得率所呈现的变化规律。在亚硫酸氢钠用量为1.5%~4.5%范围内,聚戊糖、木素和灰分的溶出增多,而纤维素基本没有变化,使得预处理得率呈下降趋势。在亚硫酸氢钠用量为4.5%~7.5%范围内,半纤维素溶出基本保持不变,纤维素和灰分保留率增大,木素的溶出率有较大幅度上升。由于木素在原料中含量较少(仅为14.69%),纤维素是原料的最主要成分(含量31.73%),所以木素的溶出对预处理得率的变化不起主要作用,对预处理得率变化起主要作用的是纤维素,导致预处理得率随纤维素保留率的增大而增大。当亚硫酸氢钠用量大于7.5%时,聚戊糖溶出基本不变,纤维素和灰分保留率呈缓慢上升的趋势,虽然木素继续溶出,但其对得率影响不大,因此,最终的结果是预处理得率呈缓慢上升的趋势。
2.1.3亚硫酸氢盐用量对稻草酶水解效果的影响
亚硫酸氢钠用量对稻草酶水解效果的影响如图3所示。从图3可知,随亚硫酸氢钠用量的增加,酶水解转化率和葡萄糖得率逐渐上升。当亚硫酸氢钠用量为10.5%时,酶水解转化率与葡萄糖得率均达到最大值。继续增加亚硫酸氢钠用量,酶水解转化率与葡萄糖得率略有下降。增加亚硫酸氢钠用量能够促进木素脱除和半纤维素水解,从而使得纤维素酶能够与纤维素更好地接触,促进预处理稻草酶水解。由于亚硫酸氢钠用量的增加有助于预处理稻草纤维素保留率的提高,使得当亚硫酸氢钠用量大于7.5%时,葡萄糖得率大幅提高。本实验酶水解转化率和葡萄糖得率均不够高,这主要与所采用的纤维素酶的用量和来源有关。
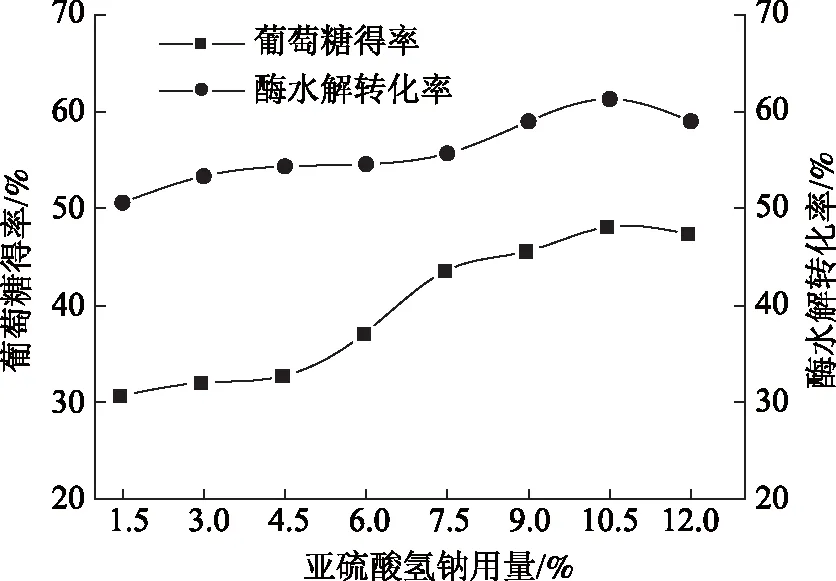
图3 亚硫酸氢钠用量对预处理稻草酶水解转化率和葡萄糖得率的影响
2.2预处理稻草各主要成分保留率与酶水解转化率的相关性
预处理过程中木素、聚戊糖及纤维素保留率与预处理稻草酶水解转化率的相关性如图4~图6所示。预处理稻草酶水解转化率随木素保留率的减小而增大,两者呈较好的负相关线性关系,相关系数为0.9176(见图4);聚戊糖保留率与预处理稻草酶解转化率大体呈负相关关系,两者之间相关性低,相关系数只有0.4633(见图5)。这主要是因为亚硫酸氢盐能够促进木素的大量溶出,随木素溶出量的增加,预处理稻草的结构变得疏松多孔,加大了纤维素酶对纤维素的可及性,从而提高预处理稻草的酶水解转化率。半纤维素溶出一般分为2个阶段:一是快速溶出段,二是慢速溶出段。在本实验特定条件(pH值<3.2)下,半纤维素溶出率达到了79%~84%,残余半纤维素的溶出处于慢速溶出段,虽然该过程能够使预处理稻草结构更加疏松多孔,但对纤维素酶与纤维素的接触没有特别明显的促进作用。纤维素保留率与预处理稻草酶水解转化率呈正相关关系,两者的相关系数(见图6)低于木素的,但高于半纤维素的,这说明在预处理过程中减少纤维素的降解对酶水解转化率有益。由此可知,酸性亚硫酸氢盐预处理稻草提高酶水解转化率的主要原因是通过亚硫酸氢盐对木素的磺化作用,导致更多木素溶出,使预处理稻草结构更加疏松多孔,增大纤维素酶与纤维素的可及性,从而提高葡萄糖得率。而稀酸法预处理是通过溶解生物质成分中的半纤维素来增大纤维素酶的可及性,从而提高酶水解转化率[25]。这是2种预处理方法的不同之处。

图4 预处理稻草木素保留率与酶水解转化率的相关性
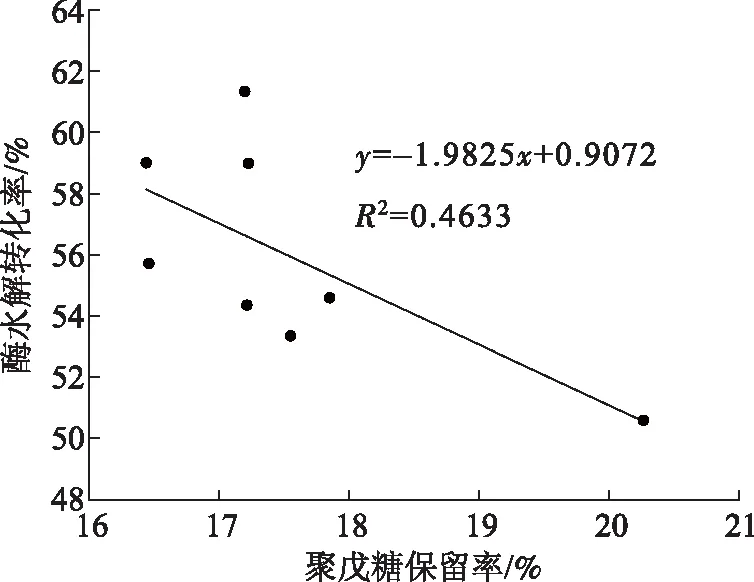
图5 预处理稻草聚戊糖保留率与酶水解转化率的相关性

图6 预处理稻草纤维素保留率与酶水解转化率的相关性
3 结 论
3.1在SPORL法预处理稻草过程中,亚硫酸氢盐能促进稻草木素的脱除和半纤维素的水解溶出,但却有利于预处理稻草纤维素的保留;其对稻草灰分也有一定影响。
3.2在SPORL法预处理稻草过程中,增加亚硫酸氢盐用量,预处理稻草酶水解转化率和葡萄糖得率提高。预处理稻草的木素、半纤维素和纤维素的含量对酶水解转化率均有影响:木素保留率与预处理稻草酶水解转化率呈较好的负相关线性关系;半纤维素溶出对预处理稻草酶水解转化率也有促进作用,但相关性较差。预处理稻草主要成分的保留率与酶水解转化率的相关性从大到小顺序为:木素>纤维素>半纤维素。
3.3SPORL法预处理是一种不同于稀酸法的预处理方法,两者的不同之处在于亚硫酸氢盐对木素的磺化作用,导致更多的木素溶出,使预处理稻草更加疏松多孔,增大纤维素酶对纤维素的可及性,从而提高葡萄糖得率。
参 考 文 献
[1] SUN Ye, Cheng Jiayang. Hydrolysis of lignocellulosic materials for ethanol production: A review[J]. Bioresource Technology, 2002, 83(1): 1.
[2] Horn S J, Eijsink V G H. Enzymatic Hydrolysis of Steam-exploded Hardwood Using Short Processing Times[J]. Biosci Biotechnol Biochem, 2010, 74(6): 1157.
[3] Mosier N, Wyman C, Dale B,et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology, 2005, 96(6): 673.
[4] Pan X J, Gilkes N, Kadla J, et al. Bioconversion of hybrid poplar to ethanol and co-products using an organosolv fractionation process: Optimization of process yields[J]. Biotechnology and Bioengineering, 2006, 94: 851.
[5] Dale B E, Leong C K, Pham T K, et al. Hydrolysis of lignocellulosics at low enzyme levels: Application of the AFEX process[J]. Bioresource Technology, 1996, 56(1): 111.
[6] Chang V S, Burr B, Holtzapple M T. Lime pretreatment of switchgrass[J]. Appl Biochem Biotech, 1997, 63(5): 3.
[7] Liu C G, Wyman C E. Partial flow of compressed-hot water through corn stover to enhance hemicellulose sugar recovery and enzymatic digestibility of cellulose[J]. Bioresource Technology, 2005, 96(18): 1978.
[8] Allen S G, Kam L C, Zemann A J, et al. Fractionation of sugar cane with hot, compressed, liquid water[J]. Ind Eng Chem Res, 1996, 35(8): 2709.
[9] Kuo C H, Lee C K. Enhanced enzymatic hydrolysis of sugarcane bagasse byN-methylmorpholine-N-oxide pretreatment[J]. Bioresource Technology, 2009, 100(2): 866.
[10] Kuo C H, Lee C K. Enhancement of enzymatic saccharification of cellulose by cellulose dissolution pretreatments[J]. Carbohyd Polym, 2009, 77(1): 41.
[11] Zhang Y H P, Ding S Y, Mielenz J R, et al. Fractionating recalcitrant lignocellulose at modest reaction conditions[J]. Biotechnol Bioeng, 2007, 97(2): 214.
[12] Keller F A, Hamilton J E, Nguyen Q A. Microbial pretreatment of biomass-Potential for reducing severity of thermochemical biomass pretreatment[J]. Appl Biochem Biotech, 2003, 105: 27.
[13] Wang G S, Pan X J, Zhu J Y, et al. Sulfite pretreatment for biorefining biomass: US, 0298149[P]. 2009.
[14] Wang G S, Zhu J Y, Pan X J, et al. Sulfite Pretreatment to Overcome Recalcitrance of Lignocellulose (SPORL) for Robust Enzymatic Saccharification of Hardwoods[J]. Biotechnology Progress, 2009, 25(4): 1086.
[15] Zhu J Y, Pan X J, Wang G S, et al. Sulfite Pretreatment (SPORL) for Robust Enzymatic Saccharification of Spruce and Red Pine[J]. Bioresource Technology, 2009, 100(8): 2411.
[16] Zhu J Y, Pan X J. Woody Biomass Pretreatment for Cellulosic Ethanol Production: Technology and Energy Consumption Evaluation[J]. Bioresource Technology, 2010, 101: 4992.
[17] 刘云云, 王高升, 普春刚, 等. 亚硫酸氢盐预处理对玉米秸秆酶水解的影响[J]. 林产化学与工业, 2010, 30(4): 73.
[18] 杨甲一, 王高升, 许 杰. 亚硫酸盐预处理对麦草组分分离和糖化的影响[J]. 中华纸业, 2010, 31(14): 15.
[19] 齐临冬, 王高升, 于梦辉, 等. 亚硫酸盐预处理对棉秆酶水解的影响[J]. 农业工程学报, 2011, 27(9): 276.
[20] 李忠正. 我国造纸用农业秸秆资源现状[J]. 中国造纸, 2014, 33(3): 56.
[21] 于建仁, 张 曾, 迟聪聪. 桉木半纤维素预提取液中戊聚糖快速测定方法[J]. 中国造纸, 2007, 26(11): 10.
[22] 石淑兰, 何福望. 制浆造纸分析与检测[M]. 北京: 中国轻工业出版社, 2001.
[23] SHI Yan. Existence of the sugar-bisulfite adducts and its inhibiting effect on degradation of monosaccharide in acid system[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1612.
[24] 詹怀宇. 制浆原理与工程[M]. 北京: 中国轻工业出版社, 2001.
[25] 吉 喆, 凌 喆, 张 逊, 等. 预处理对木质纤维素生物质细胞壁超微结构的影响[J]. 生物工程学报, 2014, 30(5): 707.

