剑湖大型底栖动物群落结构及多样性
宁鹏飞 丁煌英 张 庆 李明会
(西南林业大学林学院,云南省森林灾害预警与控制重点实验室,云南昆明650224)
剑湖湿地自然保护区是云南省西部保存较好的高原湖泊湿地之一,由于其特殊的生态功能及兼有水体和陆地双重特征,成为许多珍稀濒危物种的栖息繁衍地,也为当地人民的生存提供了丰富的资源[1]。有关剑湖大型底栖生物的生态学研究在我国尚未见报道,本次对剑湖大型底栖动物进行采集、鉴定和统计分析,旨在探索剑湖大型底栖动物群落结构的时空动态变化规律,分析大型底栖动物的多样性,为剑湖大型底栖动物的研究提供重要的参考价值,并为发展剑湖渔业生产提供一定的理论依据。
1 材料与方法
1.1 研究区域与采样点设置
剑湖位于云南西部大理州剑川县境内,海拔2 186 m,形如“元宝状”。湖盆南北长3.35 km,东西最宽处3.25 km,平均水深2.7 m,最大水深6.0 m[2]。
在剑湖的3个入湖口(金龙河、格美江、永丰河)、1个出湖口(海尾河)、沿岸区等设置11个采样点(图1),以较全面地记录剑湖大型底栖动物资源。调查在2011年1、4、6、10月进行,按季度采样。

1.2 样品采集与处理
用面积为1/16 m2的彼得森采泥器,每个采样点采集2次。采集到的样品用40目(0.35 mm孔径)的分样筛去除泥砂,在解剖盘中逐一将大型底栖动物挑出,软体动物和水生昆虫等用75%乙醇固定,寡毛类用10%福尔马林固定,然后带回实验室计数和称量。用电子天平称湿质量,精确到0.001 g,所得数据换算成密度(个/m2)和生物量(g/m2)。参照国内外相关工具书《中国动物图谱-环节动物》、《中国动物图谱-软体动物》(第一册)、《中国动物图谱-软体动物》(第四册)、《中国经济动物志》、《淡水生物学》(上册 分类学部分)等[3-10]对标本进行鉴定。定量采集过程中,记录各采样点的环境特征,如水温、水深、水草分布和透明度等。
1.3 数据处理
采用Excel 2003建立数据库并进行相关指数计算,后运用SPSS 18.0统计软件进行数据分析。
采用 Shannon-Wiener指数:H′=-Σ pilnpi[11];Margalef丰富度指数:d=(S-1)/lnN[12];Simpson生物指数:D=1-Σ p2i[13];Pielou 均匀度指数:J=H′/lnS[14],进行群落组成的多样性分析。
式中:S为物种丰度;pi为第i种个体数占样本总个体数N的比例,即pi=ni/N。
采用S=2c/(a+b)[15]比较剑湖各采样点的大型底栖动物群落相似性。式中:c为2个比较采样点共同出现的种类数;a为2个比较采样点中第1个点出现的种类数;b为第2个点出现的种类数。相似性系数S值在0~0.25为极不相似,在0.25~0.50为中等不相似,在0.50~0.75为中等相似,在0.75~1.00为极为相似。
2 结果与分析
2.1 种类组成及时空变化
调查期间,剑湖11个采样点共鉴定出大型底栖动物52种,其中:软体动物和水生昆虫各19种,各占总数的36.54%;环节动物12种,占23.08%;甲壳动物2种,占3.85%。
2.2 大型底栖动物现存量的时空变化
2.2.1 现存量的季节变化 剑湖11个采样点大型底栖动物的周年平均密度为5418.01个/m2,周年平均生物量为286.36g/m2。各季度大型底栖动物密度表现为冬季(7008.00个/m2)>春季(6110.55个/m2)>夏季(5191.27个/m2)>秋季(3365.82个/m2);各季度生物量表现为夏季(452.56 g/m2)>春季(319.02 g/m2)>秋季(257.26 g/m2)>冬季(116.60 g/m2)。
从全年密度组成上看,各季节密度主要由软体动物和环节动物组成,软体动物密度夏季最高,秋季和春季次之,冬季最低;环节动物密度冬季最高,春季和秋季次之,夏季最低;水生昆虫密度冬季最高,夏、秋季相差较小,春季最低;甲壳动物密度春季最高,夏、秋季相差很小,冬季最低(图2)。
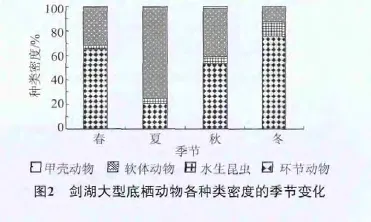
从全年生物量组成上看,各季节生物量主要由软体动物和环节动物组成,软体动物生物量夏季最高,秋季和春季次之,冬季最低;环节动物生物量为冬季>春季>秋季>夏季;水生昆虫的生物量冬季最高,夏季最低;甲壳动物的生物量秋季最高,夏季最低(图3)。

2.2.2 现存量的水平变化 由表1可以看出,剑湖全年密度为16~23 840个/m2,最高在采样点A左,E右最低;生物量全年为1.68~2 343.47 g/m2,以采样点D最高,I最低。

表1 剑湖大型底栖动物密度和生物量的水平变化个/m2;g/m2
2.2.3 剑湖大型底栖动物现存量与环境因子的关系
水温、pH、透明度和水深等是影响大型底栖动物生长的重要环境因子,将大型底栖动物的现存量与各个环境因子进行Pearson相关分析,结果见表2~3。

表2 剑湖各季节环境因子
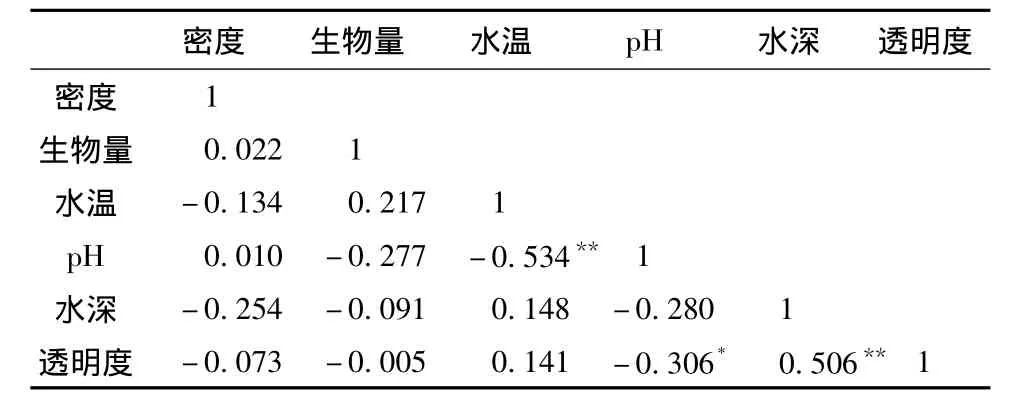
表3 剑湖大型底栖动物现存量与环境因子的Pearson相关系数
Pearson相关分析结果表明:大型底栖动物密度与水温、水深和透明度均呈负相关关系,与pH呈正相关关系;生物量与pH、水深和透明度均呈负相关关系,与水温呈正相关关系;pH与水温呈极显著负相关关系(P<0.01,n=44),与透明度呈显著负相关关系(P<0.05,n=44);水深与透明度呈极显著正相关关系(P<0.01,n=44)。
2.3 大型底栖动物多样性
2.3.1 大型底栖动物多样性的时空变化 调查期间多样性指数中的Margalef丰富度指数(d)全年为0.10~2.75;Shannon-Wiener指数(H')、Simpson生物指数(D)、Pielou均匀度指数(J),全年分别为0.09~1.09、0.03~0.65、0.03~1.43,结果见图4~7。


2.3.2 大型底栖动物多样性的相关分析 将各个季节的Shannon-Wiener指数(H')、Margalef丰富度指数(d)、Simpson生物指数(D)和Pielou均匀度指数(J)与相对应的大型底栖动物密度、生物量进行Pearson相关分析,结果见表4。从表4可知,春、夏、秋、冬4季,Shannon-Wiener指数、Simpson生物指数和Pielou均匀度指数相互间呈显著相关关系(P<0.01,n=44),由此说明,这3个多样性指数均能较好地反映剑湖大型底栖动物的多样性。
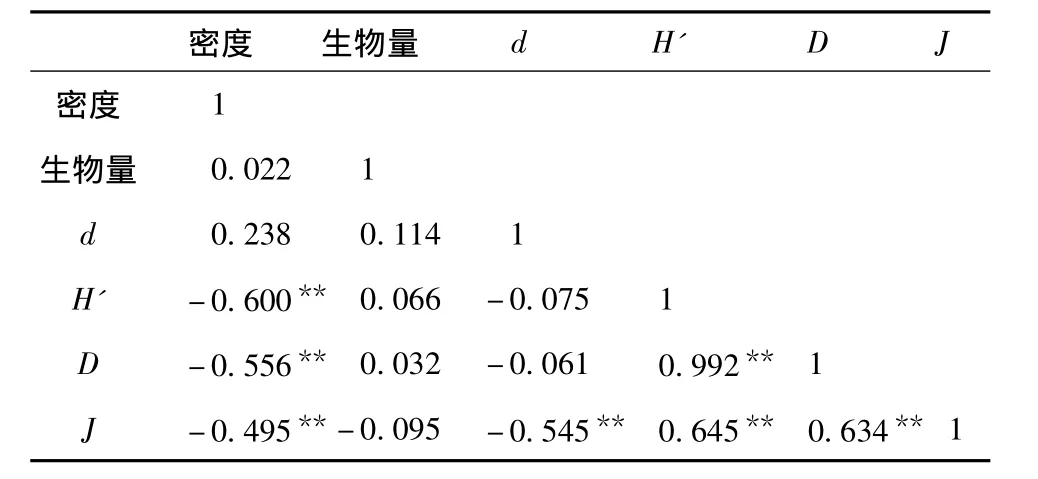
表4 多样性指数和密度、生物量的Pearson相关性
2.4 大型底栖动物群落结构的相似性
比较大型底栖动物种类组成在各采样点间的相似性得出,剑湖各采样点之间大型底栖动物种类组成的相似性系数变幅为0.43~0.87。其中,中等不相似的有4组,极为相似的有8组,其余各点间均为中等相似,不存在极为不相似(表5),可见,剑湖11个采样点间群落结构相似性程度较高。

表5 剑湖大型底栖动物各采样点之间的相似系数
3 讨论
3.1 大型底栖动物的群落特征
剑湖大型底栖动物种类以软体动物和环节动物为主,这两大类动物的生物量在各季节中的变化情况与密度完全一致。但剑湖大型底栖动物年均密度和生物量变化并不完全一致,原因是寡毛类个体极小,对生物量的贡献相对较小,表现为密度高而生物量较低;部分软体动物个体较大且其夏季食物充足,生长速度快,对生物量的贡献相对较大,表现为生物量较高。
11个采样点大型底栖动物现存量分布不均的原因是E左为永丰河的入湖口,且永丰河是城镇污水入湖的主要河流,生活污水的主要污染物质为有机物,微生物、动植物分解及化学反应产生各类化合物,对水体产生不利影响,从而影响了该水域中大型底栖动物的现存量。A右和A左是金龙河的入湖口、B右和B左是格美江的入湖口,金龙河和格美江总磷含量相对于永丰河较低,水质相对较好[16]。
3.2 环境因子对大型底栖动物的影响
Pearson相关分析结果与Viktor等[17]研究得出的,随着水深的增加浅水湖泊中的大型底栖动物密度和生物量会逐渐减少相一致。通过计算得出剑湖中的摇蚊幼虫在冬季现存量高于其他季节,软体动物在冬季现存量低于其他季节,这是由于冬季温度低摇蚊幼虫大量繁殖,软体动物进行越冬,基本停止生长,个体体质量下降明显[18],而软体动物在生物量的贡献上通常高于其他大型底栖动物,所以水温与密度呈负相关关系,与生物量呈正相关关系。本次调查发现,水草(眼子菜、茭草等)分布较多的区域,如采样点A右、A左、B右和B左,软体动物数量较多。
3.3 大型底栖动物多样性特征
从季节上看,Margalef丰富度指数在秋季最高,夏季最低,其原因主要为Margalef丰富度指数大小与大型底栖动物种类数相关,秋季采集获得的种数最多,夏季获得的种数相对较低。Shannon-Wiener指数、Simpson生物指数、Pielou均匀度指数最高值均出现在夏季,最低值均出现在冬季,原因是冬季为剑湖的枯水期,水流缓慢、沉积物较多,大部分为摇蚊幼虫和寡毛类,导致大型底栖动物群落复杂程度降低,多样性指数相对较低;夏季为水生植物生长旺盛期,软体动物和水生昆虫(除摇蚊)因食物充足而大量繁殖,多样性指数相对较高。
从空间上看,Margalef丰富度指数在采样点B右和B左的值相对较高,原因是格美江口喜富营养的茭草群落主要生长在湖岸,浅水地带少量分布,而在河口水底则生长有对水质要求较高的沉水植物苦草群落,因此,此水域中大型底栖动物种类丰富;其他3个多样性指数在采样点D的值相对较高,原因是采样点D位于金龙河和永丰河之间,2条河流汇合,营养物质丰富,适合大型底栖动物的生长繁殖,多样性指数变高。
[1]张宝元.对保护高原湖泊剑湖的思考[J].环境科学导刊,2011,30(3):49-52.
[2]张笑,剑川县党史地方志办公室.剑川年鉴:1991—2000[M].昆明:云南民族出版社,2005.
[3]陈义.中国动物图谱:环节动物[M].北京:科学出版社,1959.
[4]张玺,齐钟彦,马绣同,等.中国动物图谱:软体动物第1册[M].北京:科学出版社,1963.
[5]刘月英,张文珍,王跃先,等.中国经济动物志[M].北京:科学出版社,1979:1-126.
[6]齐钟彦,马绣同,王耀先,等.中国动物图谱:软体动物第4册[M].北京:科学出版社,1983.
[7]大连水产学院.淡水生物学:上册 分类学部分[M].北京:农业出版社,1985:181-346.
[8]Morse J C,Yang L F,Tian L X.Aquatic Insects of China Useful for Monitoring Water Quality[M].Nanjing:HoHai University Press,1994.
[9]王洪铸.中国小蚓类研究[M].北京:高等教育出版社,2002:1-227.
[10]王俊才,王新华.中国北方摇蚊幼虫[M].北京:中国言实出版社,2011.
[11]Shannon-Wiener C E,Weaver W W.The Mathematical Theory of Communication[M].Urbana:University of Illinois Press,1949.
[12]Margalef R.Diversidad de especies en las comunidades naturales[J].Publ Inst Biol Apl Barcelona,1951,9:5-27.
[13]Simpson E H.Measurement of diversity [J].Nature,1949,163:688.
[14]Pielou E C.Ecological Diversity[M].New York:Wiley-Inters,1975:163.
[15]张世海.淀山湖底栖动物群落结构及水质评价[C]//上海研究生学术论坛,2009:360-363.
[16]肖宏现.剑湖湿地湖滨带功能效益研究[J].现代农业科技,2011(13):256-259.
[17]Håkanson L,Boulion V V.Modelling production and biomasses of zoobenthos in lakes[J].Aquatic Ecology,2003,37(3):277-306.
[18]Barquin J,Death G.Patterns of invertebrate diversity in streams and freshwater springs in Northern Spain[J].Hydrobiologie,2004,161:329-349.

