咪唑离子液体中氧在MnO2电极上的电化学性能
王娟,卫国强,段东红,刘世斌
(太原理工大学化学化工学院,山西太原030024)
咪唑离子液体中氧在MnO2电极上的电化学性能
王娟,卫国强,段东红,刘世斌
(太原理工大学化学化工学院,山西太原030024)
以N-甲基咪唑和不同链长的卤代烷烃为原料,合成了三种咪唑类的双(三氟甲基磺酰)亚胺根(TFSI―)离子液体。测定了它们的电导率与电化学窗口;并通过循环伏安、计时电流和交流阻抗等电化学方法,对三种离子液体在涂覆MnO2玻碳电极上的氧还原性能进行了研究。实验结果表明:咪唑环上侧链的链长越长其电导率越小,但对电化学窗口影响不大。分析了氧在三种离子液体中的氧还原电催化机理,比较其电化学性能,均发现咪唑环上侧链链长越短其电化学性能越好。
离子液体;氧还原反应;二氧化锰;电化学性能
氧的还原反应是燃料电池与金属-空气电池中的阴极反应,这个反应机理复杂、动力学缓慢,为满足实际应用对于电池功率密度的需求,必须采用高性能的氧电极。然而作为电池正极的空气电极,存在交换电流密度小、可逆性差、过电位高等缺点。MnO2因具良好的催化活性和低廉的价格,广泛应用于金属-空气电池中[1]。
离子液体是在常温下由阴、阳离子所构成的一种液态的低温熔融盐。由于离子液体大多具有较宽的温度范围、好的电化学稳定性和良好的离子导电性等优点,有望代替传统电解质应用于电化学各领域。目前研究比较多的离子液体按阳离子可以分为季铵盐类、咪唑类和吡啶类等,阴离子主要为四氟硼酸根、六氟磷酸根、双(三氟甲基磺酰)亚胺根[(CF3SO2)2N―]等[2]。不同阴阳离子的组合对离子液体电解质的物理和电化学性质影响很大。如含有TFSI―阴离子的离子液体不仅对水稳定且具有疏水性,因此含TFSI―阴离子的离子液体可以在暴露于空气中的各种电化学过程中使用[3],离子液体的低蒸汽压特性可解决有机电解液易挥发的问题,因此研究氧在含TFSI―的离子液体中的电化学行为就显得很有意义。
本文以卤代烷烃和甲基咪唑为原料,设计合成一系列含TFSI―阴离子的疏水性咪唑类离子液体作为电解液,用MnO2作为氧还原催化剂,通过循环伏安、计时电流和交流阻抗等测试手段来研究氧还原反应在咪唑类离子液体中的电化学行为。
1 实验
1.1 试剂
N-甲基咪唑(98%)、溴辛烷(99%)和碘丁烷(99%),双(三氟甲烷磺酰)亚胺锂(99%)、溴乙烷(99%)和乙酸乙酯,硝酸银,高锰酸钾,硫酸锰,Nafion(5%)(以上均为质量分数),用水均为二次去离子水。所有测试均在室温下进行。
1.2 离子液体的合成
在氮气保护下,将新蒸馏的N-甲基咪唑和过量溴乙烷在35℃搅拌回流8h,将所得混合物用乙酸乙酯洗3次,旋转蒸发除去上层溶剂,于80℃真空干燥12h,制得淡黄色粘稠溶液EMIMBr(溴代1-甲基-3-乙基咪唑鎓盐离子液体)。然后EMIMBr与双(三氟甲基磺酰)亚胺锂(LiTFSI)溶液混合密封,搅拌4h,静置分层后倾倒上层溶液,用去离子水洗涤下层液体,直到上层溶液中滴加AgNO3溶液后无沉淀产生为止,于真空中80℃干燥24h,得到浅黄色的液体1-甲基-3-乙基咪唑双(三氟甲基磺酰)亚胺(EMITFSI)[4-5]。
1-甲基-3-丁基咪唑双(三氟甲基磺酰)亚胺(BMITFSI)与1-甲基-3-辛基咪唑双(三氟甲基磺酰)亚胺(OMITFSI)的制备步骤[4]同上,将上述过程中的溴乙烷分别换成碘丁烷和溴辛烷,与碘丁烷和溴辛烷反应65℃回流24h。
本文所合成的三种离子液体的阳离子和阴离子结构图如图1所示。
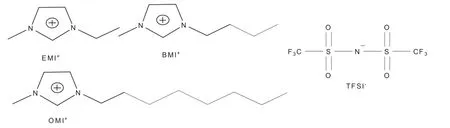
图1 阳离子和阴离子结构图
1.3 二氧化锰催化剂的制备及表征
MnO2制备的步骤为[6]:取摩尔比为2∶3的KMnO4和MnSO4·H2O分别溶于80℃的50mL去离子水中,缓慢滴加到装有100mL去离子水的三口烧瓶中,在90℃下搅拌2h,冷却后得到黑色悬浮液,超声分散匀化10min,抽滤、去离子水数次洗涤,于80℃下干燥12h至恒重,制得MnO2催化剂。
催化剂物相采用X射线衍射仪(D/max-2700,日本Rigaku公司)表征,辐射源为Cu Kα(=0.154056 nm),管压40 kV,管电流80mA,扫描速率8(°)/min,扫描范围2 θ=10°~80°。
1.4 离子液体电导率测定
离子液体的电导率采用DDS-307型电导率仪测试。电导电极为DJS-1型光亮铂电极,电极常数为0.95(298 K),电热恒温水浴控制温度,控温精度为±1 K。
1.5 工作电极的制备
称取10mg的MnO2与5mL超纯水混合,超声匀化10min,用微量注射器吸取10.0 μL悬浮液均匀滴涂于处理过的玻碳电极表面,于50℃烘干,然后取10.0 μL浓度为0.275 g/L的Nafion溶液,涂于催化剂薄膜层上,80℃烘干,即制得薄膜工作电极。
1.6 电化学测试
电化学测试所用仪器为美国PAR公司产的VMP3型多通道恒电位仪。测试采用三电极体系,载有催化剂的玻碳电极为工作电极,铂丝为对电极,Ag/Ag+电极为参比电极,参比溶液为0.1mol/L四丁基高氯酸铵和0.01mol/L硝酸银的乙腈溶液。电解液分别为EMITFSI、BMITFSI和OMITFSI。离子液体的电化学窗口由线性电位扫描(LSV)测得,测试前通氮气饱和,扫描范围―3~4V,扫速50mV/s;循环伏安测试在通氧或通氮饱和的条件下进行,扫描范围为―2~0.5V,扫速为50mV/s;计时电流曲线的测定在―2.0V进行,持续时间为60 s;交流阻抗实验频率范围为100 kHz~0.1 Hz,交流激励信号为±10mV,起始电位为―2.0V。
2 结果与讨论
2.1 X射线衍射表征结果
图2为所制备的MnO2催化剂的X射线衍射(XRD)谱图。在12.7°、18.1°、28.8°、37.5°、42°、56.4°、66.7°处比较尖锐的峰分别对应MnO2(110)、(200)、(310)、(211)、(301)、(600)和(112)晶面衍射峰,在50°、60.3°、70°和73°处较弱的峰对应MnO2(411)、(521)、(541)和(312)晶面衍射峰。图2中各衍射峰的峰位均与标准卡片(JCP-DS No.44-0141)α-MnO2的吻合较好,仅在21°处出现了杂峰,说明所制备的MnO2催化剂中主要为α-MnO2。
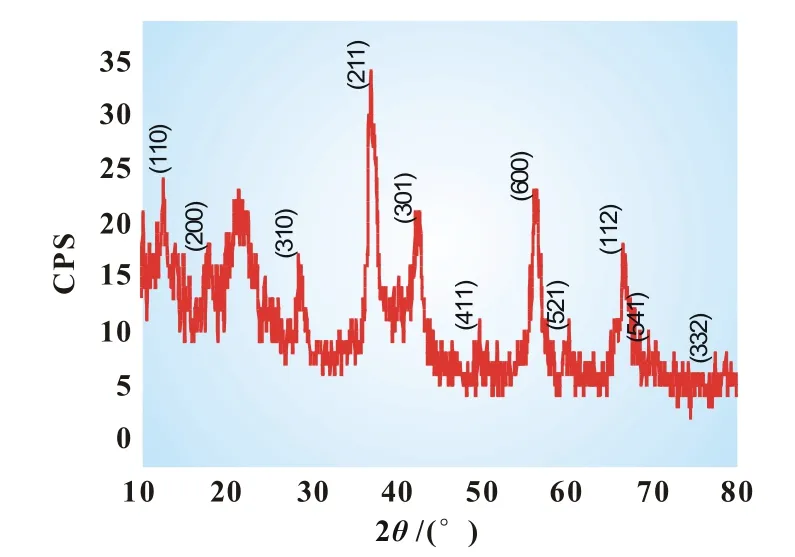
图2 MnO2的XRD谱图
2.2 离子液体电导率测定
电导率是离子液体重要的电化学性质之一,室温下咪唑类离子液体的电导率通常在10―3S/cm左右。实验测得三种离子液体EMITFSI、BMITFSI与OMITFSI的电导率分别为5.7×10―3、2.4×10―3、1.2×10―3S/cm。此三种离子液体的阴离子相同,只是阳离子环上烷基链的长度不同,随着烷基链长度的增加,阳离子的半径增大,分子量增加,黏度增加,故电导率下降[7],表明离子的尺寸对离子液体的导电性有很大影响。电导率越大,则电解质的导电性能就越好,因此EMITFSI的导电性能最好,BMITFSI次之,OMITFSI的导电性能最差。
2.3 电化学窗口分析

图3 用N2饱和的EMITFSI、BMITFSI和OMITFSI电解液的线性扫描伏安图
离子液体的电化学窗口主要由阳离子的还原能力以及阴离子的氧化能力决定,是离子液体从开始发生氧化反应到开始发生还原反应时电位的差值。图3为25℃时用玻碳电极通过LSV测得的三种离子液体的电化学窗口,扫速为50mV/s。从图3可以看出,三种离子液体均在电位负向扫描到―2.2V时开始产生还原电流,说明三种离子液体的阴极抗还原能力接近,而正向扫描时氧化分解电位差别不大,BMITFSI和 OMITFSI同为2.5V,略大于EMITFSI的2.3V,所以EMITFSI的电化学窗口为4.5V,BMITFSI和OMITFSI的电化学窗口为4.7V。三种离子液体的还原极限分别对应EMI+、BMI+和OMI+的还原反应,其氧化极限对应的是TFSI―的分解反应。由实验结果可知,对于相同的TFSI―阴离子,随着阳离子中烷基链长度的增加,电化学窗口变宽,这可能是由于烷基链增加,阳离子体积更大、更弥散的缘故[8]。
2.4 循环伏安测试
图4为玻碳电极上涂覆MnO2催化剂在EMITFSI离子液体中扫描速率为50mV/s的循环伏安曲线,图中曲线a用N2饱和,b和c用O2饱和。由图4可知,扫描范围在―2.1~0.8V内,电解液通N2饱和时未出现明显的氧化还原峰,这说明EMITFSI在此电压范围内是稳定的,无法拉第过程发生。当电解液通O2饱和时,在0.5→―1.6→0.5V扫描范围内,出现了一个还原峰(―0.83V)和一个氧化峰(―0.63V),分别对应O2还原成O2―与O2―氧化成O2的反应[3],即:

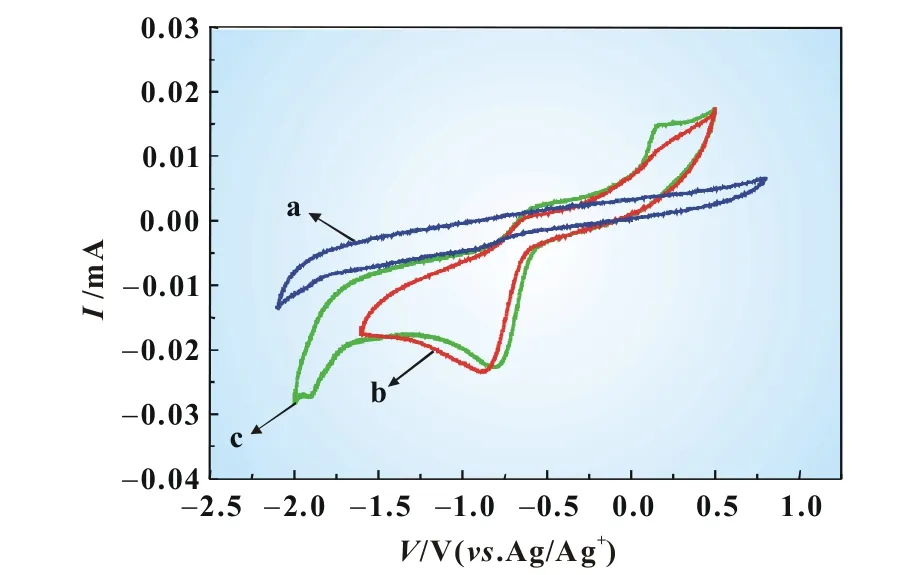
图4 EMITFSI电解液中氧还原的循环伏安图
如图4中曲线b所示,―0.83V附近的还原峰与―0.63V左右的氧化峰电位之差Δp约为200mV,且Δp随扫描速率的变化影响不大,阴极峰电流随着扫速的平方根增加而线性增加,符合Randles-Sevcik方程,说明离子液体中发生O2/O2―氧化还原反应时氧在MnO2电极界面上的传质为线性扩散,这与文献[9]在Au和玻碳电极上得到的结果一致。
图5中扫描范围为―2.0~0.5V,随着扫描速率的增加,在―0.63V处的氧化峰电流基本没有变化,结合文献[9]的研究结果可知,在―0.83V处还原峰与―0.63V处的氧化峰为O2与O2―之间的反应,是准可逆过程。由于O2―与EMI+之间易形成强的离子对(EMI+…O2―),使得O2与O2―在咪唑类离子液体中扩散速率不同,导致氧化还原峰不对称。在EMITFSI中氧的氧化还原过程可表示为:
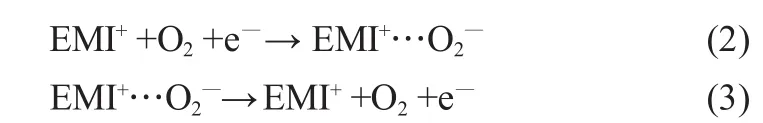
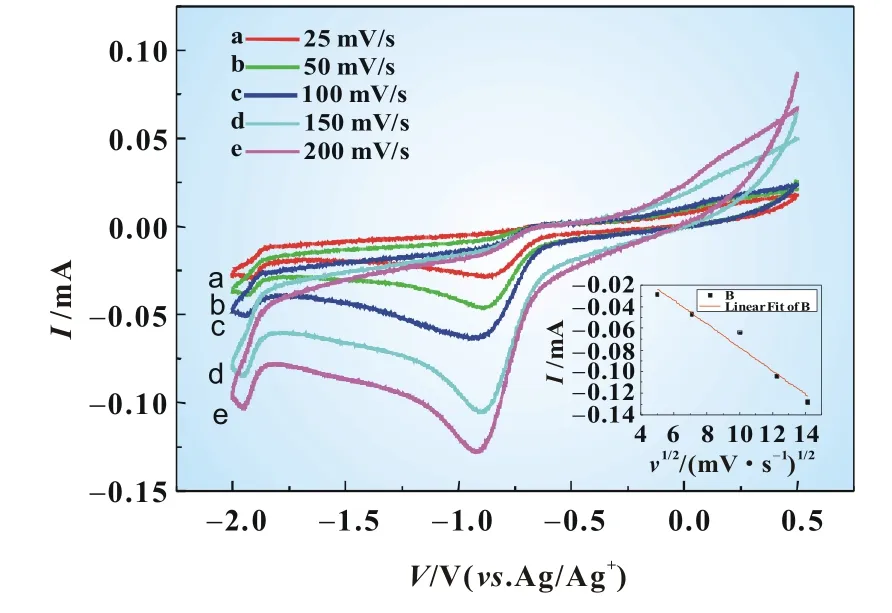
图5 不同扫速下用氧饱和的EMITFSI电解液中氧还原循环伏安图
当扫描范围扩大为0.5→―2.0→0.5V时,除了―0.83V左右的还原峰,在―1.9V左右又出现了一还原峰,在0.15V左右又出现了一氧化峰。因为EMI+在这个电位范围内不会发生还原反应,且与电解液由N2所饱和的空白曲线比较可知,在―1.9V处的还原峰,可能是由于EMI+…O2―进一步还原生成一种过氧化物,在EMI+稳定作用下以EMI+…O―O―…EMI+的形式存在;在0.15V的氧化峰可能是由于在―1.9V处还原产物的再次氧化[9]。
图6为三种离子液体EMITFSI、BMITFSI和OMITFSI作为电解液的氧还原循环伏安特性曲线,扫描速率为50mV/s。电位在―2.0~0.5V范围内,三种咪唑型离子液体循环伏安峰形和峰的位置基本相同,说明氧在二氧化锰电极上在这三种咪唑型离子液体中的氧化还原过程机理相同。在同样的条件下,三种离子液体在―0.83V左右的还原峰电流值分别为0.023、0.018、0.014mA。峰电流密度越大,说明二氧化锰电极对氧还原能力越强,因此根据循环伏安实验结果可知在EMITFSI电解液中的氧还原性能最好,BMITFSI次之,OMITFSI最差。
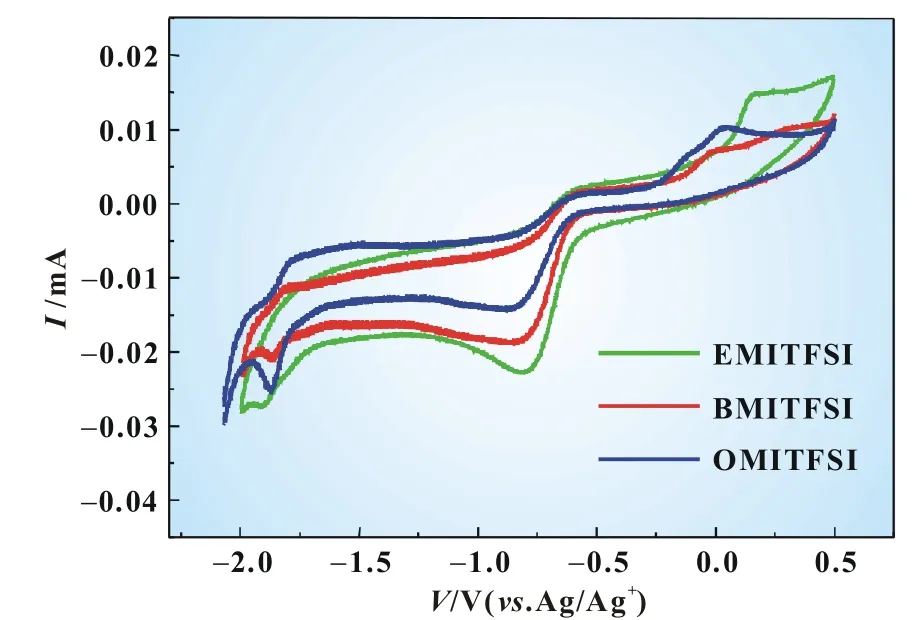
图6 氧饱和的三种电解液中氧还原的循环伏安图
2.5 计时电流分析
计时电流技术是控制电极电位按照一定电势突跃的波形规律变化,同时测量电流或者电量随时间变化的测试方法。图7为氧还原在不同电解液中以恒定电压―2.0V测试的计时电流图,图中数据显示反应开始电流呈下降趋势,除了EMITFSI电解液中有很轻微波动外,都在40 s以后趋于稳定,在EMITFSI、BMITFSI和OMITFSI三种电解液中的极化电流值分别为0.045、0.012和0.006mA,极化电流呈下降趋势,可能是由于这三种离子液体的侧链烷基增大、黏度增加、电导率减小的结果,其电化学性能优良,次序为EMITFSI>BMITFSI>OMITFSI,这与循环伏安测试结果一致。
图7 氧饱和的不同电解液的氧还原计时电流曲线
2.6 交流阻抗分析
图8为氧还原在不同电解液中的交流阻抗谱图。阻抗测试在室温条件下进行,扫描频率为100 kHz~0.1 Hz,控制电位在―2.0V下,交流电位幅值10mV。在图8中高频区阻抗环起点与实轴的交点为本体溶液的电阻,阻抗环半径大小为体系的法拉第阻抗[10]。阻抗环半径越大,产生的法拉第电流的阻抗值就会越大。由图8可知三种电解液的本体溶液电阻大小顺序为EMITFSI<BMITFSI<OMITFSI,则可知三种电解液的电导率大小为EMITFSI>BMITFSI>OMITFSI,此结果与前面所测的三种溶液的电导率规律一致。且由图8可明显看出EMITFSI的阻抗环半径最小,即法拉第阻抗最小,在此电解液中氧还原反应更易发生,所以EMITFSI的电化学性能最佳,同理BMITFSI次之,OMITFSI的最差。
3 结论
以N-甲基咪唑为原料,分别与以溴乙烷、碘丁烷和溴辛烷通过取代反应,合成了三种不同链长的咪唑类双(三氟甲基磺酰)亚胺根离子液体,且三种离子液体的电化学窗口都在4.5V左右,其中EMITFSI的电导率最大,OMITFSI的电导率最小。分别以所合成的三种离子液体为电解质进行循环伏安测试,表明氧还原过程为O2先还原为O2―,然后O2―与溶液中的EMI+形成离子对EMI+…O2―,EMI+…O2―进一步还原为O2―后又与EMI+生成了另外一种离子对。计时电流法和交流阻抗法测试结果均表明三种离子液体中,EMITFSI的电化学性能最好,BMITFSI次之,OMITFSI最差。上述结果均表明咪唑类双(三氟甲基磺酰)亚胺根(TFSI―)离子液体咪唑环上侧链烷基链越短其电化学性能越好。
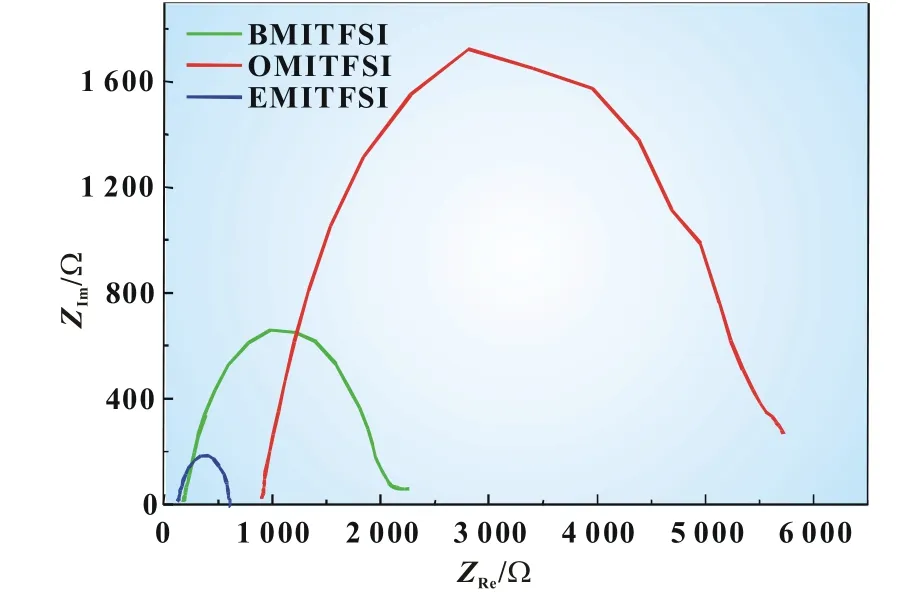
图8 氧饱和的不同电解液中的氧还原交流阻抗图
[1]WEI Z,HUANG W Z,ZHANG S T,et al.Carbon-based air electrodes carrying MnO2in zinc-air batteries[J].Journal of Power Sources,2000,91:83-85.
[2]骆宏钧,张校刚.BMIPF6室温离子液体对锂离子电池高温性能的影响[J].电源技术,2009,33(10):873-875.
[3]KATAYAMA Y,ONODERA H,YAMAGANA M,et al.Electrochemical reduction of oxygen in somehydrophobic room-temperaturemolten salt systems[J].Journal of the Electrochemical Society,2004,151(1):A59-A63.
[4]BONHOTE P,DIASA P,PAPAGEORGIOU N,et al.Hydrophobic,highly conductive ambient-temperaturemolten salts[J]. Inorganic Chemistry,1996,35(5):1168-1178.
[5]王毅,高德淑,李朝辉,等.离子液体在双电层电容器中的应用研究[J].电源技术,2005,29(7):466-469.
[6]刘世斌,周娴娴,池永庆,等.纳米二氧化锰的制备及其形貌调控[J].太原理工大学学报,2011,42(4):369-374.
[7]张星辰.离子液体——从理论基础到研究进展[M].北京:化学工业出版社,2009:31.
[8]MCEWENA B,NGO H L,LECOMPTE K,et al.Electrochemical properties of imidazolium salt electrolytes for electrochemical capatitor applications[J].Journal of the Electrochemical Society, 1999,146(5):1687-1695.
[9]ALLEN C J,MUKERJEE S,PLICHTA E J,et al.Oxygen electrode recharge ability in an ionic liquid for the li-air battery[J].The Journal of Physical Chemitry Letters,2011(2):2420-2424.
[10]LI M T,YANG L,FANG S H,et al.Polymer electrolytes containing guanidinium-based polymeric ionic liquids for rechargeable lithium batteries[J].Journal of Power Sources,2011,196: 8662-8668.
Electroreduction of oxygen on MnO2electrode in imidazolium ionic liquid electrolytes
WANG juan,WEI Guo-qiang,DUAN Dong-hong,LIU Shi-bin
Three imidazolium-base ionic liquids with bis(trifluoromethanesulfone)imide as anion were synthesized using N-methyl imidazole and different chain lengths of thehaloalkane as rawmaterials.Their conductivity and electrochemical windows were determined.Glass carbon was coated with MnO2as a working electrode,the electrochemical oxygen reduction reaction was investigated in threehydrophobic room-temperature ionic liquids by different electrochemicalmethods,such as cyclic voltammogram,chronoamperometry and electrochemical impedance spectra.Experimental results show that the longer the chain length of imidazole ring on the side chain, the smaller the conductivity;but ithas little effect on the electrochemical windows.Themechanism of electro-catalysis oxidation reduction reaction was analyzed in the three ionic liquids using cyclic voltammogram. Comparing their electrochemical properties,all the testing results shows that the shorter the chain length of imidazole ring on the side chain,the better the electrochemical will performance.
ionic liquid;oxygen reduction reaction;MnO2;electrochemical performance
TM 912
A
1002-087 X(2014)10-1860-04
2014-03-15
国家自然科学基金(20676088);教育部博士点基金(20091402110009)
王娟(1986—),女,山西省人,硕士研究生,主要研究方向为电化学及其应用。
段东红,副教授,E-mail:dhduan@163.com