缝线黏附重组pcDNA3-GDNF-GFP质粒在周围神经损伤中的实验研究
何 睿,蒋电明
缝线黏附重组pcDNA3-GDNF-GFP质粒在周围神经损伤中的实验研究
何 睿,蒋电明
目的 研究周围神经损伤后新的修复方法,了解携带含胶质细胞源性神经营养因子(GDNF)基因重组质粒的缝合线对损伤的周围神经修复的影响。方法 使用prolene线浸泡于0.1%的左旋多聚赖氨酸和质粒等体积液并冻干,反复3次后使缝线黏附上质粒DNA。50只雌性Wistar大鼠制成右侧坐骨神经缺损动物模型,随机分为实验组和对照组,每组各25只。实验组使用黏附pcDNA3-GDNF-GFP的缝线,对照组使用黏附pcDNA3的缝线进行坐骨神经的缝合修复。术后1 w、8 w使用激光共聚焦显微镜检测GDNF在神经修复处的表达,于坐骨神经吻合处取材行免疫组化检测;手术后12 w行右侧坐骨神经电生理检查。结果 携带pcDNA3-GDNF-GFP重组质粒的缝线修复周围神经时,该质粒可以转染周围神经并得到表达。实验组神经的传导速度、动作电位的峰值及潜伏期分别是(19.82±1.90)m/s、(3.47±0.32)mV、(0.36±0.03)ms,明显优于对照组。结论 使用携pcDNA3-GDNF-GFP重组质粒的缝线修复损伤的周围神经,可以促进损伤神经的再生。
神经;再生;缝线;胶质细胞源性神经营养因子;质粒;修复
胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)是一种具有重要生物活性的神经营养因子,其促进神经元存活,参与神经细胞程序化死亡,并在轴突损伤的修复方面起着重要的作用[1]。本实验用携带pcDNA3-GDNF-GFP重组质粒的缝线修复大鼠坐骨神经,验证其作为载体的可行性。
1 材料与方法
1.1 质粒的提取与纯化 重组质粒pcDNA3-GDNF-GFP与pcDNA3,由重庆医科大学微生物教研室提供,使用Qiagen公司的Endofree Plasmid Giga试剂进行质粒的提取和纯化,最终浓度为5 mg/ml。
1.2 缝线的制备 采用美国强生公司10/0 prolene线。用0.1%的左旋多聚赖氨酸(Sigma公司)和质粒进行等体积混合,使其终浓度为2.5 mg/ml。将prolene线浸泡于混合溶液中, 24 h后取出冻干,再浸泡于此溶液中,重复3次,共浸泡72 h后,将制备的缝线置于无菌Eppendorf管内,存放于低温冰箱备用。经紫外分光光度仪检测,缝线质粒含量约为2.5 μg/cm。
1.3 神经离断动物模型 雌性Wistar大鼠购自第三军医大学实验动物中心[动物合格证号:SCXK(渝)2012-003],体重约250 g,共50只,采用完全随机分段分组法分成实验组和对照组,每组各25只。经3.5%水合氯醛按1 ml/100 g行腹腔注射麻醉,于无菌条件下作右臀部斜切口,显露右坐骨神经,距梨状肌下缘0.5 cm处切断,实验组使用黏附pcDNA3-GDNF-GFP的缝线、对照组使用黏附pcDNA3的缝线,端端对线缝合神经外膜8针。
1.4 观察指标
1.4.1 大体观察 术后常规喂养大鼠,按设定时间段观察步态、双下肢肌肉、右足肿胀和足底溃疡的情况。
1.4.2 激光共聚焦显微镜检测 两组于术后1 w、8 w各取5只大鼠,以3.5%水合氯醛腹腔注射麻醉后,取距吻合口上下各0.5 cm共约1 cm长神经,OTC包埋后立刻冰冻切片(40 μm),用Leica TCS SP2激光共聚焦显微镜直接观察荧光表达。
1.4.3 免疫组化检测 术后1 w、8 w分别处死两组各10只大鼠,于坐骨神经吻合处切片,使用中杉公司试剂并按说明行GDNF免疫组化检测。
1.4.4 神经电生理测定 术后12 w,两组各10只大鼠以3.5%水合氯醛腹腔麻醉后,显露右侧坐骨神经,刺激电极在吻合口近端钩住坐骨神经,接收电极于吻合口以远刺入坐骨神经,地线刺入对应的股二头肌。使用成都泰盟公司BL-410生物机能系统,刺激强度0.2 V,波宽0.1 ms,延时5 ms,单刺激。找出诱发动作电位的阈值和最大刺激后,再重复刺激3次,待显示动作电位稳定后,计算潜伏期、神经传导速度和动作电位峰值。
1.5 统计学方法 使用SPSS 13.0 软件进行统计学分析,所有的数据以均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大体观察 所有大鼠的伤口均一期甲级愈合。术后即出现患侧拖足步态,足下垂,患侧肢体肿胀且着地时间明显缩短。2 w后肿胀开始减退;术后3 w,两组患侧腓肠肌均严重萎缩,手术侧足部仍红肿;术后8 w步态有好转,实验组腓肠肌萎缩,对照组足部均出现溃疡;12 w后,实验组腓肠肌萎缩恢复,对照组溃疡愈合,但肌萎缩明显。
2.2 荧光检测 术后1 w,激光共聚焦显微镜下,实验组缝合处可见强烈荧光蛋白表达,阳性细胞分布均匀,大小不等,部分胞体较大,可能是雪旺细胞,胞体较小可能是淋巴细胞或成纤维细胞(图1A);8 w时表达减少,荧光减弱,但仍可以检出。对照组未检出荧光蛋白(图1B)。
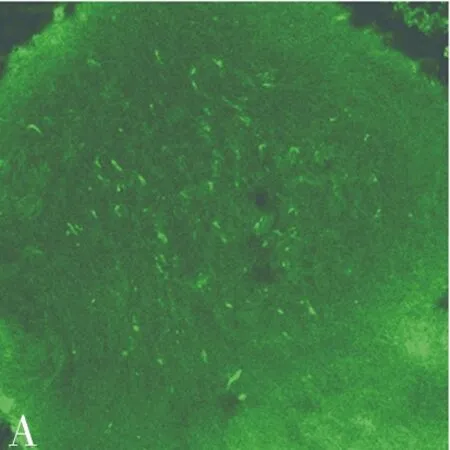
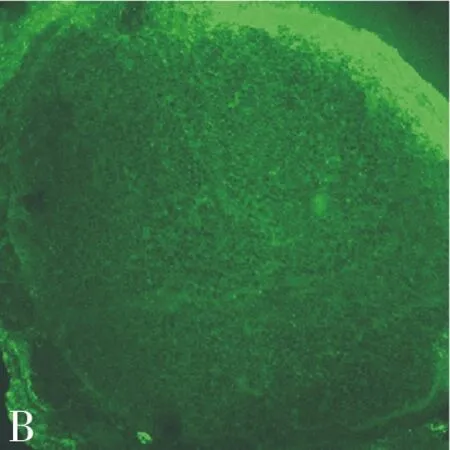
图1 术后1 w激光共聚焦(×200)
2.3 免疫组化结果 1 w时,实验组GDNF阳性表达细胞数显著高于对照组(P<0.01),两组的GDNF阳性细胞在8 w时均下降,但实验组仍高于对照组(图2),两者比较有显著差异(P<0.01,表1)。
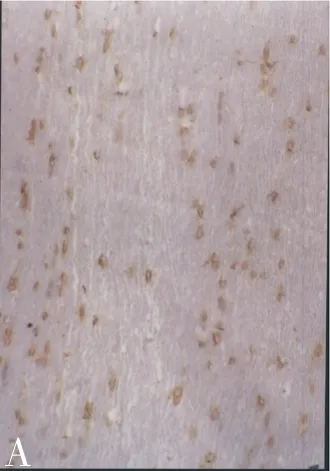

图2 术后8 w免疫组化染色(×200)

组别 1w8w实验组0.56±0.11①0.38±0.07①对照组0.36±0.08 0.17±0.05
注:与同时间对照组相比,①P<0.01
2.4 神经电生理测定结果 术后12 w,实验组动作电位潜伏期短于对照组,神经传导速度和动作电位峰值均较对照组高(P<0.01,表2)。

表2 术后12 w神经电生理检测结果(n=10)
注:与对照组相比,①P<0.01
3 讨论
周围神经损伤后,在其远、近端及间隙中形成的具有促神经生长的细胞、细胞外基质和营养神经物质被称为周围神经再生的微环境。许多研究证实,周围神经损伤后,能否可以成功的再生,主要依靠其是否具有适合的微环境条件。神经营养因子是其中的重要因素,在神经系统的发育和再生中起着重要作用[2]。这种机制主要包括:(1)保持感觉、运动神经元的存活;(2)加快神经再生速度;(3)诱导分化神经生长方向。因此,在周围神经损伤后的再生微环境中,加入外源性的神经营养因子可以促进其修复。
GDNF是近年神经营养因子研究的热点之一,许多研究已证明GDNF对损伤神经有保护作用,GDNF是TGF-β超家族中最具有潜力的营养因子。目前已发现它能促进人体内许多种细胞群的存活,包括缺血、损伤状态下的中枢和外周神经、脊髓的自主神经元、多巴胺能神经元及视网膜节细胞等[3-7]。GDNF的分子量为15 kDa,是一种分泌蛋白,是靶源性的神经营养因子,可通过逆转运或旁分泌作用对神经元起营养作用[8-10]。
选择适合的载体,将编码GDNF的基因导入损伤部位使其稳定并高效的表达,发挥营养、促进神经再生的作用,对周围神经损伤后的治疗有积极意义。目前研究的GDNF基因载体主要有:(1)脂质体介导的GDNF转染真核细胞;(2)病毒载体;(3)质粒,作为非病毒载体,目前质粒在基因治疗中的应用前景最引人注目[11]。质粒DNA和重组病毒相比,操作更简单,容纳的插入序列更大,扩散整合的危险性更小,容易制备、成本很低。质粒DNA的抗原性较低,可以多次反复投药而不会引起严重免疫的反应。
现阶段使用重组载体增加神经再生微环境中的神经营养因子大多采用注射方法,通常采用肌肉内注射、神经中注射、皮下注射和灌注等。这些方法有一定操作难度,作用时间较短暂,神经注射后可出现轴索损伤和脱髓鞘等改变[12]。本实验采用携质粒DNA的prolene线作为载体,使用携重组pcDNA3-GDNF-GFP质粒的缝线修复神经损伤,使得神经的修复和营养因子的导入一步完成,既可以减少损伤,又能简化操作。在缝线制备时,使用0.1 %的右旋多聚赖氨酸作为黏合剂,同时右旋多聚赖氨酸带正电荷,质粒DNA带负电荷,两者电荷相吸亦可促进质粒的黏附。
本实验证实,缝线携带DNA修复损伤的坐骨神经,质粒DNA可以释放并转染表达。在实验中,术后8 w仍可观察到外源性的GDNF-GFP荧光,实验组神经的传导速度、动作电位的峰值和潜伏期明显优于对照组,动物伤肢恢复也好于对照组。提示应用携pcDNA3-GDNF-GFP质粒的缝线修复损伤坐骨神经,短期内可以促进轴突再生,降低实验动物伤残率,其长期效果还需要进一步观察。但该方法可以避免其他导入方式所引起的损伤和毒副作用,可能成为周围神经损伤后基因治疗的一个新方法。
[1] Oppenheim RW,Houenou LJ,Johnson JE,et al.Developing motor neurons rescued from programmed and axotomy-incuced cell death by GDNF[J].Nature,1995,373(3):344-346.
[2] Henderson CE.Role of neurotrophic factors in neuronal development[J].Curr Opin Neurobiol,1996,6(1):64-70.
[3] Bark S.Parkinson disease:etiology,pathogenesis and future of gene therapy[J].Neuroscience Research,2001,41(5):5-12.
[4] Sarabi A,Chang CF,Wang Y,et al.Time course study of GFRalpha-1 expression in an animal model of stroke[J].Exp Neurology,2001,170(4):283-289.
[5] Marques JM,Belze I,Holtmann B,et al.Cardiotrophin-1 is an es-sential factor in the natural defense of the liver against apoptosis[J].Hepatology,2007,45(3):639-648.
[6] Yang ZT,Lau CK,Lam SP,et al.Cardiotrophin-1 enhances regeneration of cirrhotic liver remnant after hepatectomy through promotion of angiogenesis and cell proliferation[J].Liver Int,2008,28(5):622-631.
[7] Eric G,Isabelle D,Michael P,et al.GDNF and NGF released by synthetic guidance channels support sciatic nerve regeneration across a long gap[J].European Journal of Neuroscience,2002,15(4):589-601.
[8] Cheng H,Wu JP,Tzeng SF.Neuroprotection of glial cell line-derived neurotrophic factor in damaged spinal cords following contusive injury[J].J Neurosci Res,2002,69(3):397-405.
[9] Miyazaki H,Takashi O,Yasunobu O,et al.Glial cell line-derived neurotrophic factor modulates ischemia-induced tyrosine hydroxylase expression in rat hippocampus[J].European J Neuroscience,2000,129:2032-2038.
[10] Brunet N,Tarabal O,Portero-Otin M,et al.survival and death of mature avian motoneurons in organotypic slice culture:trophic requirement for survival and different types of degeneration[J].Journal of Comparative Neurology,2007,501(5):669-690.
[11] Lew D,Parker SE,Latimer T,et al.Cancer gene therapy using plasmid DNA:pharmacokinetic study of DNA following injection in mice[J].Hum Gene Ther,1995,6:553-564.
[12] Shy ME,Tani M,Shi YJ,et al.An adenoviral vector can transfer lacZ expression into Schwann cells in culture and in sciatic nerve[J].Ann Neurol,1995,38:429-436.
Experimental research on peripheral nerve regeneration promoted by suture carrying recombinant plasmid pcDNA3-GDNF-GFP
He Rui1,Jiang Dianming2
1.Department of Orthopaedics,the Second People's Hospital of Chengdu City,Chengdu,Sichuan,610017,China;2.Department of Orthopaedics,the First Affiliated Hospital,Chongqing University of Medical Science,Chongqing,400016,China
Objective To develop a new restorative procedure after peripheral nerve injury,and to explore the effects of the suture carrying glial cell line-derived neurotrophic factor(GDNF)recombinant plasmid on peripheral nerve regeneration.Methods Prolene sutures were soaked in the mixed solution of 0.1% poly L lysine and the same volume of plasmid and got freeze dried for consecutive 3 times until the sutures carried the plasmid DNA.Then sutures were stored the sutures in deep freeze refrigerator for later use.Fifty Wistar rats with their right sciatic nerves cut were used as the animal model and randomly divided into experimental and control groups with 25 ones in each group.In the reparation of sciatic nerves,the sutures carrying pcDNA3-GDNF-GFP plasmid were used in the experimental group,while the sutures carrying pcDNA3 were used in the control group.Confocal laser scanning microscope was used to detect the expression of GDNF in the repaired sites of the nerves 1 and 8 w after the operation.Materials in the sciatic neural anastomosic sites were taken for the immunohistochemistry examination.Electeophysiological examination was carried out 12 weeks after the operation.Results In the neural reparation by the sutures carrying pcDNA3-GDNF-GFP recombinant plasmid,the plasmid could transfer the peripheral nerve and be expressed.The neural conduction velocity,peak value of action potential,and the latent period in the experimental group were(19.82±1.90)m/s,(3.47±0.32)mv,and(0.36±0.03)ms,respectively,which were significantly better than those in the control group.Conclusion Using the suture carrying pcDNA3-GDNF-GFP recombinant plasmid in the reparation of the injured peripheral nerves can promote the regeneration of the injured nerves.
nerve;neural regeneration;suture;glial cell line-derived neurotrophic factor;plasmid;reparation
610017 成都,成都市第二人民医院骨科(何 睿);重庆医科大学附属第一医院骨科(蒋电明)
蒋电明,E-mail:jdm571026@vip.163.com
R 651.3
A
1004-0188(2014)01-0026-03
10.3969/j.issn.1004-0188.2014.01.010
2013-08-05)
——从一道浙江选考生物学试题谈起

