反向斑点杂交检测泰泽病原体
赵婷婷,严磊,魏立雯,韦莉,王会娟,赖国旗,谭毅
(1.重庆医科大学实验动物中心,重庆 400016;2.泸州医学院科技处实验动物中心,四川 500016;3.重庆市中药研究院,重庆 400065)
泰泽病原体属毛状芽孢杆菌(Bacillus piliformis),由日本学者Ernest Tyzzer于1917年首次在华尔兹小鼠群中发现并命名[1]。其宿主范围较广,能感染大鼠、小鼠、豚鼠、地鼠、沙鼠、仓鼠、兔、猫、狗、马、牛、恒河猴、狐狸、袋鼠、熊猫、鹦鹉等动物,甚至可能感染人,特别是实验动物饲养人员[2,3]。泰泽病原体主要呈隐形或亚临床性感染,啮齿动物可成为其长期的携带者[4]。当动物处于应激状态(环境条件改变、过度拥挤、长途运输等)、使用高蛋白饲料喂养或实验中使用免疫抑制剂,均会导致本病的流行,其对实验动物的健康和动物实验的顺利进行是一潜在威胁。国家标准规定泰泽病原体是清洁级及以上实验动物必须排除的病原体之一。
目前,可用于泰泽病原体检测的方法很多,如,组织病理学诊断、PCR扩增、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)和免疫荧光试验(immuno fluorescence assay,IFA)等[5]。其中ELISA法和IFA法是实验动物微生物质量检测国家标准。组织病理学诊断不够客观,PCR法非特异性高,ELISA法和IFA法检测灵敏度低。因这些检测方法的局限,使得泰泽病原体的检测成为了实验动物质量控制中的一个难题。
本实验尝试将反向斑点杂交和PCR扩增相结合,建立一种检测泰泽病原体的新方法。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验动物为38只SD大鼠和41只小鼠(品种有C57BL/6、KM、BALB/c),来自重庆地区各实验动物中心,清洁级;沙门菌(Salmonella sp.)、金黄色葡萄球菌(Staphylococcus aureus)由重庆医科大学实验动物中心保存;小鼠肝炎病毒A59(mouse hepatitis virus,MHV-A59)购自美国菌种保藏中心(ATCC)。Taq DNA聚合酶、DH5α感受态细胞、pMD18-T载体、胶回收试剂盒、RNA提取试剂盒(均为TaKaRa公司,日本)、基因组DNA提取试剂盒、碱性磷酸酶SA-AP(均为Promega公司,美国)、蛋白胨、琼脂糖等(均为北京鼎国生物试剂公司,中国)、硝酸纤维膜(Millipore公司,美国)、BCIP/NBT碱性磷酸酶显色试剂盒(上海碧云天生物技术有限公司,中国)、牛血清白蛋白(BSA)(Spain公司,西班牙)、酶联免疫吸附试验试剂盒(江苏西山,中国)、免疫荧光试验试剂盒(中国医学科学院,中国)。
1.1.2 仪器
1000-Series Thermal Cyclers PCR仪、GelDocXR+凝胶成像分析系统(BioRad公司,美国),NANODROP 2000(Thermo公司,美国),恒温培养振荡器(上海智城分析仪器制造有限公司,中国),杂交槽(北京明威派胜医药科技有限公司,中国)。
1.2 方法
1.2.1 引物和探针的设计
根据泰泽病原体16S rDNA序列设计PCR扩增引物[5-7]和特异性探针(表1),其中外引物为细菌16S rDNA通用引物,内引物根据泰泽病原体16S rDNA序列保守区设计,内引物的上游引物在5'端标记生物素,由Invitrogen公司合成。

表1 引物及探针Tab.1 The primers and probes used in this study
1.2.2 泰泽病原体DNA提取
根据基因组DNA提取试剂盒使用说明,提取泰泽病原体阳性小鼠新鲜肝组织基因组DNA。
1.2.3 外引物PCR扩增及T载体连接
(1)外引物PCR扩增
扩增体系为 5 × Primix Taq 25 μL,20 μmol/L的 F1/R1各1μL,模板 DNA 150 ng,ddH2O 补足至50 μL。扩增条件为:94℃预变性5 min;94℃变性2 min,51℃退火 2 min,72℃延伸 2 min,30 个循环;72℃延伸7 min。PCR扩增产物进行1.2%的琼脂糖凝胶电泳及NANODROP 2000定量。
(2)pMD18-T-Tyzzer连接并测序
按pMD18-T连接试剂盒使用说明,将F1/R1 PCR扩增产物亚克隆到pMD18-T载体上,方法如下:pMD18-T 载体 1 μL,PCR 产物 124 ng,ddH2O 1 μL,Solution 5 μL。16℃ 连接 2 h,全量加至 50 μL DH5α感受态细胞,冰上放置30 min,42℃热激45 s,冰上放置1 min,加450 μL不含氨苄抗性的LB液体培养基,37℃、250 r/min振荡培养60 min。9000×g离心后弃上清,均匀涂布于氨苄抗性的L-琼脂平板培养基上,37℃培养16 h,挑取单菌落于含氨苄抗性的LB液体培养基中37℃、250 r/min培养16 h,提取质粒DNA,送Invitrogen公司测序。
1.2.4 内引物PCR扩增
扩增体系为 5 × Primix Taq 25 μL,20 μmol/L的 F2/R2 各 1 μL,pMD18-T-Tyzzer DNA 150 ng,ddH2O补足至50 μL。扩增条件与外引物PCR扩增相同。扩增产物进行1.2%的琼脂糖凝胶电泳及NANODROP 2000定量。
1.2.5 杂交膜制备
将硝酸纤维素膜先后于ddH2O和2×SSC、0.1%SDS中浸泡10 min,挑选浸泡均匀的膜,120℃烘烤30 min,后裁剪为约4 mm宽、4.5 cm长的试剂条备用。以pMD18-T-Tyzzer为模板,用内引物进行PCR扩增,将PCR扩增产物(含生物素标记)稀释成3 ng/μL作为阳性对照,将生物素标记的内引物上游引物配制成0.1 μmol/L作为通用探针,将探针1和探针2(poly-10C、15C、20C)配制成50 μmol/L。按阳性对照、通用探针、探针1和探针2的顺序各取1 μL点膜(图1),自然晾干后于1500×0.1 mJ/cm2进行紫外交联,120℃烘烤30 min后室温干燥保存。

图1 泰泽病原体检测试剂条示意图Fig.1 Diagram of the test strip of Tyzzer's organism
1.2.6 反向斑点杂交条件优化
(1)杂交条件优化
将制备好的杂交膜浸泡于2 mL杂交液(2×SSC、0.1%SDS)中,加入40 μL PCR 变性产物(F2/R2 PCR扩增产物10 μL和0.4 mol/L NaOH变性液30 μL 于室温混合作用 15 min),43℃、45℃或 48℃40 r/min振荡杂交1 h、1.5 h或2 h。
(2)洗膜、孵抗和显色条件优化
杂交完毕后,用杂交液室温漂洗2~3次,3分/次,洗膜液(0.5× SSC、0.1%SDS)45℃或50℃洗脱20 min;TBS室温漂洗3 min,将杂交膜浸泡于2 mL SA-AP液(TTBS 2 mL+BSA 0.1 g+SA-AP 1∶2000、1∶5000 或 1∶7000),37℃ 孵育 0.5 h、1 h 或1.5 h;TBS室温漂洗3 min,生物素缓冲液室温漂洗3 min,将杂交膜浸入2 mL NBT/BCIP显色工作液(碱性磷酸酯酶显色缓冲液2 mL+150×NBT 13 μL+300× BCIP 6 μL避光配制),避光显色20 min,最后将杂交膜浸入蒸馏水中终止显色反应,根据紫色斑点出现的位置直接判断杂交结果。
1.2.7 反向斑点杂交灵敏度及特异性检测
用ddH2O稀释泰泽病原体PCR产物至18 ng/μL、9 ng/μL、4.5 ng/μL 和 2.25 ng/μL,按优化的RDB方法进行反向斑点杂交,判断检测下限;按参考文献[8-10]方法分别扩增小鼠肝炎病毒、Staphylococcus aureus和Salmonella sp.,并进行RDB。
1.2.8 反向斑点杂交的应用
用ELISA、IFA和优化后的RDB对重庆地区38只大鼠和41只小鼠进行泰泽病原体检测,并按实验动物使用的3R原则给予人道关怀。
1.2.9 统计学分析
用软件SSPS 17.0对实验数据进行统计学分析。若P<0.05,则有统计学差异。

图2 泰泽病原体16S rDNA PCR扩增产物琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of the PCR amplification products of Tyzzer's organism 16S rDNA
2 结果
2.1 内外引物PCR扩增结果
泰泽病原体用外引物(F1/R1)PCR扩增后目的片段为625 bp(图2 a);用内引物(F2/R2)PCR扩增后目的片段为196 bp(图2 b),经测序后与泰泽病原体16S rDNA序列进行同源性比较,匹配率为100%。
2.2 反向斑点杂交条件优化
将探针1和探针2在3'端和5'端分别用10C、15C、20C 修饰,并将探针按 20、50、100 μmol/L 浓度稀释后分别点样,在42℃、45℃和48℃温度下分别杂交 1 h、1.5 h、2 h,在 37℃与 1∶2000、1∶5000、1∶7000 浓度的 SA-AP 孵育0.5 h、1 h、1.5 h,结果发现探针1和探针2均修饰15C、浓度为50 μmol/L,杂交温度为 45℃、杂交时间为 1 h,抗体浓度为1∶2000、孵育时间为1 h时,各斑点信号强度较好,并无非特异性染色(图3)。
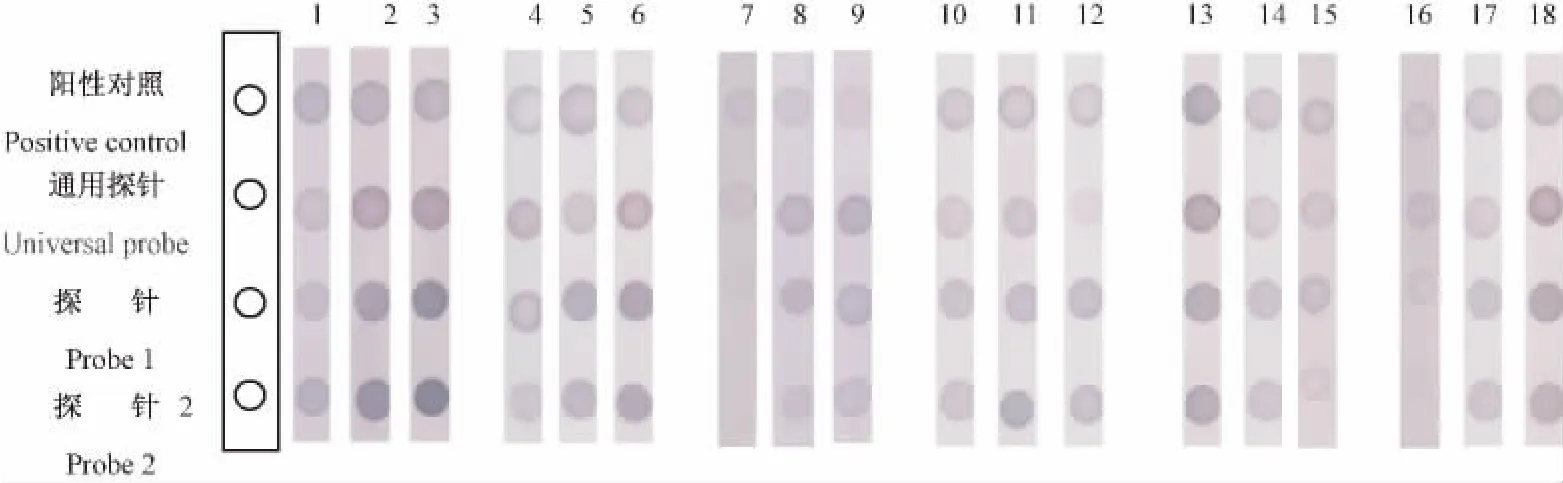
图3 泰泽病原体反向探针斑点杂交条件优化Fig.3 Optimization of the conditions of Tyzzer's organism RDB detection
2.3 反向斑点杂交灵敏度和特异性
将PCR扩增后的产物用ddH2O梯度稀释后,进行反向斑点杂交检测,当PCR产物浓度最低为4.5 ng/μL时,可检测出泰泽病原体(图4)。将泰泽病原体、小鼠肝炎病毒、Staphylococcus aureus和Salmonella sp.PCR扩增产物分别进行反向斑点杂交检测,仅泰泽病原体检测结果为阳性(图5)。
2.4 反向斑点杂交反应的应用
应用ELISA、IFA和RDB同时检测大、小鼠共79只,结果见表2。ELISA法和RDB法检测结果一样,均检测出6个阳性样本,阳性率均为7.59%,P>0.05,差异无显著性;而IFA法和RDB法检测结果差异有显著性,P<0.05,差异有显著性。
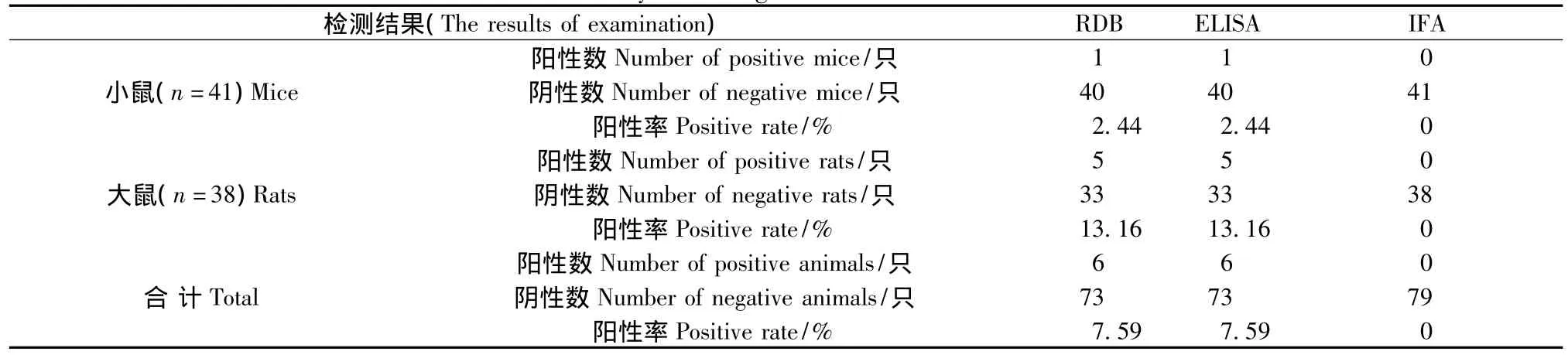
表2 大、小鼠泰泽病原体检测结果Tab.2 Detection results of the rat and mouse Tyzzer's organism

图4 泰泽病原体反向斑点杂交灵敏度检测Fig.4 Sensitivity of the RDB detection of Tyzzer's organism

图5 泰泽病原体反向斑点杂交特异性检测Fig.5 Specificity of the RDB detection of Tyzzer's organism
3 讨论
泰泽病原体为专性胞内寄生菌,有嗜肝细胞性,对生长环境要求苛刻,不能在无细胞的人工培养基上生长,在无活体组织和活细胞时极易自溶。泰泽病原体可通过卵黄囊途径接种鸡胚进行增殖,但是该方法成功率较低,推广应用困难,严重制约了对泰泽病原体生物学特性,遗传致病机制,检测方法的研究。
目前,用于检测泰泽病原体的方法主要是ELISA、IFA、可的松激发试验和PCR扩增。日本实验动物中央研究所、我国台湾及内陆研究人员均先后发现并证实:在使用ELISA或IFA检测泰泽病原体时,梭菌会和泰泽病原体发生交叉反应而出现假阳性,故不能用于确诊实验动物泰泽病原体感染[5]。并且ELISA和IFA等血清学检测方法对泰泽病原体的抗原抗体要求较高,病原体分离培养难度大,成本高,有效期短,不适合小样本筛检,故血清学方法的应用推广也变得困难。而可的松激发试验操作繁琐,周期长,大规模检测时可实施性较小,而PCR扩增灵敏度高,快速,但特异性较难保证。
反向斑点杂交的原理是将已知的特异性探针固化到硝酸纤维膜上,与5'端修饰有生物素的引物扩增的PCR产物进行杂交,通过对生物素显色,直观的判断杂交信号,即得出检测结果。该方法因快速、简便、特异、灵敏等优点,已广泛应用于病原体检测、基因突变、基因分型的研究[11-14]。
本实验合成的两个寡核苷酸探针与基因库进行同源性比对,发现与之互补序列均为泰泽病原体所特异,与其他生物无同源性。结果判断:当显色对照和通用探针成立的前提下,两条探针检测结果均为阳性,则结果判为阳性;两条探针中有一条为阳性,则结果判为可疑;两条探针均为阴性,则结果判为阴性。此过程保证了该方法检测结果的可靠性。使用寡聚多胸腺嘧啶(dC)加尾,并用紫外交联、高温烘烤方式使探针牢固的固定于硝酸纤维膜上,确保了该检测方法的稳定性。经过杂交条件优化,确定了当探针均修饰15C,浓度为50 μmol/L;杂交温度为45℃,杂交时间为1 h;抗体的浓度为1∶2000,孵育时间为1 h时杂交信号最好,且无非特异性信号出现。通过对79例实验动物进行检测,并与ELISA、IFA进行比较,检测结果一致率分别为100%和92.4%,RDB与ELISA阳性检出率均为7.59%(6/79),而IFA阳性检测率为0%(0/79)。
本实验使用了线性试剂条,可用阅读卡进行判读,相比于其他斑点杂交实验,其实验结果更为简洁、清晰[11,12]。并且,建立的 RDB 克服了 ELISA、IFA血清学检测方法成本高、不利于各单位小样本自检等缺点。将PCR扩增与反向斑点杂交相结合,并设计两条通用探针,弥补了PCR扩增的假阳性的不足。检测结果简洁直观、可靠稳定,可用于实验动物泰泽病原体的检测。
综上,本实验所建立的反向斑点杂交检测方法用于检测泰泽病原体,具有简洁、灵敏、特异、准确等优点,便于基层单位推广应用。同时,为探索实验动物其他病原微生物的RDB方法的建立提供理论依据。
[1]Fujiwara K.Tyzzer's disease[J].Jap J Exp Med,1978,48:467-480.
[2]姚菊芳.某实验动物科技机构人员泰泽病原体感染血清学的调查[J].上海实验动物科学,1999,19(4):218.
[3]Smith KJ,Skelton HG,Hilyard EJ.Bacillus piliformisinfection in a patient infected with HIV-1:confirmation with 16s ribosomal RNA sequence analysis[J].J Am Acad Dermatol,1996,34:343-348.
[4]Fujiwara K,Takagaki Y,Naiki M,et al.Tyzzer's disease in mice:effects of corticosteroids on the formation of liver lesions and the level of blood transaminases in experimentally infected animals[J].Jpn J Exp Med,1964,34:559-575.
[5]高正琴,邢进,王春玲,等.实验大鼠泰泽菌检测方法的比较研究[J].中国实验动物学报,2004.12(3):142-146.
[6]Wilson KH,Blitchinqton RB,Greene RC.Amplification of bacterial 16S ribosomal DNA with polymerase chain reaction [J].J Clin Microbiol,1990,28:1942-1946.
[7]Goto K,Itoh T.Detection ofBacillus piliformisby specific amplification of ribosomal sequences[J].Exp Anim,1994,43(3):389-394.
[8]赖国旗,何明忠,谭毅,等.小鼠肝炎病毒RT-PCR检测方法的研究[J].西南农业大学学报(自然科学版),2004,26(6):762-764.
[9]魏立雯,韦莉,张文露,等.反向线性探针杂交在检测试验动物沙门菌中的研究[J].四川动物,2013,32(2):195-198.
[10]韦莉,魏立雯,赖国旗,等.金黄色葡萄球菌反向线性杂交探针检测方法的建立[J].中国实验动物学报,2012,20(6):85-88.
[11]樊慧珍,于化鹏,黄少杰.反向斑点杂交快速检测肺炎支原体[J].实用医学杂志,2005,21(21):2349-2351.
[12]赖国旗,张文露,胡源,等.反向线性探针杂交技术检测慢性乙型肝炎病毒拉米夫定耐药研究[J].西南师范大学学报(自然科学版),2012,37(3):113-119.
[13]赵丽,张文露,胡源,等.反向斑点杂交法快速检测HBV基因型反应条件的优化和建立[J].中国生物工程杂志,2009,29(12):85-89.
[14]田永强,朱中元,王海波.人乳头瘤病毒线性杂交分型技术的建立及评价[J].中国实验诊断学,2010,14(3):389-392.

