影像引导放疗中交互式肿瘤靶区勾画方法
周 武 谢耀钦 田洋洋
(中国科学院深圳先进技术研究院深圳518055)
影像引导放疗中交互式肿瘤靶区勾画方法
周 武 谢耀钦 田洋洋
(中国科学院深圳先进技术研究院深圳518055)
在图像引导放射治疗中肿瘤(靶区)和危险器官的勾画是制定放疗计划的重要环节。在临床应用中靶区勾画通常是由医生手动完成,虽然这种方法普遍被认为可靠,但是耗时较多且精度受医生主观影响较大。由于临床上人体组织结构的多样性和靶区目标影像的复杂性,自动勾画方法在精度和可靠性上并不能较好的满足实际临床需求。文章提出了一种交互式轮廓勾画的方法,结合自动的活动轮廓模型和手动交互的多尺度曲线编辑方法实现靶区的快速精确勾画。通过初始化轮廓调整使活动轮廓模型快速可靠地达到目标轮廓,然后使用多尺度数字曲线编辑可实现对复杂形状轮廓的快速修正。医学临床实验结果验证了方法的有效性。
轮廓勾画,活动轮廓模型,曲线编辑,放疗计划,影像引导放疗
1 引 言
影像引导放射治疗(Image Guided Radiation Therapy, IGRT)是一种四维的放射治疗技术,它在三维放疗技术的基础上加入了时间因数的概念,充分考虑解剖组织在治疗过程中的运动和分次治疗间的位移误差,如呼吸和蠕动运动、日常摆位误差、靶区收缩等引起放疗剂量分布变化和影响治疗计划等方面的情况。在患者进行治疗前和治疗中利用各种先进的影像设备对肿瘤及正常器官进行实时监控,并能根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,使之能做到真正意义上的精确治疗[1]。在肿瘤放射治疗的图像处理和分析中,快速准确地勾画出一些感兴趣区对于患者的图像分析、准确治疗以及减少临床医生工作量有着极大的帮助[2]。
临床上,靶区的勾画通常由医生在体数据中一层层手动完成[3]。手动分割过程比较精确,但勾画过程给医生负担较重,精度受医生主观影响较大。近年来,大量的计算机辅助勾画方法不断被应用于医学临床,这些方法中既有半自动也有全自动的[4]。半自动的勾画方法主要是分割过程加入用户的输入信息,使靶区勾画在用户的控制下进行,主要运用于基于阈值法[5]、区域增长[6]、变形模板[7,8]等。全自动方法在靶区勾画中无需任何用户的输入,主要依据分割的先验知识。比较经典的自动分割方法是基于标记集的分割方法和基于统计形状模型的分割方法。尽管自动和半自动方法均在医学图像分割中被广泛应用,但仍然很难满足医学临床的精度和效率的要求。主要原因是临床医学影像的灰度分布不均匀、对比度较低及噪声较大,另外靶区目标的边缘可能模糊和部分缺失[3]。这些因素使得传统的基于阈值和灰度区域增长等半自动方法很难获得精确稳定的靶区轮廓,而活动轮廓模型对于模糊边缘和形状较复杂的靶区轮廓很难获得精确的定位。
本文提出了一种交互式目标轮廓的勾画方法。结合自动的活动轮廓模型和手动交互的多尺度曲线编辑方法实现靶区的快速精确勾画。首先,用户在医学影像中手工画出包含有感兴趣区域的轮廓。由于该手动勾画与真实轮廓位置之间一般包含较大的偏差,通过活动轮廓模型使手动勾画轮廓演化到真实轮廓。
2 方 法
2.1 方法流程
研究目的是在临床应用中简单快速地实现靶区的轮廓勾画。我们结合传统的活动轮廓模型和数字曲线,设计一种结合手动和自动的交互式靶区勾画方法。轮廓勾画方法的流程图如图1所示,该方法主要包括三个步骤:首先是手动初始化,用户通过按住鼠标左键实现感兴趣区域的选择,手动选择并移动自动生成的控制点,改变初始勾画轮廓的位置。其次是通过活动轮廓模型使初始化曲线自动演化。最后通过鼠标拖拽多尺度间距的控制点手动修改轮廓。该方法结合了自动勾画和手动勾画的优点。一方面,手动勾画结果采用数字曲线表征和控制点位置调整,可以快速方便地实现轮廓勾画。将临床医生的宝贵经验融入手动调整过程。同时,自动轮廓模型的设计使手动生成的轮廓更加精确,克服了手动分割时主观因素引起的偏差。
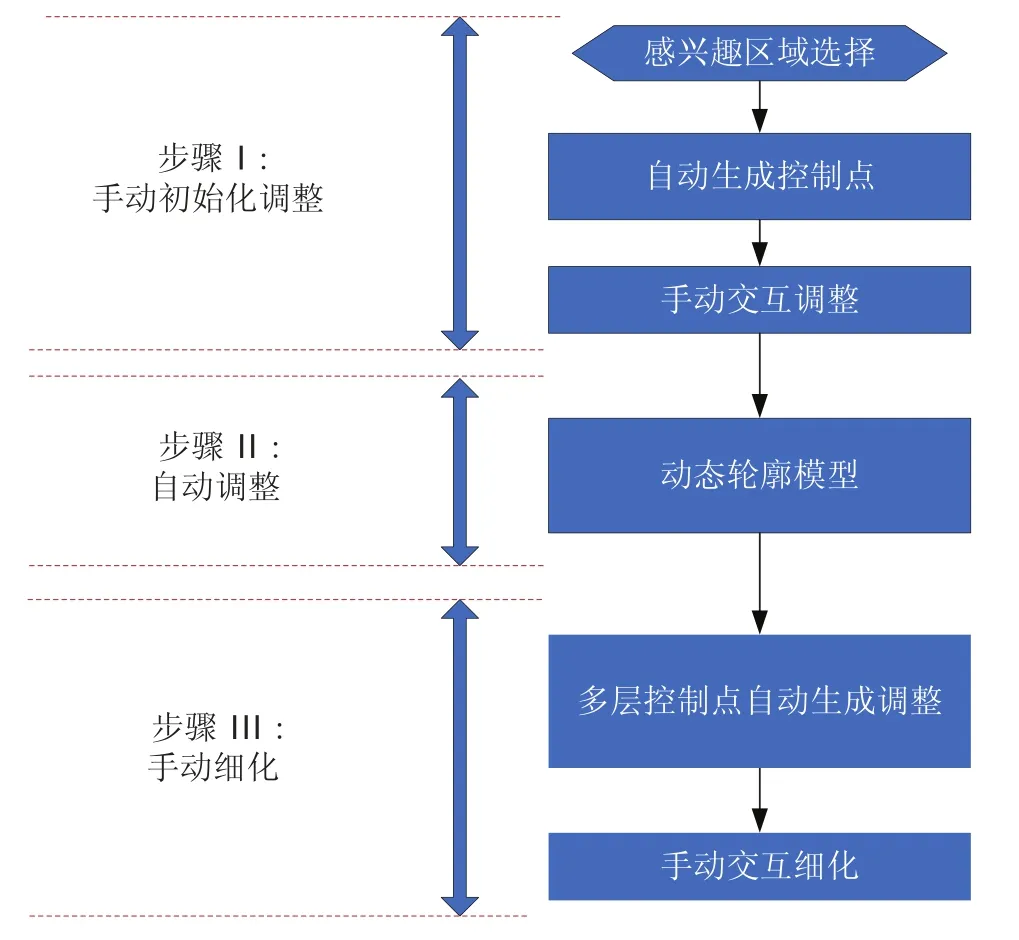
图1 轮廓勾画方法流程图Fig.1. The framework of the proposed contour delineation algorithm
一般情况下,活动轮廓模型在图像的边缘较清晰且对比度较高时,可以获得较精确的结果。由于医学影像的灰度分布不均、对比度较低且图像噪声较大,自动的活动轮廓模型往往包含一些偏差。特别是在靶区边缘较模糊或边缘缺失时,活动轮廓模型很难获得令人满意的勾画结果。因此,在临床应用中,最后阶段的手动编辑是非常必要的。此外,活动轮廓模型的初始轮廓需要靠近真实的目标轮廓,一旦初始轮廓距离真实轮廓较远,活动轮廓模型将很难稳定地收敛于真实轮廓,而且耗费时间较多。本文方法可以大大提高活动轮廓模型在临床应用中的性能。一方面,手动初始化和调整的过程可以为活动轮廓模型产生尽可能接近真实边界的初始轮廓。如果初始轮廓接近实际轮廓,那么活动轮廓模型的轮廓演化收敛更快,且更可靠。另外,手动细化过程可以改进活动轮廓模型的结果,在复杂的医学影像中减少靶区勾画的偏差。
2.2 数字曲线生成和调整
曲线拟合方法是通过对控制点集拟合生成参数曲线,利用参数曲线描绘一个区域轮廓。因此,通过改变控制点集的空间位置可调整参数曲线的形状。靶区勾画中,在手动勾画的初始化轮廓上自动产生一些控制点集合,然后手动调整控制点的位置使参数曲线和靶区的真实轮廓重合,这样就达到了手动调整的目的。在众多的曲线拟合方法中,选择了三次Hermite插值方法[9],因为这种方法计算简单、曲线平滑。假定向量P0和P1分别表示曲线的起点和终点,向量u0和u1表示曲线离开起点和终点的切线,则四个Hermite基函数如下:
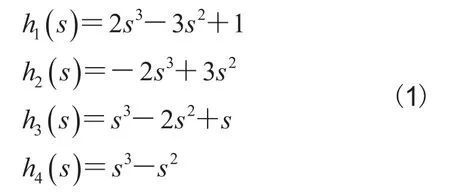
上述四个向量P0,P1,u0与u1和上述四个Hermite基函数相乘后相加,就得到了Hermite曲线的一般形式:
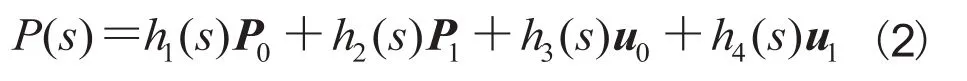
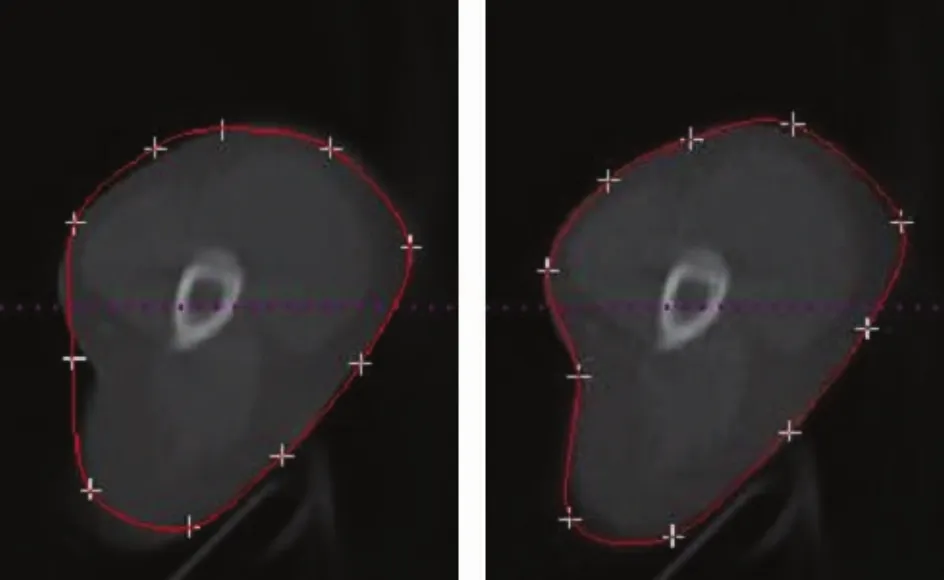
图2 临床影像的初始轮廓和手动调整后轮廓Fig.2. Initial drawing and interactive calibration results for clinical CT images
2.3 活动轮廓模型
活动轮廓模型已被广泛应用于医学影像的边缘检测和分割。该模型被定义为能量最小化的样条曲线,能量取决于轮廓形状和在图像内的位置。轮廓的形状被内力和外力控制,外力引导图像中轮廓模型的特征,而内力为轮廓模型平滑的约束力。假定向量作为轮廓模型的参数曲线,参数s从0到1变化,那么活动轮廓模型的能量函数定义如下:
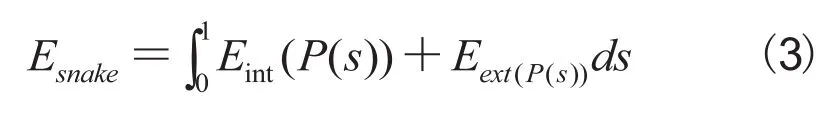
其中,Eint是迫使活动轮廓曲线短小而光滑的内部能量,Eext是使活动轮廓在图像中趋近对象边缘的外部能量。普遍的外部能量采用梯度值的逆度量,即边缘的位置能量较低,而高能量在边缘以外的区域。这里的目的是找到这样轮廓曲线P(s),使活动轮廓模型的总能量最小化。该内部能量被定义为:
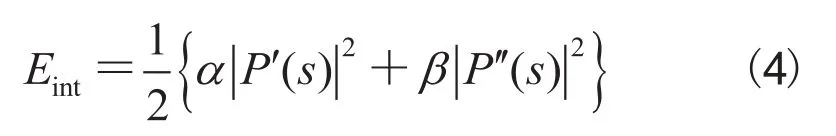
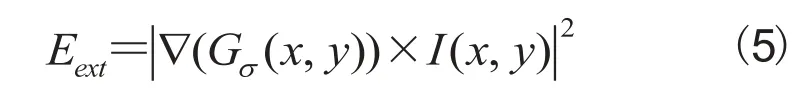
为了最小化能量函数,我们使用Euler-Lagrange方程:采用梯度下降法求解上述方程。将活动轮廓转换成关于时间 t 的函数,并且用P对时间的偏导数替换公式(6)中右式的0:
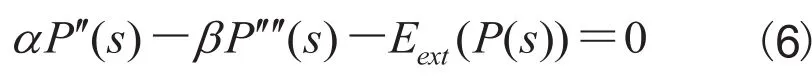
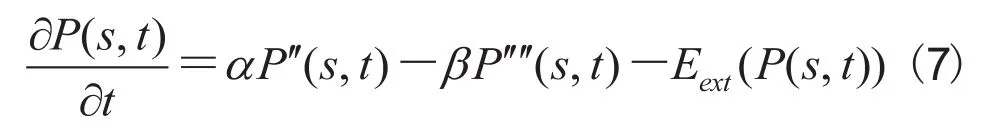
当轮廓模型收敛至最小值时,上述方程的解P(s,t)将稳定,它对时间的导数将为零,因此可以得到上述Euler-Lagrange方程的解。
一般情况下,活动轮廓模型要求初始轮廓尽可能地接近真实的轮廓边缘。如果活动轮廓模型的初始轮廓距离目标边界较远,上述轮廓演化可能无法收敛到目标边界。图3显示了在不同的初始轮廓下活动轮廓模型的演化结果。需要注意的是,图3(b)中的初始轮廓是通过移动图3(a)的初始轮廓控制点产生的,因此如果初始轮廓偏离实际轮廓远离,结果会变得较差。因此,在临床应用中,手动修改初始化初始轮廓使其尽可能地接近实际轮廓是必要的。如果初始轮廓靠近实际轮廓,轮廓演化消耗的时间将被大大降低。此外,医学影像中尖锐的边缘被活动轮廓模型的内部能量计算而平滑,因而临床医疗图像中活动轮廓模型的最终结果通常包含错误。
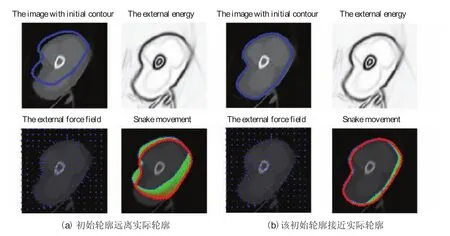
图3 不同初始轮廓的活动轮廓模型演化结果Fig.3. The results of the snake model with different initial contour
图4显示了活动轮廓模型在较好的初始轮廓和最佳参数时的演化结果,其中,红色显示所获得的轮廓,绿色圆圈中包含的轮廓错误是由于高曲率的边缘和模糊的边界引起的。我们在试验中发现,在靶区边缘模糊或部分缺失时,活动轮廓模型的靶区勾画错误很常见。
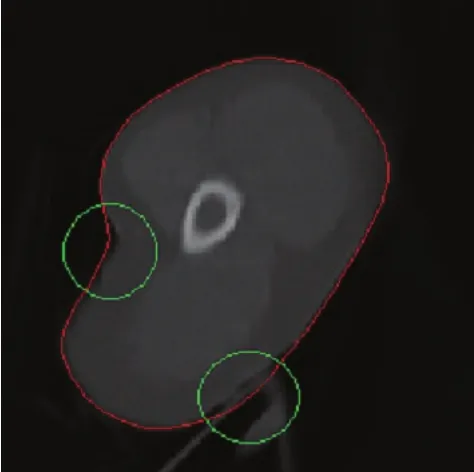
图4 活动轮廓模型的演化结果Fig.4. The result of the snake model
2.4 多尺度曲线修正
由于在临床应用中活动轮廓模型的靶区勾画普遍存在偏差,手动编辑修正这些边界错误非常必要。一般情况下,从活动轮廓模型中得到的边界大部分是正确的,少部分由于边缘模糊或缺失会包含错误。手动编辑应该只修改在有限区域的边界错误而保持其他勾画正确的边界地区不变。因此,手动编辑是局部控制过程,对一个边界区域操作不影响其他的边界区域。此外,靶区轮廓形状可能很复杂,固定数量控制点的拟合曲线可能无法较好地表征复杂形状的靶区轮廓。为此,我们设计了一个分层的多尺度方法用于修改的控制点,通过控制点的增加提高拟合数字曲线的伸缩性,从而更好地表征复杂靶区轮廓。图5显示了分层多尺度方法生成的控制点。在第一层,活动轮廓模型得到的轮廓只生成13个控制点。由于边界的形状复杂,第一层的13个点不能较好的描绘目标轮廓。图5(a)中Hermite插值曲线(蓝色)和活动轮廓(红色)在尖锐区域的拟合不一致,蓝色的拟合曲线与实际边缘偏差也较大。在靶区边缘形状不复杂的情况下,很少的控制点就足够描绘它们结构特征。因此,手动编辑很少的控制点就足够产生满意的修正结果。然而,人体组织解剖结构是复杂的,较少的控制点拟合的数字曲线有时很难精确表征结构轮廓,因此,有时需要产生大量控制点用于手动编辑。如图5(c)和(d)所示,在较多的控制点情况下,Hermite插值曲线(蓝色)和活动轮廓(红色)很吻合。
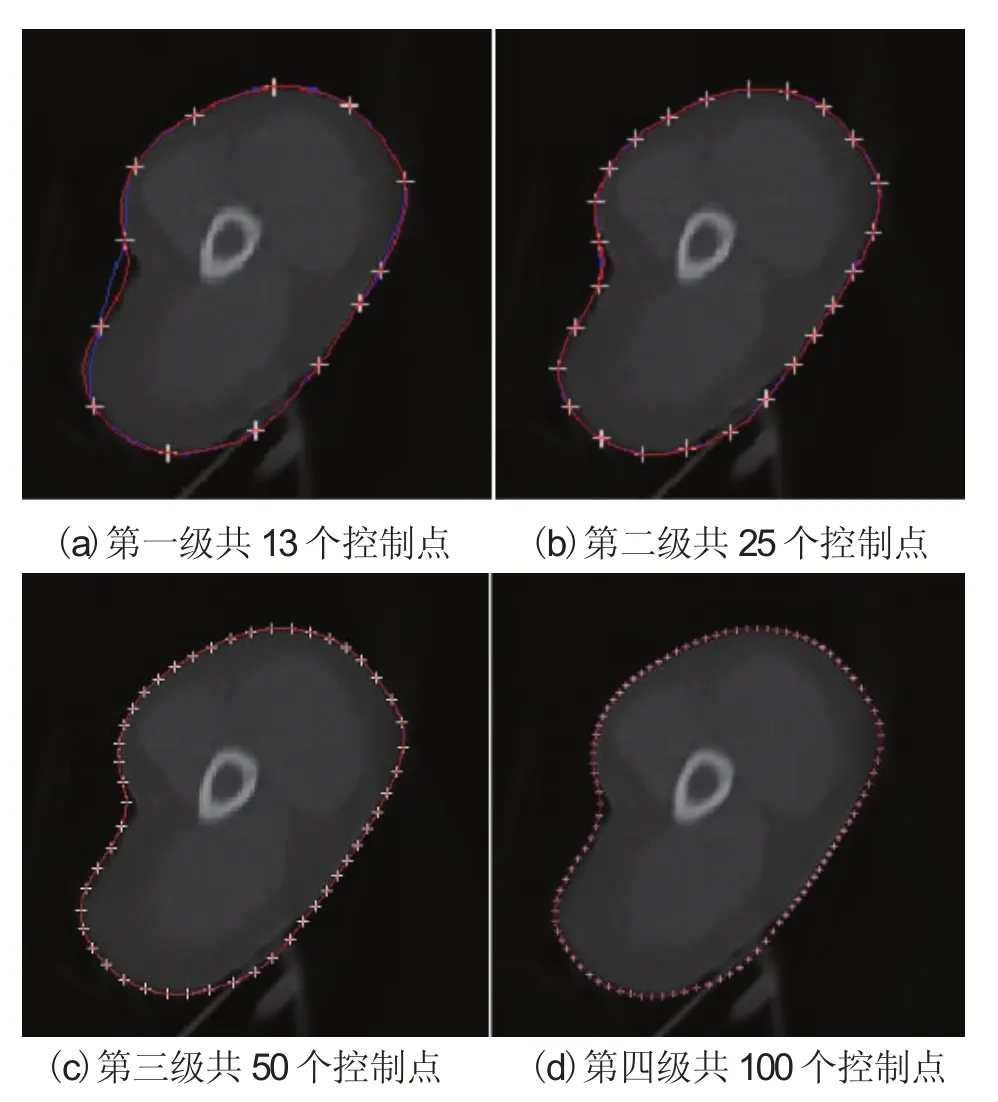
图5 分层的多尺度方法生成均匀分布的控制点Fig.5. A hierarchical multiscale approach to generate uniformly spaced control points for manual editing
图6显示了用手动编辑改进的活动轮廓模型轮廓的结果,它清晰地显示了通过操纵几个相关控制点而获得令人满意的最终轮廓。其中,红色曲线为活动轮廓模型产生的原始轮廓,红色十字为产生的控制点。绿线为手动编辑后产生的最终轮廓,白色十字为经过修正的相关控制点。其它不必修正的控制点则一致显示为白色。图 6(a)显示了为改进活动轮廓模型产生的轮廓,在第三级修改了6个相关控制点位置。图6(b)显示了在第四级中修改了12个相关控制点位置。一般来说,手动编辑越多的控制点将会使轮廓的勾画越精细,使修正的曲线越接近真实轮廓。然而,对于使用者而言,修正大量控制点既耗时又容易产生疲惫感。一般第三层产生的控制点已适合手工编辑,而对一些相关控制点的手工修改可以改善活动轮廓模型的轮廓。如果临床医生想通过手动编辑生成更精确的边界,可以修正更多相关控制点产生尖锐轮廓,那么选择第四层的控制点会更好。
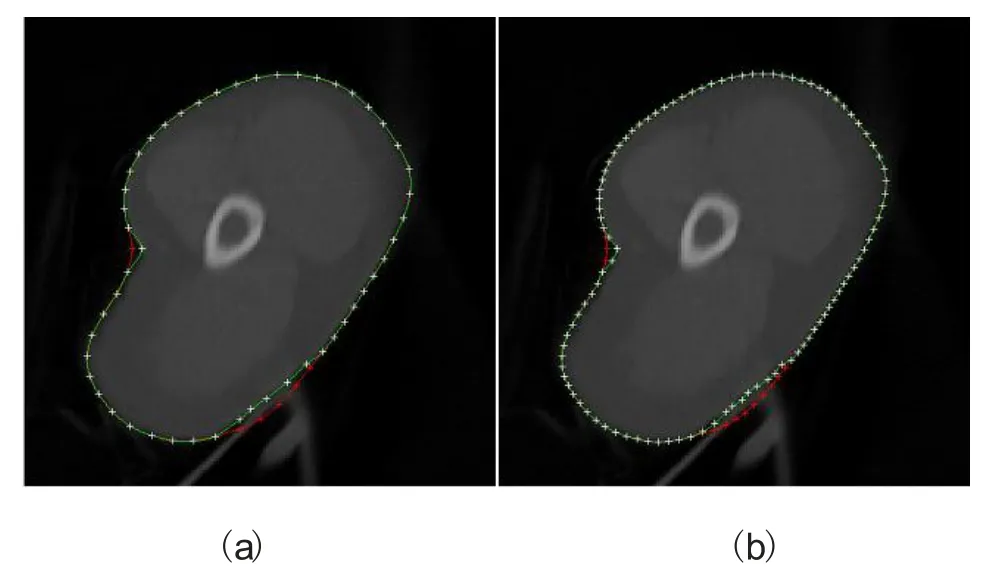
图6 手动编辑结果Fig.6. Manual editing
多层控制点生成的优点是兼顾控制点调整的效率和轮廓勾画的准确性。因此,我们根据区域边界的长度设计了一个分层生成控制点的策略。如果活动轮廓模型的演化轮廓出现较大的偏差时就自动生成间距较大的控制点网格,且控制点的数量相对较少,一个控制点位置的改变将影响较大区域的曲线轮廓。为了进一步细化结果,控制点网格要逐步细化。在这种情况下,第i层控制点网格插入新的控制点,建立i+1层细化控制点网格,则每一步控制点间距减半,控制点数量加倍,而相应控制点对周围轮廓区域的影像面积也减小。随着在不同层控制点的修正,将会生成与实际轮廓一致的最终轮廓,这个修正过程直至观察到满意的结果为止。很明显通过逐步细化可以表达复杂的形状,这使得通过用更多的控制点修正小的轮廓以保证其准确性成为可能。同时,也可以用相对较少的控制点修正大的轮廓,而且这个过程是高效和快速的。
3 结 果
为了验证方法的有效性和稳健性,我们使用了各种临床医学图像,如:CT图像、MRI图像和超声图像对方法进行测试。在实验中分别详细显示初始轮廓、活动轮廓和手动修正的靶区勾画结果。在医学图像分割中,由于医学组织结构的复杂性和很难获得真实的靶区轮廓作为标准,严格意义上的量化结果很难获得。因此,在文中给出了定性的对比分割结果。
影像测试数据来源于临床医学,图7(a)为增强型CT肝脏扫描图像[10],图7(b)为心脏左心室MRI图像[11]。图7(c)为一个年轻的男性前列腺超声图像[12],图中箭头指向的囊性结构(箭头)代表前列腺囊肿。由于超声图像的分辨率和对比度较低,而且图像质量受到斑点噪声影响较大,无论是手动分割还是自动分割方法的轮廓都包含较大的分割错误。
图8中显示了本文方法的分割结果,从视觉上看,最终轮廓较好地表征了靶区轮廓。虽然如图9所示活动轮廓模型可以得到非常平滑的轮廓,但往往偏离真实的边界。其原因是:在尖锐的边缘部分活动轮廓模型的内部能量使高曲率变得平滑,使演化后的轮廓无法精细定位于真实边缘轮廓。例如,在图7(a)所示的CT图像中,目标边界对比度较低,活动轮廓模型的结果中包含较大的偏差。本文方法在精细调整后,可以观察到最终轮廓并没有明显的错误。对控制点的手动编辑可以大量减少活动轮廓模型边界错误,这个过程可以通过修正几个相关控制点实现。
本文所描述的靶区勾画方法已被用于二维临床医学影像。操作过程包括手动初始化轮廓勾画,活动轮廓模型演化和交互式手动编辑。512×512像素的二维医学影像轮廓勾画可能需要几秒钟,其中一次Hermite插值拟合需要的时间不超过0.02秒。如果初始轮廓远离实际轮廓,活动轮廓模型需要耗费大量的时间。然而,所提出的手动初始化方法使初始轮廓接近实际轮廓。因此,如表1所示,活动轮廓模型只需要1~2秒即可完成临床图像的轮廓演化。活动轮廓模型的迭代参数最大限度是50。活动轮廓模型耗费的时间和得到的初始轮廓接近实际边界是值得的注意的,因为初始轮廓收敛到实际轮廓演化需要最少的次数,所以轮廓时间消耗最低。
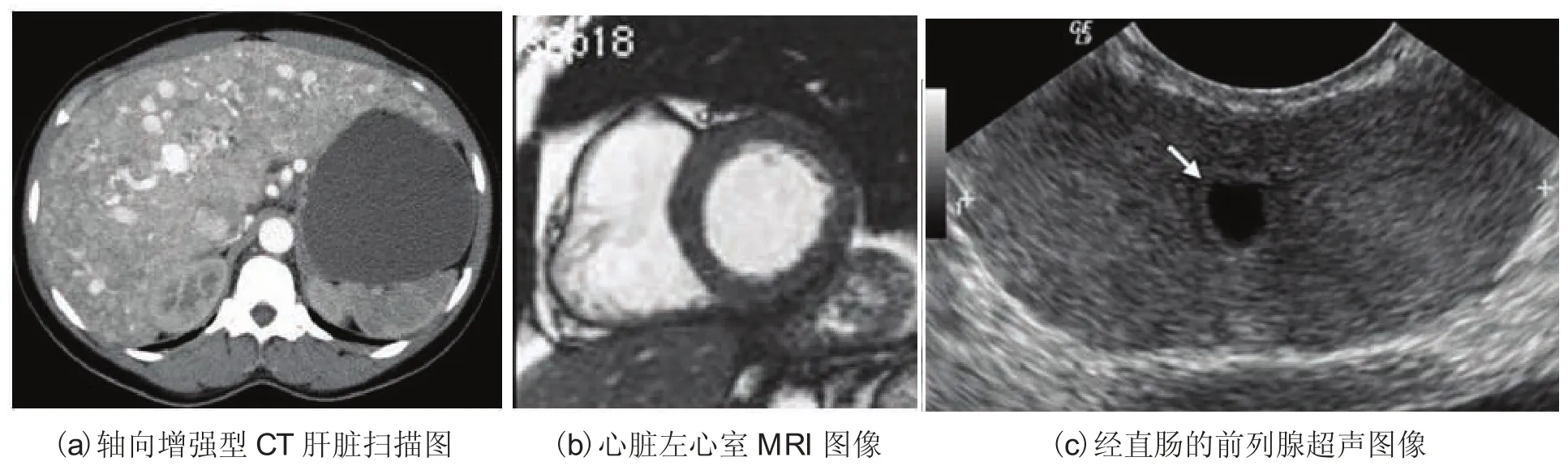
图7 IGRT治疗计划中的临床医疗影像Fig.7. Clinical medical images in treatment planning in IGRT
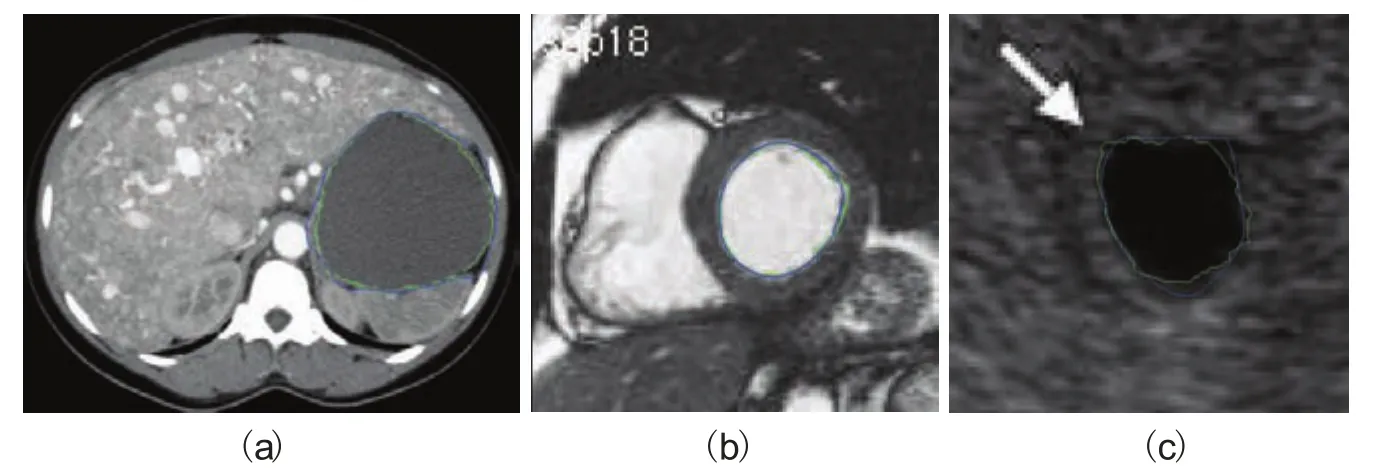
图8 轮廓修订(蓝色为活动轮廓模型所产生的轮廓,绿色为手动编辑后的最终轮廓)Fig.8. Contour delineation by the proposed method(blue shows the contour generated by the snake model and green shows the fi nal contour after manual editing)
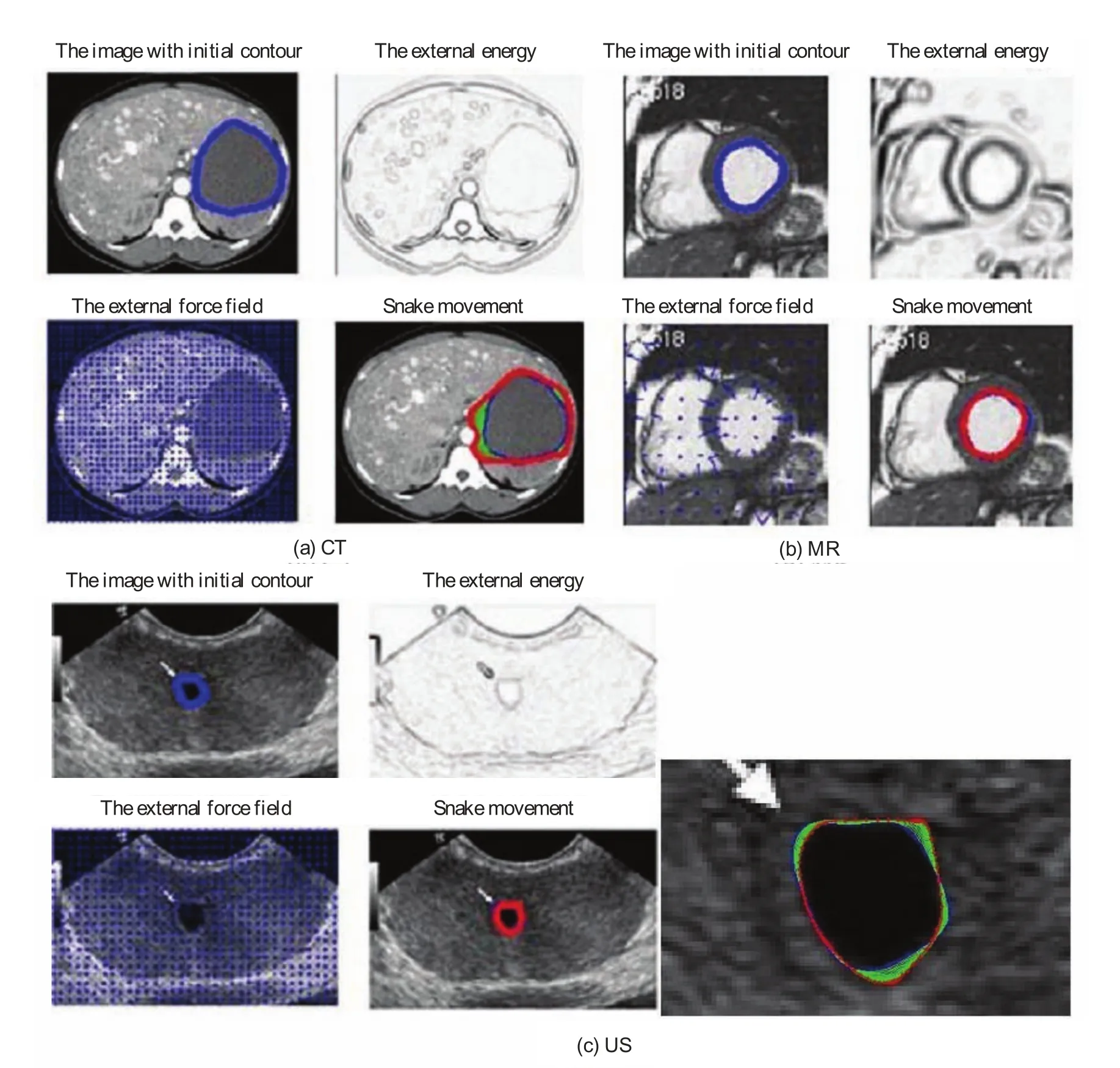
图9 基于活动轮廓模型的CT,MR,US勾画轮廓图像(蓝色为初始轮廓,红色为活动轮廓模型演化产生的最终轮廓)Fig.9. Contour delineation by basic snake model for CT, MR, US images with optimal parameters(blue shows the initial contour and red shows the fi nal contour generated by the snake model)
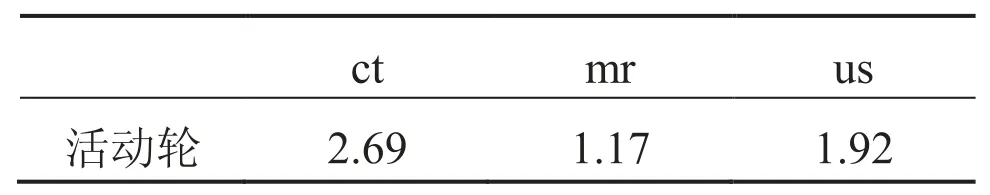
表1 初始轮廓接近真实轮廓时活动轮廓模型演化耗费时间(/s)Table1. The time consuming of the snake model with initial contours which are close to the actual boundary (/s)
4 结 论
本文提出了一种新的交互式靶区轮廓勾画方法,通过使用活动轮廓模型和多尺度曲线编辑可获取满意的靶区目标轮廓。所提出的技术在临床应用中允许用户通过简单的鼠标操作迅速修正轮廓,并且克服了临床应用中活动轮廓模型的弊端。实验结果显示了该方法在临床应用中靶区勾画的有效性。
[1] Peters TM, Cleary KR. Image-guided Interventions: Technology and Applications [M]. Berlin: Springer, 2008.
[2] Xing L, Thorndyke B, Schreibmannetal E, et al. Overview of image-guided radiation therapy [J]. Medical Dosimetry, 2006, 31(2): 91-112.
[3] Zhao F, Xie X. An overview of interactive medical image segmentation [Z]. Annals of the British Machine Vision Association, 2013, 7: 1-22.
[4] Batchelor PG, Edwards PJ, King AP. 3D Imaging, Analysis and Applications [M]. London: Springer-Verlag, 2012.
[5] Gonzalez RC, Woods RE. Digital Image Processing [M]. Prentice Hall, 2008
[6] Pohle R, Toennies KD. Segmentation of medical images using adaptive regions growing [C] // Proceedings of SPIE Medical Imaging 2001: Image Processing, 2001: 1337-1346.
[7] McInerney T, Terzopoulos D. Deformable models in medical image analysis: a survey [J]. Medical Image Analysis, 1996, 1(2): 91-108.
[8] Kass M, Witkin A, Terzopoulos D. Snakes-active contour models [J]. International Journal of Computer Vision, 1987, 1(4): 321-331.
[9] Mortenson M. Geometric Modeling (3 edition) [M]. Industrial Press, 2007.
[10] Learning Radiology [OL]. http://www.learningradiology.com.
[11] Leids Universitair Medisch Centrum [OL]. https:// www.lumc.nl/con.
[12] Technical Advances in Interventional Radiology [OL]. http://www.mghradrounds.org.
Interactive Target Delineation in Clinical Treatment Planning of Image Guided Radiation Therapy
ZHOU Wu XIE Yaoqin TIAN Yangyang
( Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China )
The accurate contour delineation of the target and organs at risk (OAR) is essential in treatment planning for image guided radiation therapy. In clinical applications, the contour delineation is often done manually by clinicians, which may be accurate, but time-consuming and tedious for users. Although a lot of automatic contour delineation approaches have been proposed, few of them can fulf i ll the necessities of applications in terms of accuracy and eff i ciency. In this work, a novel approach of target delineation was proposed. Target delineation of OARs was achieved by using snake model and multiscale curve editing to obtain promising results. It allows users to quickly improve contours by a simple mouse click. Experimental results demonstrate the effectiveness of the proposed method for clinical target delineations.
contour delineation; snake; curve editing; treatment planning; image guided radiation therapy
TP 391
A
2013-11-20
中国博士后科学基金(2013M530740),国家自然科学基金(81171402),国家自然科学基金海外研究基金,港澳合作研究基金(30928030),国家重点基础研究发展计划973(2010CB732606),广东省创新团队项目(2011S013)。
周武,博士后,研究方向为医学影像分析和图像配准;谢耀钦(通讯作者),研究员,研究方向为医学物理和弹性配准,E-mail:yq.xie@siat.ac.cn;田洋洋,硕士研究生,研究方向为医学影像分析。

