生物浸出过程影响因素与环境参数的数学模型
陈 朋 , 李红玉, 晏 磊, 王宁波
(1.甘肃省商业科技研究所,甘肃 兰州 730010;2.兰州大学 药学院,甘肃 兰州 730020;3.黑龙江八一农垦大学,黑龙江 大庆 163319)
生物浸出过程影响因素与环境参数的数学模型
陈 朋1, 2, 李红玉2, 晏 磊3, 王宁波1
(1.甘肃省商业科技研究所,甘肃 兰州 730010;2.兰州大学 药学院,甘肃 兰州 730020;3.黑龙江八一农垦大学,黑龙江 大庆 163319)
生物浸矿是贫矿采集的有效方法之一,对不可再生资源的高效利用有着深远的意义。围绕生物浸出过程的影响因素和环境参数有很多的研究报道,但是系统化的对生物浸出过程的影响因素与环境参数及其数学模型鲜有归纳总结。详述生物浸出的影响因素与环境参数,在浸出机理的基础上论述了影响因素与环境参数的数学模型,并对采矿生产的可预测性、可控制性和最优化设计提出展望。
浸矿微生物;生物浸出;影响因素;环境参数;数学模型
1 生物浸出的影响因素与环境参数
生物浸出环境中的生理生化参数有温度、pH值、氧化还原电位、三价铁离子浓度、光、压力等。生物浸出环境中微生物学参数包括:微生物多样性、菌密度、金属耐受性、微生物的适应性等。浸出矿物的属性有矿物类型、组成、颗粒大小、亲水性、矿浆密度等。表1中列出了大量的浸出环境参数,本文针对其中较为重要参数进行阐述。
1.1浸矿微生物的多样性
目前已用于浸矿的微生物有多种,分属自养菌、异养菌和兼性菌。这些细菌生长在普通微生物所不能生存的酸性水体中,摄取空气中的二氧化碳、氧和水中的其他微量元素,用以合成细胞组织,在促进矿石中硫、铁等成分的氧化作用的同时,获得新陈代谢的能量,自养自生。表2列出了生物浸出环境及酸性矿水中的生物多样性,将不同的浸矿微生物分为古生菌、细菌、真核微生物、真菌、酵母、藻类等。嗜酸性古生菌最适pH一般都在3.0以下,还有一些古生菌是极端嗜热菌,最高耐受温度高达85 ℃;多数浸矿细菌的最适pH在 3.0~5.0之间,也有一些中性菌株是高于pH 7.0,生长温度多数为37 ℃左右;而真菌、酵母均属于异养菌,生长温度都在30 ℃左右。在这些浸矿微生物中目前应用最广泛的是A.ferrooxidans和A.thiooxidans。其中A.ferrooxidans具有广泛的代谢途径,它可氧化铁、硫和硫化矿,对多种金属与非金属具有天然的抗性和清除能力[1],因此也是目前研究最为清楚,应用最为广泛的浸矿微生物之一[2]。
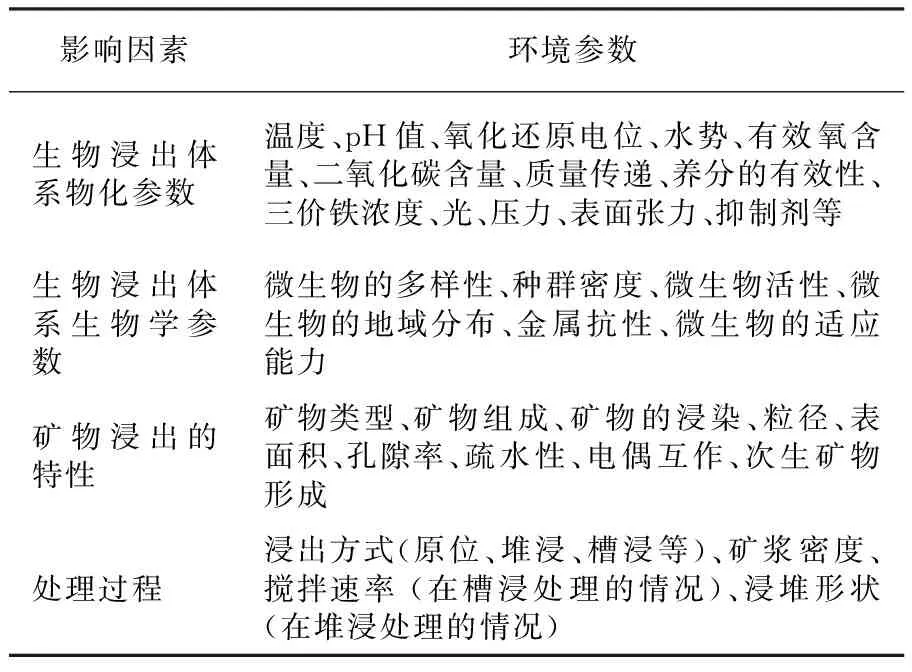
表1 细菌对矿物氧化和金属浸出的影响因素与环境参数Table 1 Factors and parameters influencing bacterial mineral oxidation and metal mobilization

表2 生物浸出环境和酸性矿水中的微生物多样性
1.2温度对生物浸矿的影响
大多数A.ferrooxidans菌株都属于常温微生物,生长温度为15~37 ℃之间,最适为30 ℃左右[3]。Wiertz等研究了在30和70 ℃时黄铁矿的氧化速率,认为70 ℃时Sulfolobusmetallicas对黄铁矿的氧化速率要比30 ℃时A.ferrooxidans对黄铁矿的氧化速率高出5倍[4]。过高的浸出温度也会减少Fe3+转化为黄钾铁矾沉淀,而黄钾铁矾沉淀会造成硫化物表面钝化,使得矿物浸出过程受阻[5]。因此,高温对矿物的溶解有一定的促进,但是高于菌株生理生化的最适温度的范围,就会对浸出过程产生不同的抑制作用。
1.3pH对生物浸矿的影响
A.ferrooxidans是1株严格嗜酸菌。对于pH而言,通常认为A.ferrooxidans在pH 1.5~6.0范围内生长和代谢,最适pH约为2.0,根据不同的菌株组成和实验条件有所不同[6]。研究表明在pH值大于3.0时,浸矿微生物对矿物浸出过程缓慢,受抑制的原因与铁离子沉淀的形成相关,铁离子沉淀的形成会阻碍矿物表面的生物浸出反应[7]。
1.4生物量对生物浸矿的影响
大多数研究报道显示生物量与生物浸出离子浓度成正比,即在较高的初始生物量下,其金属浸出的浓度会随着菌株数量的增多而增多,但浸出后期可能会有所不同[8-9]。
1.5亚铁离子对生物浸矿的影响
虽然亚铁离子对于生物浸出具有非常重要作用,但是过高浓度的铁离子会抑制细菌的生理生化活性,阻止矿物的进一步氧化[10]。研究表明,随着初始亚铁离子浓度的升高,伴随着Fe3+的浓度升高,将导致金属浸出率的下降[11],其原因是Fe3+或Fe3+复合物(如针铁矿、磁铁矿或者黄钾铁矾)对某些浸出金属离子的吸收造成的,它们显示出了极高的金属移除能力[12-13]。
另外,在生物浸出硫化矿过程中,亚铁离子与硫作为A.ferrooxidans菌株的2种重要的能源物质,在生物浸出过程发挥着关键的作用。A.ferrooxidans在亚铁离子与元素硫存在时对雄黄的生物浸出中能源的利用[2]。在存在不同能源(亚铁离子与元素硫)的条件下,细菌利用何种能源以增强浸出能力是值得研究的问题[14]。
1.6矿浆密度对生物浸矿的影响
Abhilash等[15]研究指出金属溶解的效率会受到浸出体系中矿浆密度的极大影响。这可能是由于矿浆密度的增加形成了一个高毒性环境,抑制了浸矿菌株的生理活性,同时矿浆密度增高使得剪切力下降,降低了物质传递[16]。因此,作为浸出实验的作用基质,合理的矿浆密度显得非常重要,它不但可以在适宜菌株抗性的合理范围使菌株发挥其生理活性,同时也能增加生物浸出效率。
2 生物浸出机制的数学模型
从上述影响因素与环境参数的论述可以看出,生物浸出是一个复杂的理化过程,到目前为止已普遍形成共识的3种主要机理分别是[17-18]:①细菌浸出的直接作用机理:细菌在其菌毛、胞外多聚物(EPS)、表面黏液或矿物附着力的作用下,附着在矿石表面。细胞膜中的酶催化氧化降低矿石活化能,破坏矿物晶格,矿石发生氧化作用的同时使矿石中金属溶解浸出;②细菌浸出的间接作用机理:在有不溶性矿物存在时,细菌通过新陈代谢作用,产生硫酸或硫酸铁等代谢产物,破坏矿石晶格,把矿石中的金属转化成可溶性的盐类从而使金属浸出。无论是细菌的直接作用还是间接作用,最终的电子受体都是氧,而细菌只起催化作用;③细菌浸出的协同作用机理:在生物浸出不同时期存在以上2种机理作用,浸矿初期细菌直接作用高于间接作用的氧化速度常数,此时细菌直接作用起主导作用。随着氧化剂的生成,破坏矿物晶格的速度加快,逐步间接作用起了主导作用,细菌直接氧化作用下降。在实际的浸矿过程中常常是第3种机制在发挥作用[19]。由于生物浸矿的机理不同,使得浸矿过程的影响因素与环境参数也不相同,分析浸出数据拟合不同机理下对应的数学模型,对分析浸矿机理,优化浸矿过程有着至关重要的意义,所以生物浸出的数学模型对于不同的浸出工艺优化尤为重要。
从上述的生物浸出过程的主要机理分析可以看出,生物浸出的实质依然是基于化学反应的实验过程,主要是浸矿微生物氧化作用之后的化学反应过程。动力学研究生物浸出过程已有大量的研究报道[8,20-21],这些数据以数学模型为描述语言再现了生物浸出的过程,大量的动力学模型的分析,为我们提供生物浸出的规律与机理的数学基础。传统的生物学是采用描述性研究方法,因此缺乏客观性的对生物浸出过程的科学描述,生物数学的融入为微生物学研究提供了重要的研究工具。
从动力学角度看,可以把整个生物浸出过程分为几个独立的过程或单元。生物浸出过程中,由于细菌进行非均匀性侵蚀,所以生物浸出过程的动力学与一般浸出过程的动力学有所不同[19]。①细菌的铁氧化生长动力学模型:该模型由Janes和Kelly提出[22],阐明了底物的促进和抑制作用对细菌生长的影响。研究表明Fe2+浓度<56 g/L时,细菌的生长与浓度成正比,同时Fe2+部分用于细菌生长,部分用于细胞的消耗及维持[23]。柳建设等利用基于Monod方程建立的细菌生长动力学方程模型,采用Matlab软件中的Gauss-Newton算法确定了在不同条件下细菌生长动力学参数[24];②细菌的氧浓度生长动力学模型:氧浓度的高低直接影响浸矿菌种的酶活性或菌体数量。当氧浓度偏低时,细菌处于内源呼吸状态,生长缓慢,对浸出效率影响极大。因此氧的浓度在生物浸出过程中是一个关键影响因素[25];③综合模型:是Boon和Huberts[26-27]建立的一种以氧化还原电位为参数的浸出菌生长动力学模型。利用氧化还原电位的变化,研究Fe2+氧化还原反应的速率和效果[28]。这个模型综合考虑了温度、浓度、电子转移速率等因素的影响,因而在生产过程可进行预测、控制及最优化设计和处置[19]。Crundwell[29]提出了细菌浸出在分批培养与连续培养方式下的数学模型。
对于生物浸出工艺优化通常采用单因素实验设计、正交实验设计与响应面实验设计,这些实验设计所获得的实验结果一般作为工艺优化的指导。但是这些方法没有经过进一步的数学模型分析,对实验所得数据与实际生物浸出过程存在一定的差距。如在微生物浸出雄黄试验工艺的优化中,通过单因素实验设计结合线性模型分析的方法,确定了最佳优化工艺[30],这一结果与采用响应面设计所得的实验结果是相同的。由于采用数学模型分析,使得实验过程得以简化,数学模型阐明实验过程,使得工艺的优化更具有可操作性。动力学研究方法是从动力学的原始实验数据出发,经分析获得某些反应动力学参数,用这些参数表征反应体系的速率特征,也是目前最为常用的研究方法。在表3中,总结归纳了围绕生物浸出影响因子与环境参数的动力学模型。主要的分析方法包括双倒数作图法(Linweaver-Burk)、线性回归法(Linear regression)、分线性回归法(Nonlinear regression)。通过不同的实验设计获得不同的数学模型,用以描述不同体系的浸出过程。进一步整合现有生物浸出数据,将生物浸出动力学应用于浸出过程的研究以及环境参数的选择,有助于进一步探索与分析浸出机制,揭示生物浸出的内在规律与联系。

续表
注:μmax:最大生长速率;Vmax,亚铁离子最大氧化速率;qmax,最大氧消耗速率;KS,底物偏好常数;KP,产物抑制常数;(a):实验室菌株;(b):野外分离菌株
3 展 望
我国矿产资源丰富,但是贫矿、小型矿、废弃矿也数量巨大。提高非再生矿产资源的利用,降低采矿成本是我国采矿业面临的主要问题之一。生物浸出法作为一种低成本的采矿手段早在上世纪60年代就被用于冶金生产中。该方法在金、铜、铀矿的冶金中已经广泛使用推广,是一种高经济效益、高环境友好的生产工艺,特别适用于高含砷、含硫矿床的生物氧化工艺。研究生物浸矿的影响因素与环境因素的数学模型,能对优化生物浸矿条件提供准确的理论依据,从而对发展高效采矿技术有指导性意义,为进行工业化规模生产提供前提和基础。今后还应进一步完善生物浸出生产工艺,提高经济效益,降低采矿业环境污染,推广生物浸出法在冶金业中广泛应用。
[1] Chen P, Yan L, Wang Q, et al.ArsenicPrecipitationin the Bioleaching of Realgar Using Acidithiobacillus ferrooxidans[J]. Journal of Applied Chemistry, 2013, 2013: 5.
[2] Chen P, Yan L, Leng F, et al. Bioleaching of realgar byAcidithiobacillusferrooxidansusing ferrous iron and elemental sulfur as the sole and mixed energy sources[J]. Bioresource Technology, 2011, 102(3): 3260-3267.
[3] Silverman MP,Lundgren DG. Studies on the chemoautotrophic iron bacteriumThiobacillusferrooxidans. I. An improved medium and a harvesting procedure for securing high cellular yields[J]. Journal of Bacteriology, 1959, 77(5): 642-647.
[4] Wiertz JV, Mateo M,Escobar B. Mechanism of pyrite catalysis of As(III) oxidation in bioleaching solutions at 30 ℃ and 70 ℃[J]. Hydrometallurgy, 2006, 83(1-4): 35-39.
[5] Yang X, Zhang X, Fan Y, et al. The leaching of pentlandite byAcidithiobacillusferrooxidanswith a biological-chemical process[J]. Biochem Eng J, 2008, 42(2): 166-171.
[6] Leduc LG,Ferroni GD. The chemolithotrophic bacteriumThiobacillusferrooxidans[J]. FEMS Microbiol Rev, 1994, 14(2): 103-119.
[7] Meruane G,Vargas T. Bacterial oxidation of ferrous iron byAcidithiobacillusferrooxidansin the pH range 2.5-7.0[J]. Hydrometallurgy, 2003, 71(1-2): 149-158.
[8] Xia L, Yin C, Dai S, et al. Bioleaching of chalcopyrite concentrate usingLeptospirillumferriphilum,AcidithiobacillusferrooxidansandAcidithiobacillusthiooxidansin a continuous bubble column reactor[J]. J Ind Microbiol Biotechnol, 2010, 37(3): 289-295.
[9] Pradhan D, Mishra D, Kim DJ, et al. Bioleaching kinetics and multivariate analysis of spent petroleum catalyst dissolution using two acidophiles[J]. J Hazard Mater, 2010, 175(1-3): 267-273.
[10]Kawabe Y, Inoue C, Suto K, et al. Inhibitory effect of high concentrations of ferric ions on the activity ofAcidithiobacillusferrooxidans[J]. J Biosci Bioeng, 2003, 96(4): 375-379.
[11]Giaveno A,Donati E. Bioleaching of heazelwoodite byThiobacillusspp. [J]. Process Biochem,2001, 36(10): 955-962.
[12]Giménez J, Martínez M, de Pablo J, et al. Arsenic sorption onto natural hematite, magnetite, and goethite[J]. Journal of Hazardous Materials 2007, 141(3): 575-580.
[13]Mohan D ,Pittman JCU. Arsenic removal from water/wastewater using adsorbents-A critical review[J]. Journal of Hazardous Materials 2007, 142(1-2): 1-53.
[14]Ferguson SJ ,Ingledew WJ. Energetic problems faced by micro-organisms growing or surviving on parsimonious energy sources and at acidic pH: I.Acidithiobacillusferrooxidansas a paradigm[J]. Biochim Biophys Acta, 2008, 1777(12): 1471-1479.
[15]Abhilash, Singh S, Mehta KD, et al. Dissolution of uranium from silicate-apatite ore byAcidithiobacillusferrooxidans[J]. Hydrometallurgy, 2009, 95(1-2): 70-75.
[16]Bayat O, Sever E, Bayat B, et al. Bioleaching of zinc and iron from steel plant waste usingAcidithiobacillusferrooxidans[J]. Appl Biochem Biotechnol, 2009, 152(1): 117-126.
[17]Tributsch H. Direct versus indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2-3): 177-185.
[18]Sand W, Gehrke T, Jozsa P-G, et al. (Bio)chemistry of bacterial leaching-direct vs. indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2-3): 159-175.
[19]Wang X ,Gong W. Study on Application of Microbiology in Bioleaching[J]. Journal of Wuhan University of Technology, 2005, (3): 56-58.
[20]Ren WX, Li PJ, Zheng L, et al. Effects of dissolved low molecular weight organic acids on oxidation of ferrous iron byAcidithiobacillusferrooxidans[J]. J Hazard Mater, 2009, 162(1): 17-22.
[21]Jaisankar S ,Modak JM. Ferrous iron oxidation by foam immobilizedAcidithiobacillusferrooxidans: Experiments and modeling[J]. Biotechnol Prog, 2009, 25(5): 1328-1342.
[22]Jones CA ,Kelly D. Growth ofThiobacillusferrooxidanson ferrous iron in chemostat culture: influence of product and substrate inhibition. J Chem Tech Biotechnol[J].Biotechnol,1983,33(4): 241-261.
[23]Nemati M, Harrison STL, Hansford GS, et al. Biological oxidation of ferrous sulphate by Thiobacillus ferrooxidans: a review on the kinetic aspects[J]. Biochem Eng J,1998,1(3):171-190.
[24]柳建设, 张艳华, 李邦梅, 等. 嗜酸氧化亚铁硫杆菌生长动力学(英文) [J].微生物学杂志,2006, 26(2):9-13.
[25]Liu M, Branion R ,Duncan D. The effects of ferrous iron, dissolved oxygen, and inert solids concentrations on the growth ofThiobacillusferrooxidans[J]. Can J Chem Eng, 1988, 66(3): 445-451.
[26]Boon M, Ras C ,Heijnen J. The ferrous iron oxidation kinetics ofThiobacillusferrooxidansin batch cultures[J]. Appl Microbiol Biotechnol, 1999, 51(6): 813-819.
[27]Boon M, Brasser H, Hansford G, et al. Comparison of the oxidation kinetics of different pyrites in the presence ofThiobacillusferrooxidansorLeptospirillumferrooxidans[J]. Hydrometallurgy, 1999, 53(1): 57-72.
[28]Meruane G, Salhe C, Wiertz J, et al. Novel electrochemical-enzymatic model which quantifies the effect of the solution Eh on the kinetics of ferrous iron oxidation withAcidithiobacillusferrooxidans[J]. Biotechnol Bioeng, 2002, 80(3): 280-288.
[29]Crundwell F. Mathematical modelling of batch and continuous bacterial leaching[J]. Chem Eng J Biochem Eng J, 1994, 54(3): 207-220.
[30]Chen P, Yan L, Yue X, et al. Optimal parameters for bioleaching of realgar usingAcidithiobacillusferrooxidansunder different growth conditions and mathematical analysis[J].Biocatalysis and Biotransformation,2013,31(1):33-41.
[31]Suzuki I, Lizama H , Tackaberry P. Competitive inhibition of ferrous iron oxidation bythiobacillusferrooxidansby increasing concentrations of cells[J].Appl Environ Microbiol,1989,55(5): 1117.
[32]Lizama HM , Suzuki I. Synergistic competitive inhibition of ferrous iron oxidation byThiobacillusferrooxidansby increasing concentrations of ferric iron and cells[J].Appl Environ Microbiol,1989,55(10):2588.
[33]Harvey P , Crundwell F. Growth ofThiobacillusferrooxidans: a novel experimental design for batch growth and bacterial leaching studies[J]. Appl Environ Microbiol, 1997, 63(7): 2586.
[34]Nemati M , Webb C. Inhibition effect of ferric iron on the kinetics of ferrous iron[J].Biotechnol Lett,1998,20(9):873-877.
[35]Gomez JM , Cantero D. Kinetic study of biological ferrous sulphate oxidation by iron-oxidising bacteria in continuous stirred tank and packed bed bioreactors[J].Process Biochem,2003,38(6): 867-875.
[36]Molchanov S, Gendel Y, Ioslvich I, et al. Improved experimental and computational methodology for determining the kinetic equation and the extant kinetic constants of Fe(II) oxidation byAcidithiobacillusferrooxidans[J].Appl Environ Microbiol, 2007, 73(6): 1742-1752.
MathematicalModelsofEffectingFactorsandEnvironmentParametersonBio-Leaching
CHEN Peng1, 2, LI Hong-yu2, YAN Lei3, WANG Ning-bo1
(1.GansuInst.ofBusinessSci-Tech,Lanzhou730010; 2.Schl.ofPharm.,LanzhouUni.,Lanzhou730020; 3.HeilongjiangBayiUni.ofLandReclamt'n,Daqing, 163319)
Bio-leaching is one of effective methods for low-grade ores mining. It has profound significance for highly efficient utilization of non-renewable resources. It has been many reports revolving around effecting factors and environment parameters in the bio-leaching process. However, the systemization of the effecting factors, environment parameters as well as the mathematical models of the bio-leaching process were rarely induced and summarized. Firstly, the effecting factors and environment parameters of bio-leaching were dilated; secondly, based on mechanism of leaching, the mathematical models of the effecting factors and environment parameters were dealt with; finally, an outlook on the predictability, controllability, and optimization design of mining production were put forward in this paper.
bio-leaching microorganisms; bio-leaching; effecting factors; environment parameters; mathematical models
甘肃省杰出青年基金(1308RJDA014);陇原青年创新人才扶持计划项目(甘组通字[2014]4号)
陈朋 男,副研究员。研究方向为生物转化过程与系统微生物学。Tel:0931-8551962,E-mail:BlueSCI@126.com
2013-10-21;
2013-11-20
Q936
A
1005-7021(2014)04-0071-06
10.3969/j.issn.1005-7021.2014.04.014