EBNA3C与Gemin3两种蛋白形成复合物及相互作用的结构域
郭 毅, 唐艳君, 赵 楠
(1.中国医科大学附属第一医院 妇科,辽宁 沈阳 110001;2.鞍山市岫岩满族自治县第三人民医院 妇产科,辽宁 鞍山 114300)
EBNA3C与Gemin3两种蛋白形成复合物及相互作用的结构域
郭 毅1, 唐艳君2, 赵 楠1
(1.中国医科大学附属第一医院 妇科,辽宁 沈阳 110001;2.鞍山市岫岩满族自治县第三人民医院 妇产科,辽宁 鞍山 114300)
探讨EB病毒核抗原3C(EBNA3C)与Gemin3的相互结合及其作用区域。用Flag-EBAN3C与GFP-Gemin3共转染HEK 293细胞,采用免疫共沉淀、谷胱苷肽-S转移酶共沉淀及免疫荧光蛋白共存实验确定EBNA3C与Gemin3两种蛋白在体内、体外相互结合及相互作用的结构域。EBNA3C与Gemin3两种蛋白在体内外相结合,二者通过各自的C端相互结合。EBNA3C与Gemin3两种蛋白形成稳定复合物。
EBNA3C;Gemin3;结构域
EB病毒是第一个被发现的人类肿瘤病毒,与多种淋巴细胞增殖性疾病的发生相关,其中包括Burkitt淋巴瘤、鼻咽癌以及Hodgkin病。EB病毒为一种广泛存在的γ-疱疹病毒,90%以上的成人均感染EB病毒,发生于儿童期的初次感染多无临床症状,青年和成人初次感染可引起传染性单核细胞增多症。免疫系统功能低下的艾滋病人和器官移植术后病人易发生EB病毒相关的淋巴瘤。在体外,EB病毒可以将静止的B细胞转化为具有无限增殖能力的潜伏感染的B细胞,即淋巴母细胞样B细胞系。EB病毒与其他疱疹病毒一样,其生命周期分为潜伏期(非增殖期)和溶解期(增殖期)。EB病毒在体外转化B淋巴细胞并建立潜伏感染的关键调控因子,包括EBNA2,EBNA3A、3C和LMP1蛋白[1-2]。EBNA3C作为转录调节因子与多种细胞及病毒因子相作用。Gemin3(又称DDX20或DP103)分别作为EB病毒核心抗原(EBNA2和EBNA3C)及运动神经元生存因子(SMN)的结合蛋白被发现[3-4],它由825个氨基酸组成,其中有包括ASP-Glu-Ala-Asp序列(或DEAD框肽)在内的9个保守序列,Gemin3属于DExD/H框RNA解旋酶家族,该家族在RNA代谢过程中有许多作用,包括mRNA前体的剪接,核糖体生物合成,RNA转运,翻译的起始以及RNA的降解[5-6]。EBNA2和EBNA3C均与SMN以及Gemin3相结合,EBNA2与SMN通过协同作用转录激活病毒的LMP1启动子[7-8]。Gemin3与一些细胞转录因子相结合并调控这些因子,其中包括类固醇生长因子1(SF-1)[9-10],早期生长反应蛋白2(Egr-2)[11],叉头转录因子2(FOXL2)[12]以及有丝分裂原Ets转录抑制因子PE-1/METS[13]。本研究表明,EBNA3C与Gemin3形成复合物并确定了它们相互作用的结构域。
1 材料与方法
1.1材料
1.1.1 质粒、细胞系和抗体 pA3F-EBNA3及其截短片断(EBNA3C 1-365,366-620,621-992)、myc-Gemin3和GST-EBNA3C截短片断质粒如前所述[14]。表达GFP(绿色荧光蛋白)标记Gemin3的质粒采用将PCR扩增的Gemin3片断于EcoRI和SalI限制性酶切位点插入pEGFP-C1载体(BD Biosciences Clontech)。表达Myc或GST标记的Gemin3质粒(myc-Gemin3,GST-Gemin3)由Gideon Dreyfuss(宾夕法尼亚大学医学院)赠送,GST-Gemin3截短片断GST-Gemin3 1-272是将相应PCR片断于Kpn1和EcoR1位点插入pGEX-2T载体,GST-Gemin3 307-547及GST-Gemin3 546-825是将相应PCR片断于BambH1和EcoR1位点插入pGEX-2TK载体。所有质粒均经测序证实。
1.1.2 培养基 HEK 293、U2OS和Saos-2细胞培养采用DMEM(HyClone,Logan,UT)培养基,加入10%胎牛血清,50 U/mL青霉素,50 μg/mL链霉素和2 mmol/L L-谷氨酰胺。BJAB、RAMOS和EBV阳性的细胞系采用RPMI 1640培养基,其所添加物与DMEM相同。在37 ℃、5% CO2、饱和湿度环境下培养。
1.1.3 抗体 鼠抗Gemin3单抗由Gideon Dreyfuss惠赠,鼠抗myc单抗9E10和抗EBNA3C单抗A10来源相应杂交瘤培养液。鼠抗Flag单克隆抗体M2购自Sigma-Aldrich公司(St. Louis, MO)。鼠抗p53单抗DO-1购自Santa Cruz 生物技术公司(Santa Cruz, CA)。
1.2方法
1.2.1 转染 采用Bio-Rad Gene Pulser II型电穿孔仪转染细胞,收集15×106对数生长期细胞,PBS冲洗后重新悬浮于400 μL已加入转染DNA的培养基中,转入0.4 cm间距电转杯中,电容为975 μF,转染HEK 293和SAOS-2电压为210 V,B淋巴细胞用220 V转染。转染的细胞移到加入10 mL培养基的培养皿或培养瓶中37 ℃培养,36 h后收集细胞。
1.2.2 免疫沉淀和蛋白免疫印迹 收集并裂解细胞,细胞裂解物与正常鼠血清及30 μL 1∶1蛋白A和蛋白G琼脂糖凝胶珠子共旋转预清除非特异反应复合物(1 h,4 ℃)。离心去除珠子,将上清转移到新的微小离心管并取出约5%裂解物,保留作为内对照。其余裂解物中加入1 μg相关抗体4 ℃旋转过夜以捕获目的蛋白,然后加入30 μL 1∶1蛋白A和蛋白G琼脂糖凝胶珠子捕获所形成的免疫复合物并沉淀,用冰冷RIPA缓冲液洗涤5次。蛋白免疫印迹实验中,蛋白裂解物和免疫沉淀复合物用Laemmli上样缓冲液加热变性,SDS聚丙烯酰胺凝胶电泳分离,转移到0.45 μm硝酸纤维素膜。用相关抗体检测醋酸纤维膜中的蛋白,再与相应的发射红外光的第二抗体共培育后,用Odyssey imager (LiCor Inc., Lincoln, NE)扫描。
1.2.3 谷胱苷肽-S转移酶(GST)融合蛋白纯化 用表达相关GST融合蛋白的质粒转化大肠埃希菌BL21,挑选单个菌落接种含有100 μg/mL氨苄青霉素的3 mL LB培养基过夜,次日取其中1 mL接种500 mL同样培养基,当光密度在600 nm达到0.6时,加入1 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)30 ℃诱导12 h。然后沉淀细菌,用STE缓冲液(100 mmol/L NaCl,10 mmol/L Tris,1 mmol/L EDTA,pH 7.5)洗涤1次,再用3 mL加入蛋白酶抑制剂的NETN缓冲液(0.5% NP-40, 100 mmol/L NaCl,20 mmol/L Tris,1 mmol/L EDTA,pH 8.0)重新悬浮,冰浴15 min。再加入150 μL 1 mol/L二硫苏糖醇(DTT)和1.8 mL含有10%肌氨酰(Sarkosyl)的STE缓冲液,在冰中超声裂解3 min将蛋白溶解。裂解物离心(12 000×g,10 min,4 ℃)分离未溶解成分,将上清成分转移到新的离心管,加入3 mL含有10% Triton X-100的STE缓冲液及200 μL谷胱甘肽琼脂糖珠,4 ℃旋转过夜。离心收集与谷胱甘肽琼脂糖珠结合的蛋白(600×g,2 min,4 ℃)并用加有蛋白酶抑制剂的NETN缓冲液洗涤5次。用SDS聚丙烯酰胺凝胶电泳检测纯化程度并将纯化的蛋白放于4 ℃保存。
1.2.4 谷胱苷肽-S转移酶共沉淀实验 对于细胞裂解成分的共沉淀分析,首先用RIPA缓冲液(0.5% NP-40,10 mmol/L Tris(pH 7.5),2 mmol/L EDTA,150 mmol/L NaCl,以及蛋白酶抑制剂)处理。裂解物经过预清除然后与谷胱甘肽琼脂糖珠对照或相应的谷胱甘肽琼脂糖珠融合蛋白结合。在体外结合实验中,谷胱甘肽琼脂糖珠对照或相应的谷胱甘肽琼脂糖珠融合蛋白与35S标记的体外翻译蛋白在结合缓冲液(1×PBS,0.1% NP-40,0.5 mmol/L DTT,10%甘油以及蛋白酶抑制剂)共培育。体外蛋白翻译采用TNT快速转录/翻译偶联系统(Promega Inc., Madison,WI),操作步骤同产品说明。
1.2.5 免疫荧光蛋白共存实验 用脂质体转染试剂盒Lipofectamine 2000 (Invitrogen, Carlsbad, CA)将质粒转染到U2OS后在盖玻片上培养观察外源性Gemin3与EBNA3C两种蛋白的共存,采用LCL1细胞观察内源性Gemin3和EBNA3C在细胞内的共存,采用鼠单抗12H12检测Gemin3蛋白表达,内源性EBNA3C蛋白采用与EBNA3C反应的兔源性多克隆抗体(1∶150 dilution)检测;Flag标记的EBNA3C用M2单抗(1∶1 000 dilution; Santa Cruz Biotechnology, Inc., Santa Cruz, CA)检测。一抗与细胞在室温下共同孵育30 min,用PBS清洗3遍后加入二抗。对于LCL1细胞分别用与Alexa Fluor 594相结合羊抗鼠抗体检测Gemin3,与Alexa Fluor 488相结合的羊抗兔抗体检测EBNA3C;对于U2OS细胞用与Alexa Fluor 594相结合羊抗鼠抗体检测EBNA3C。二抗用封闭缓冲液1∶1 000稀释并在室温下孵育1 h,然后用封闭缓冲液冲洗3次。最后一次的冲洗液中含4′,6-二脒基-2-苯基吲哚(DAPI; Promega, Madison, WI)对胞核进行复染。玻片用奥林巴斯激光共聚焦扫描显微镜观察,图像用Fluoview FV300(Olympus,Melville,NY)软件分析。
2 结果与分析
2.1EBNA3C与Gemin3在体内外形成复合物
将Flag标记的EBNA3C和GFP标记的Gemin3共转染HEK 293细胞,采用相应的空白载体作阴性对照。经过转染的293细胞提取物用抗Flag的抗体沉淀,所得到的沉淀物用抗GFP的抗体做蛋白免疫印迹分析(图1A),转染的Flag-EBNA3C和GFP-Gemin3相互结合而与空白载体无结合,显示外源性表达的EBNA3C和Gemin3特异性结合。随后检测了内源性EBNA3C和Gemin3的相互结合。采用EBV阴性的Burkitt淋巴瘤细胞系Ramos,以及EBV转化的细胞系(LCL1和LCL2)的细胞裂解物做免疫共沉淀,内源性Gemin3被抗EBNA3C抗体A10免疫沉淀,但不能被对照鼠血清沉淀(图1B);EBNA3C阴性细胞系中检测不到EBNA3C信号表明了该免疫共沉淀的特异性。这些结果显示EBNA3C与Gemin3形成复合物。
本研究还进行了体外结合实验确定EBNA3C是否与Gemin3直接作用,谷胱苷肽-S转移酶及其标记的Gemin3经过大肠埃希菌表达蛋白与体外翻译的35S标记的EBNA3C蛋白共孵育,GST-Gemin3蛋白结合珠子可以沉淀大量的具有放射性的EBNA3C蛋白,而单独GST结合珠子则没有这种功能。考马斯蓝染色显示了在结合实验中所用的GST及GST-Gemin3融合蛋白的表达量(图1C)。该实验表明Gemin3和EBNA3C在体外形成复合物。
2.2EBNA3C与Gemin3通过各自的C端相连接
为了确定EBNA3C与Gemin3相结合的区域,用GFP标记的Gemin3与Flag标记EBNA3C全长(1~992)或其截短片断(1~365、366~620或621~992)质粒共转染HEK-293细胞。Gemin3与全长的EBNA3C及其C端有较高的亲和性,发生共沉淀反应(图2A)。为了确定Gemin3中与EBNA3C连接的结构域,构建了GST-Gemin3的截短片断(1~272、307~547和546~825)并经细菌表达,与体外翻译的全长EBNA3C共孵育,结果显示Gemin3的C端与EBNA3C的C端相结合(图2B)。

图1 EBNA3C与Gemin3蛋白的结合Fig.1 Binding of EBNA3C and Gemin3
A:外源性表达的GFP-Gemin3和Flag-EBNA3C结合;
B:内源性Gemin3与EBNA3C结合;
C:GST-Gemin3与EBNA3C在体外结合
A:GFP-Gemin3 and Flag-E3C combined in transfected 293 cells;
B:Endogenous Gemins3 combined with EBNA3C;
C:GST-Gemins3 combined with in-vitro translated EBNA3C
2.3EBNA3C与Gemin3共存
采用免疫共存实验以确定EBNA3C与Gemin3相互作用发生在细胞内的同一位置,将外源性的Flag标记的EBNA3C和GFP标记的Gemin3在U2OS细胞表达。
免疫荧光结果显示EBNA3C蛋白为细胞核内的点状结构,Gemin3主要存在于细胞核内及散在于细胞核周围。EBNA3C与Gemin3在一些位点上共存显示为黄色。为了观察在生理状态下这两种蛋白的相互作用,用EBV阳性的LCL1细胞系观察到了同样的EBNA3C与Gemin3共存形式(图3)。

图2 EBNA3C和Gemin3通过各自的C端结合Fig.2 EBNA3C and Gemin3 combined through their C-terminal
A:全长EBNA3C及其621~992截短片段与Gemin3结合;
B:GST-Gemins3的C端546~825与EBNA3C结合
A:Full-length EBNA3C and its 621~992 truncate combined with Gemin3;
B:GST-Gemin3 combined with EBNA3C through its C-terminal
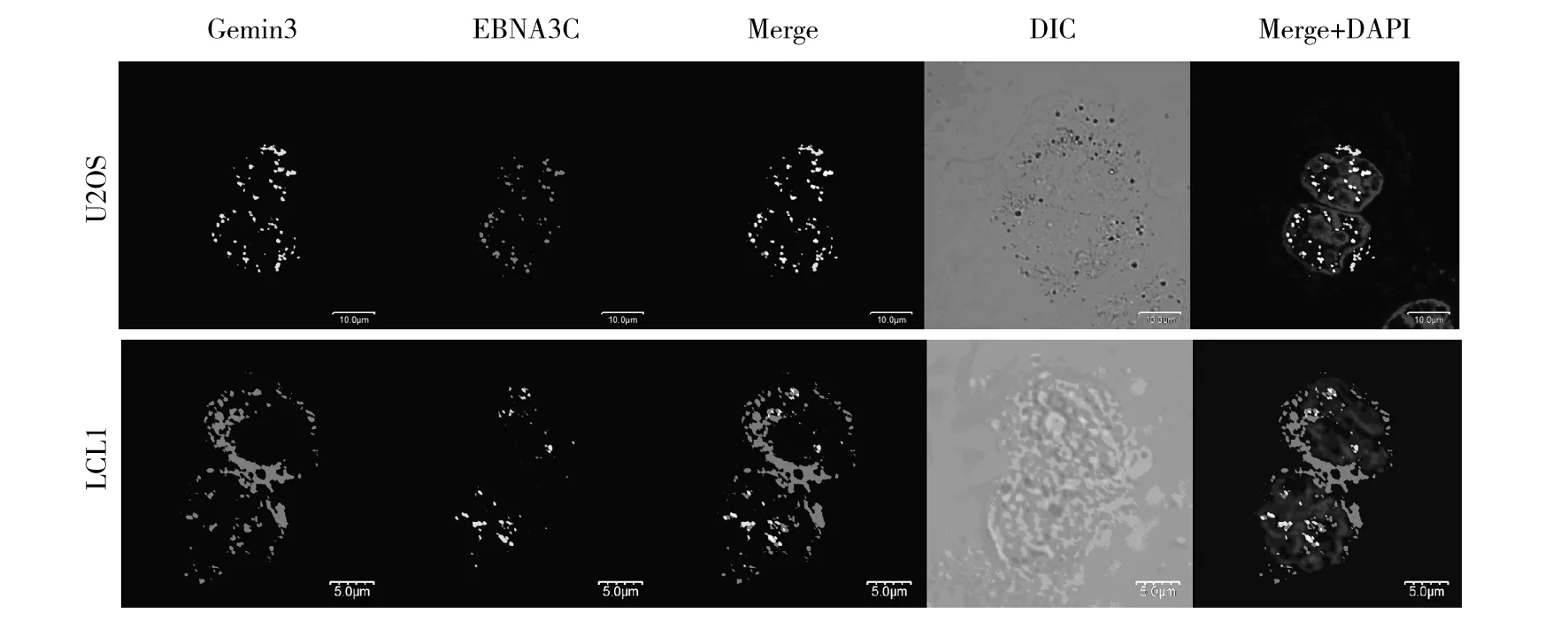
图3 免疫荧光检测EBNA3C和Gemin3蛋白共存Fig.3 EBNA3C co-localized with Gemin3
3 讨 论
EBNA3C为由992个氨基酸组成的蛋白并以散在的颗粒状存在于细胞核内。EBNA3C具有激活宿主细胞和自身病毒基因的双重作用。EBNA3C具有癌基因的功能与活化的(Ha-)ras基因共同作用转化大鼠的胚胎纤维母细胞[14]。EBNA3C通过直接的蛋白之间相互作用调节细胞周期[15]。EBNA3C通过召集泛素化连接酶E3复合物机制降解Rb或p27蛋白[16];它还能稳定宿主细胞内的癌蛋白c-Myc和Mdm2[17-18]。Gemin3(DP103/DDX20)最初是在寻找与EBNA2及EBNA3C相互作用的细胞因子的过程中通过酵母双杂交实验发现的[4],Gemin3的N端包含保守的解弦酶序列,其非保守的C端是与多种细胞和病毒因子相互结合的部位[10]。本实验结果表明Gemin3通过其C端的548-825位点氨基酸结构域与EBNA3C结合。无论是对于简单的果蝇还是复杂的哺乳动物,Gemin3都是胚胎发育和成活的关键基因[19-20]。Gemin3通过与其他分子作用而表现出不同的生物学功能。Gemin3在于睾丸组织中含量较高,而其他产雄激素或非产雄激素的组织中的含量均较低,Gemin3与类固醇生长因子1(SF-1)结合在转录水平抑制后者的功能[9]。Gemin3还与有丝分裂元Ets转录抑制因子METS/PE1或ERF形成复合物,通过召集组蛋白乙酰基转移酶(HDAC2和HDAC5)控制细胞的增值和分化[13],Gemin3通过与早期生长反应因子2(Egr2/Krox-20)结合并部分依赖召集HDAC而抑制其转录活性[11],Gemin3还可以通过与叉头转录因子2(FOXL2)结合诱导凋亡[17]。Gemin3与肿瘤相关的直接证据来源于膀胱癌危险因素与microRNA相关基因突变关系的临床分析,Gemin3基因的非同义单核苷酸多态性的同源性变异是膀胱癌发病的高危因素[21]。本实验表明EBNA3C与Gemin3两种蛋白通过各自的C端形成复合物,我们的相关实验表明EBNA3C稳定Gemin3蛋白的表达,后者通过下调p53蛋白的结合能力而抑制细胞凋亡[22-23]。
[1] Rickinson, A B, E Kieff. Epstein-Barr virus [M]. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed). Fields virology, 4rd ed. Vol. 2. Lippincott Williams & Wilkins, Philadelphia, Pa.2002,(2 vols):2575-2627.
[2] Zhao B, CE Sample. Epstein-barr virus nuclear antigen 3C activates the latent membrane protein 1 promoter in the presence of Epstein-Barr virus nuclear antigen 2 through sequences encompassing an spi-1/Spi-B binding site[J].J Virol, 2000,74:5151-5160.
[3] Charroux, B, L Pellizzoni, RA Perkinson, et al. Gemin3: A novel DEAD box protein that interacts with SMN, the spinal muscular atrophy gene product, and is a component of gems[J].J Cell Biol,1999,147:1181-1194.
[4] Grundhoff AT, EK Remmer, O. Tureci, et al. Characterization of DP103, a novel DEAD box protein that binds to the Epstein-Barr virus nuclear proteins EBNA2 and EBNA3C[J].J Biol Chem,1999,274:19136-19144.
[5] Cordin O, J Banroques, NK Tanner, et al. The DEAD-box protein family of RNA helicases[J].Gene,2006,367:17-37.
[6] Rocak S, P Linder. DEAD-box proteins: the driving forces behind RNA metabolism[J].Nat Rev Mol Cell Biol,2004,5:232-241.
[7] Krauer KG., M Buck, DK Belzer, et al. The Epstein-Barr virus nuclear antigen-6 protein co-localizes with EBNA-3 and survival of motor neurons protein[J].Virology,2004,318:280-294.
[8] Voss MD, A Hille, S Barth, et al. Functional cooperation of Epstein-Barr virus nuclear antigen 2 and the survival motor neuron protein in transactivation of the viral LMP1 promoter[J].J Virol,2001,75:11781-11790.
[9] Ou Q, JF Mouillet, X Yan, et al.The DEAD box protein DP103 is a regulator of steroidogenic factor-1[J].Mol Endocrinol,2001,15:69-79.
[10]Yan X, JF Mouillet, Q Ou, et al. A novel domain within the DEAD-box protein DP103 is essential for transcriptional repression and helicase activity[J]. Mol Cell Biol,2003,23:414-423.
[11]Gillian AL, J Svaren. The Ddx20/DP103 dead box protein represses transcriptional activation by Egr2/Krox-20[J]. J Biol Chem, 2004,279:9056-9063.
[12]Lee K, MD Pisarska, JJ Ko, et al. Transcriptional factor FOXL2 interacts with DP103 and induces apoptosis[J].Biochem Biophys Res Commun, 2005,336:876-881.
[13]Klappacher G.W, VV Lunyak, DB Sykes, et al. An induced Ets repressor complex regulates growth arrest during terminal macrophage differentiation[J]. Cell,2002,109:169-180.
[14]Parker GA, T Crook, M. Bain, et al. Epstein-Barr virus nuclear antigen (EBNA)3C is an immortalizing oncoprotein with similar properties to adenovirus E1A and papillomavirus E7[J].Oncogene,1996,13:2541-2549.
[15]Knight JS, N Sharma, ES Robertson. Epstein-Barr virus latent antigen 3C can mediate the degradation of the retinoblastoma protein through an SCF cellular ubiquitin ligase[J].Proc Natl Acad Sci U S A,2005,102:18562-18566.
[16]Knight JS, N Sharma, ES Robertson. SCFSkp2 complex targeted by Epstein-Barr virus essential nuclear antigen[J].Mol Cell Biol,2005,25:1749-1763.
[17]Bajaj BG., M Murakami, Q Cai. Epstein-Barr virus nuclear antigen 3Cinteracts with and enhances the stability of the c-Myc oncoprotein[J].J Virol,2008,82:4082-4090.
[18]Saha A, M Murakami, P Kumar. Epstein-Barr virus nuclear antigen 3C augments Mdm2-mediated p53 ubiquitination and degradation by deubiquitinating Mdm2[J].J Virol,2009,83:4652-4669.
[19]Cauchi RJ, Ke Davies, JL Liu. A motor function for the DEAD-box RNA helicase, Gemin3, in Drosophila[J].PLoS Genet,2008, 4:e1000265.
[20]Mouillet JF, X Yan, Q Ou, et al. DEAD-box protein-103 (DP103, Ddx20) is essential for early embryonic development and modulates ovarian morphology and function[J].Endocrinology,2008,149:2168-2175.
[21]Yang H, CP Dinney, Y Ye, et al. Evaluation of genetic variants in microRNA-related genes and risk of bladder cancer[J].Cancer Res, 2008,68:2530-2537.
[22]郭毅,孔繁明,赵楠.EB病毒核抗原3C提高Gemin3基因的表达[J].中国医科大学学报,2012,41(6):497-500.
[23]郭毅,张晓光,赵楠,等.Gemin3基因通过抑制p53表达阻碍细胞凋亡[J].中华肿瘤杂志,2011,33(11):810-815.
CompoundFormedbyTwoProteinsEBNA3C&Gemin3andTheirInteractionStructuralDomain
GUO Yi1, TANG Yan-jun2, ZHAO Nan1
(Dept.ofGynecol., 1stAffil.Hosp.ofChinaMed.Uni.,Shengyang110001; 2.Dept.ofGyneacol. &Obstetrics, 3rdPeople'sHosp.ManzhuAutonom.CountyofXiuyan,AnshanCity114300)
Interaction and working domain of nucleo-antigen 3C of EB virus (EBNA3C) with Gemin3 was investigated. HEK 293 cells were co-infected with Flag-EBNA3C and GFP-Gemin3, and their structural domain of two proteins EBNA3C and Gemin3 inter-conjunction and interactioninvivoandinvitrowas confirmed by co-existence experiment adopting immune co-precipitation, glutathione-S transferase and immunofluorescence protein. EBNA3C and Gemin3 combined with each otherinvivoandinvitrothrough their individual C-terminal. Two kinds of proteins of EBNA3C and Gemin3 formed a stable compound.
EBNA3C; Gemin3; structural domain
国家自然科学基金(81171649);辽宁省自然科学基金(201102267)
郭毅 男,教授。研究方向为肿瘤病毒。E-mail: guoyi12@hotmail.com
2013-05-14;
2013-05-25
Q939.96;R466.5
A
1005-7021(2014)04-0027-06
10.3969/j.issn.1005-7021.2014.04.005