骨转录因子Runx2和骨桥蛋白OPN在人乳腺癌组织中的表达及其与乳腺癌微钙化的关系
梁晓燕,马少君,王 原,康晓丽,王 涛,黄范利,王 宏
(陕西省人民医院:1.放射科;2. 病理科;3. 肿瘤外科,陕西西安 710068)
◇临床研究◇
骨转录因子Runx2和骨桥蛋白OPN在人乳腺癌组织中的表达及其与乳腺癌微钙化的关系
梁晓燕1,马少君1,王 原2,康晓丽1,王 涛1,黄范利1,王 宏3
(陕西省人民医院:1.放射科;2. 病理科;3. 肿瘤外科,陕西西安 710068)
目的 观察骨转录因子Runx2、骨桥蛋白(osteopontin, OPN)在人乳腺癌组织中的表达,并进一步探讨其与乳腺癌微钙化形成间的关系。方法 利用免疫组化方法观察骨转录因子Runx2和骨桥蛋白OPN在62例乳腺癌组织中的表达。根据乳腺癌患者钼靶X线片中微钙化的有无与数量多少,将62例乳腺癌分为3组,即无钙化组、少量钙化组以及大量钙化组,观察Runx2和OPN蛋白表达与不同乳腺癌微钙化之间的关系。结果 Runx2蛋白在人类乳腺癌组织中表达阳性率为72.6%(45/62)。OPN蛋白在人类乳腺癌组织中表达阳性率为79.0%(49/62)。Runx2和OPN蛋白的阳性表达与乳腺癌钼靶X线片中微钙化的出现和数量密切相关,随着微钙化从无到有以及由少至多,Runx2(χ2=15.686,P<0.05)和OPN(χ2=16.161,P<0.05)蛋白的阳性表达率呈逐步增高的趋势。但Runx2和OPN阳性表达与乳腺癌钼靶片中微钙化形态无关。结论 Runx2和OPN蛋白在人类乳腺癌组织中高表达,其可能参与了乳腺癌微钙化的形成过程。
乳腺癌;Runx2;骨桥蛋白(OPN);免疫组化;微钙化;钼靶
乳腺癌是严重危害妇女身体健康的常见肿瘤之一。近年来我国乳腺癌发病率呈明显上升趋势,2010年中国肿瘤登记年报显示我国乳腺癌发病率位居女性恶性肿瘤第一位[1]。微钙化是乳腺癌钼靶X线检查中具有诊断意义的重要征象之一[2-3]。因此,明确乳腺癌微钙化的形成机制将为预测和治疗乳腺癌提供重要线索和依据。
Runx2是一个骨特异性转录因子。研究显示其在成骨细胞的分化以及骨骼形成中发挥重要作用,Runx2蛋白可能参与并调节组织的钙化过程[4-7]。骨桥蛋白(osteopontin, OPN)是一种骨基质磷酸化糖蛋白,研究亦显示其参与骨组织的钙化过程[3]。ENDO等[8]关于甲状腺癌微钙化的研究显示,Runx2蛋白在甲状腺乳头状癌组织中高表达,并且参与甲状腺乳头状癌的微钙化形成。然而,目前关于Runx2和OPN在人类乳腺癌组织中的表达情况以及其在乳腺癌微钙化形成中的作用尚不清楚。因此,本研究采用免疫组化方法检测了Runx2和OPN在人类乳腺癌组织中的表达,并进一步分析其与乳腺癌微钙化形成之间的关系,以期为乳腺癌微钙化的形成提供研究线索,并为防治乳腺癌奠定实验基础。
1 材料与方法
1.1 一般资料 收集陕西省人民医院2009年1月~2013年5月间临床资料和钼靶X线检查资料完整的乳腺癌组织石蜡样本62例。术前均未进行任何放疗和化疗。所有病例均经2位有经验的病理医师复诊病理切片,最终选用病变典型,与X线检查同一部位乳腺癌组织蜡块进行病理形态学和免疫组化检测。62例乳腺癌患者均为女性,年龄从28~76岁,平均49.9岁,其中患者年龄≤50岁者36例,年龄>50岁者26例;均单侧发病,其中右乳38例,左乳24例,肿瘤直径≤2cm共28例,肿瘤直径>2 cm组34例;TNM临床分期Ⅰ期9例,Ⅱ期22例,Ⅲ期21例,Ⅳ期10例;按照世界卫生组织(WHO)乳腺癌病理诊断标准:浸润性导管癌28例,浸润性小叶癌13例,腺癌3例,髓样癌11例,硬癌7例。
1.2 钼靶X线检查 患者术前均行钼靶X线摄片,常规摄取轴位和侧斜位片,钼靶片均由2位有经验的影像科诊断医师复诊阅片,对肿瘤形态、微钙化征象等进行进一步的描述和分组。依据乳腺癌组织有无微钙化[3],将患者分为钙化组和无钙化组;进一步根据微钙化的数目将钙化组分为大量微钙化组(≥20枚)和少量微钙化组(<20枚)。
1.3 免疫组织化学染色 鼠抗人Runx2单克隆抗体购自美国Abnova公司,鼠抗人OPN单克隆抗体购自美国Santa Cruz公司。免疫组化采用链霉素抗生物素蛋白-过氧化酶连接法(SP法),SP试剂盒购自北京中山生物科技有限公司。常规脱蜡、水化、封酶和抗原修复后,一抗(1∶100稀释)4 ℃孵育过夜,37 ℃ 1~2 h,PBS冲洗3次,每次5 min;滴加二抗室温孵育15 min;辣根标记的链霉卵蛋白室温孵育15 min;DAB显色2~7 min;苏木素复染,20 mL/L盐酸酒精分化,中性树胶封片。用已知阳性的人类胎盘组织做阳性对照;用PBS代替一抗做阴性对照。
1.4 染色结果判定标准 以细胞核中出现棕黄色颗粒为Runx2阳性染色细胞,以细胞质和(或)细胞膜出现棕黄色颗粒为OPN阳性染色细胞。每张切片随机选取10个高倍视野,按照阳性细胞的染色数量和显色强度分级评分,取其平均值。 细胞染色数量的评分按照阳性细胞计数占同类细胞的百分比,计算该病例的细胞阳性率。阳性细胞数<5%计0分,6%~25%计1分;26%~50%计2分;51%~75%计3分;>76%计4分;同时根据细胞染色强度加以评分,无着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分。最后根据阳性细胞率与染色强度的评分相加进行最后的评分,两项相加0~1分为(-),2~3分为(+),4~5分为(),6~7分为()。
1.5 统计学处理 所有数据均采用SPSS 13.0统计学软件进行统计分析。计数资料组间比较采用χ2检验与Fisher确切概率检验;P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌钼靶X线片中微钙化情况 62例乳腺癌X线片中表现有微钙化(图1)的38例(61.3%)。根据钙化形态,其中表现为泥沙样钙化17例,细线分枝状15例,沙砾样5例,蠕虫状1例;根据微钙化数目,表现为大量微钙化25例(占钙化组65.8%),少量微钙化的13例(占钙化组34.2%)。
2.2 Runx2和OPN蛋白在乳腺癌组织中的表达 Runx2蛋白阳性表达定位于细胞核(图2A)。62例乳腺癌组织中Runx2阳性表达45例,阳性率72.6%。OPN蛋白阳性表达定位于细胞质和(或)细胞膜(图2B)。62例乳腺癌组织中OPN阳性表达49例,阳性率79.0%。
2.3 Runx2在乳腺癌组织中的表达及其与微钙化的关系 无钙化组乳腺癌组织Runx2阳性表达率58.3%(14/24),钙化组为81.6%(31/38),其中少钙化组和多钙化组分别为76.9%(10/13)和84%(21/25)。各组乳腺癌中,随着微钙化从无到有以及由少至多,Runx2阳性表达率呈逐步增高的趋势(表1),3组间Runx2蛋白的表达差异具有统计学意义(χ2=15.686,P<0.05)。然而Runx2蛋白表达在泥沙样钙化、细线样钙化以及其他钙化等不同乳腺癌微钙化形态之间未见明显差异(χ2=0.904,P>0.05,表2)。
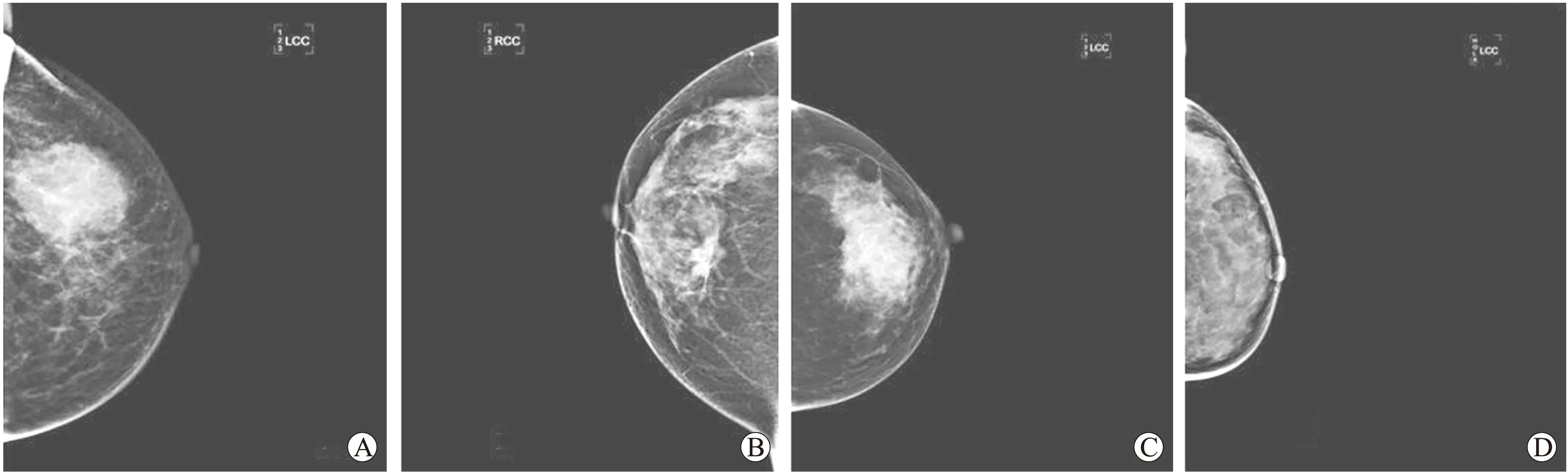
图1 乳腺癌钼靶X线图像
Fig.1 Molybdenum target X-ray images of breast cancer
A:左乳浸润性导管癌,钼靶X线显示无钙化;B:右乳浸润性导管癌,X线可见少量细小泥沙样钙化;C:左乳浸润性导管癌 X线可见大量细线分枝状钙化;D:左乳浸润性导管癌,可见大量泥沙样钙化。
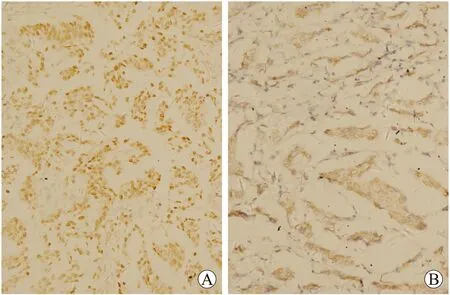
图2 Runx2、OPN蛋白在乳腺癌组织中的表达
Fig.2 The expressions of Runx2 and OPN proteins in breast cancer tissue (DAB, ×400)
A:Runx2蛋白表达;B:OPN蛋白表达。
表1 Runx2蛋白的表达与乳腺癌微钙化量之间的关系
Tab.1 The relationship between the expression of Runx2 protein and the amount of microcalcification in breast cancer
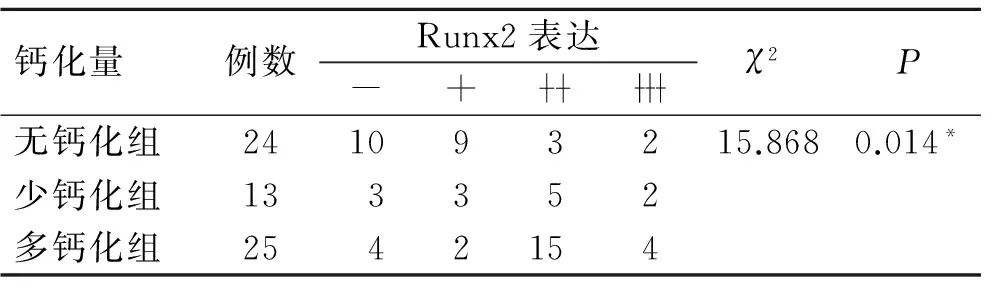
钙化量例数Runx2表达-+χ2P无钙化组241093215.8680.014*少钙化组133352多钙化组2542154
3组之间两两比较,*P<0.05。
2.4 OPN在乳腺癌组织中的表达及其与微钙化的关系 无钙化组乳腺癌组织OPN阳性表达率62.5%(15/24),钙化组为89.5%(34/38),其中少钙化组和多钙化组分别为84.6%(11/13)和92%(23/25)。各组乳腺癌中,随着微钙化从无到有以及由少至多,OPN阳性表达率呈逐步增高的趋势(表3),3组间OPN蛋白的表达差异具有统计学意义(χ2=16.161,P<0.05)。然而OPN蛋白表达在泥沙样钙化、细线样钙化以及其他钙化等不同乳腺癌微钙化形态之间未见明显差异(χ2=1.900,P>0.05)(表4)。
表2 Runx2蛋白的表达与乳腺癌微钙化形态之间的关系
Tab.2 The relationship between the expression of Runx2 protein and the morphology of microcalcification in breast cancer

钙化形态例数Runx2表达-+χ2P泥沙样钙化1742830.9040.989细线样钙化152292其他钙化61131
表3 OPN蛋白的表达与乳腺癌微钙化量之间的关系
Tab.3 The relationship between the expression of OPN protein and the amount of microcalcification in breast cancer
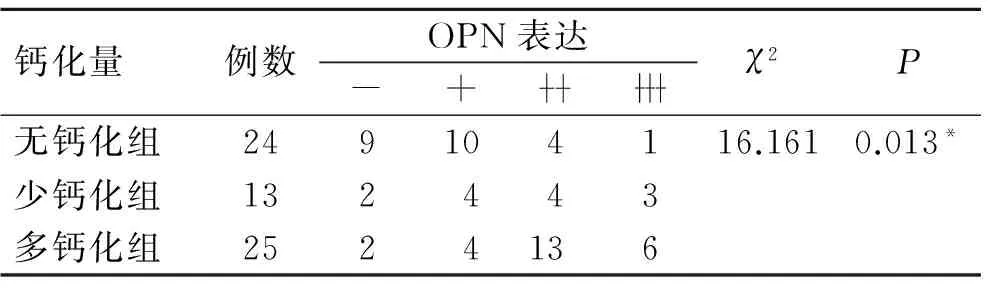
钙化量例数OPN表达-+χ2P无钙化组249104116.1610.013*少钙化组132443多钙化组2524136
3组之间两两比较,*P<0.05。
表4 OPN蛋白的表达与乳腺癌微钙化形态之间的关系
Tab.4 The relationship between the expression of OPN protein and the morphology of microcalcification in breast cancer
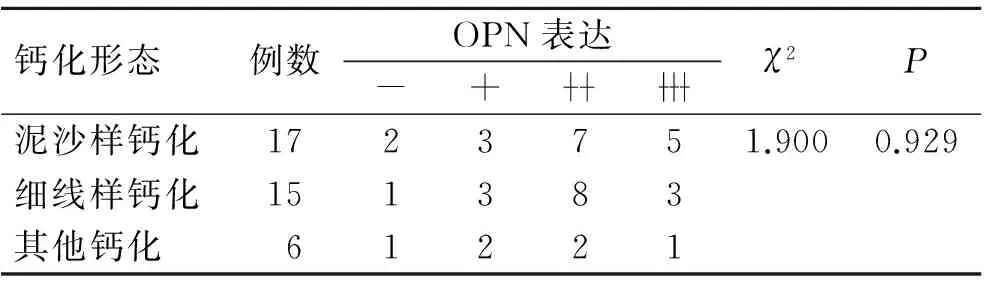
钙化形态例数OPN表达-+χ2P泥沙样钙化1723751.9000.929细线样钙化151383其他钙化61221
3 讨 论
乳腺癌是严重危害妇女身体健康的常见肿瘤之一,微钙化在乳腺癌特别是早期癌的诊断中具有重要的参考价值[2-3]。近年来,随着数字化技术的运用和改进,乳腺癌钼靶 X线图像的对比度和清晰度明显提高,尤其对微钙化的显示,优于其他影像检查方法。微钙化的数量、形态、分布特征是早期、无创评估乳腺癌的生物学行为和预后的重要指标,这已是乳腺影像诊断的共识。自1951年发现微钙化与乳腺癌密切相关以来,对于微小钙化与乳腺癌关系的研究一直没有停止[2]。明确乳腺癌微钙化的分子形成机制将为预测和治疗乳腺癌提供重要线索和依据。
传统认为乳腺癌微钙化是一种营养不良性钙化,可能是癌组织局部坏死碎裂、碱性磷酸酶增多引起的,是一个被动退化的过程[3]。然而近年来,随着影像学、病理学以及分子生物学的发展,研究显示乳腺组织钙化可能是一个由多种与钙化有关的蛋白和细胞因子参与的组织异位钙化的主动过程[2-3]。
Runx2是Runx转录因子家族成员之一[9],其基因定位于人类常染色体6P21,长220 kb,包括8个外显子,并具有由128个氨基酸组成的Runt结构域[9-10]。生理情况下,Runx2不仅在成骨细胞早期增殖过程中起作用,也在成骨细胞的分化成熟过程中发挥重要作用。Runx2作为重要的成骨细胞分化转录因子,参与调控成骨细胞分化过程中的钙化过程,从而对成骨细胞的成熟和稳定起了重要的调节作用[4-7]。 骨桥蛋白OPN基因定位于人类常染色体4q13,是一种由成骨细胞和破骨细胞分泌的含有特异精-甘-天冬氨酸(Arg-Gly-Asp,RGD)序列的磷酸化糖蛋白,参与了骨矿化的形成[3,6]。然而,目前关于Runx2、OPN在人类乳腺癌组织中的表达情况以及其在乳腺癌微钙化形成中的作用尚不清楚。
本研究显示Runx2、OPN蛋白在大多数乳腺癌组织中均有表达,阳性表达率分别为72.6%和79.0%。这与Runx2蛋白在其他肿瘤如骨肉瘤、脑胶质瘤和甲状腺癌组织中的阳性表达率相似[11-13],也与杨光等[3]关于OPN在乳腺癌组织中阳性表达率约87.1%的报道接近。Runx2、OPN在肿瘤组织的高表达提示Runx2、OPN可能参与调控肿瘤的生物学行为。ONODER[14]以及FERRARI等[15]曾报道Runx2调控乳腺癌浸润转移过程,特别在雌激素受体(ER)阴性的乳腺癌。BRAMWELL等[16]也曾报道OPN具有预测乳腺癌预后的价值。
另一方面,我们的研究结果显示,Runx2、OPN蛋白阳性表达与乳腺癌钼靶X线片中微钙化的形成密切相关。随着微钙化从无到有以及由少至多,Runx2阳性表达率呈逐步增高的趋势(P<0.05);OPN阳性表达率也呈逐步增高的趋势(P<0.05)。但Runx2、OPN蛋白表达在泥沙样钙化、细线样钙化以及其他钙化等不同乳腺癌微钙化形态之间未见明显差异。这些研究结果说明Runx2、OPN可能参与或调控乳腺癌组织微钙化的形成过程,Runx2、OPN可能是肿瘤组织异位钙化发生的重要调节因子。因此,深入研究和探讨异位钙化的原因和机制对全面掌握疾病发生、发展以及预后具有重要意义。Runx2、OPN在乳腺癌组织中的表达及其与微钙化的关系对早期评估乳腺癌生物学行为具有一定的临床参考价值。
[1] 赵平,陈万青. 2010中国肿瘤登记年报[M]. 北京:军事医学科学出版社,2010:60-61.
[2] CRAFT M, BICKNELL AM, HAZAN GJ, et al. Microcalcifications detected as an abnormality on screening mammography: outcomes and followup over a five-year period[J]. Int J Breast Cancer, 2013:458540.
[3] 杨光,张祥宏,张静,等. 乳腺癌组织中骨桥蛋白和骨连接蛋白的表达及其与微钙化形成的关系[J]. 中华放射学杂志, 2006, 40(9):953-956.
[4] MARTIN JW, ZIELENSKA M, STEIN GS, et al.The role of RUNX2 in osteosarcoma oncogenesis[J]. Sarcoma, 2011:282745.
[5] OLFA G, CHRISTOPHE C, PHILIPPE L, et al. RUNX2 regulates the effects of TNFalpha on proliferation and apoptosis in SaOs-2 cells[J].Bone, 2010, 46(4):901-910.
[6] WANG DC, WANG HF, YUAN ZN. Runx2 induces bone osteolysis by transcriptional suppression of TSSC1[J]. Biochem Biophys Res Commun, 2013, 438(4):635-639.
[7] DALLE CARBONARE L, INNAMORATI G, VALENTI MT. Transcription factor Runx2 and its application to bone tissue engineering[J]. Stem Cell Rev, 2012, 8(3):891-897.
[8] ENDO T, OHTA K, KOBAYASHI T. Expression and function of Cbfa-1/Runx2 in thyroid papillary carcinoma cells[J]. J Clin Endocrinol Metab, 2008, 93(6):2409-2412.
[9] BAE SC, LEE YH. Phosphorylation, acetylation and ubiquitination: the molecular basis of RUNX regulation[J]. Gene, 2006, 366(1):58-66.
[10] 张媛,闫玉仙. Runx2及相关骨科疾病研究进展[J]. 武警医学院学报, 2010, 19(11):914-917.
[11] 闵大六,沈赞,林峰,等. Runx2和Ezrin基因在骨肉瘤组织中的表达及其临床意义[J].中国癌症杂志, 2012, 22(9):685-688.
[12] 陈锋,袁先厚,江普查. Runx2及Galectin-3在脑胶质瘤中的表达及其临床意义[J]. 武汉大学学报, 2010, 31(2):200-203.
[13] NIU DF, KONDO T, NAKAZAWA T, et al. Transcription factor Runx2 is a regulator of epithelial-mesenchymal transition and invasion in thyroid carcinomas[J]. Lab Invest, 2012, 92(8):1181-1190.
[14] ONODERA Y, MIKI Y, SUZUKI T, et al. Runx2 in human breast carcinoma: its potential roles in cancer progression[J]. Cancer Sci, 2010,101(12):2670-2675.
[15] FERRARI N, MCKONALD L, MORRIS JS, et al. RUNX2 in mammary gland development and breast cancer[J]. J Cell Physiol, 2013, 228(6):1137-1142.
[16] BRAMWELL VH,DOIG GS,TUCK AB,et al. Serial plasma osteopontin levels have prognostic value in metastatic breast cancer[J]. Clin Cancer Res, 2006, 12(11 Pt1):3337-3343.
(编辑 国 荣)
The expressions of Runx2 and OPN protein in human breastcancer tissue and their association with microcalcification
LIANG Xiao-yan1, MA Shao-jun1, WANG Yuan2, KANG Xiao-li1,WANG Tao1, HUANG Fan-li1, WANG Hong3
(1. Department of Radiology; 2. Department of Pathology; 3. Department ofSurgical Oncology, Shaanxi Provincial People Hospital, Xi’an 710068, China)
Objective To explore the expressions of Runx2 and osteopontin (OPN) in human breast cancer tissue and their association with the formation of microcalcification. Methods The expressions of Runx2 and OPN were detected in breast cancer tissue of 62 cases by immunohistochemical method. Then the 62 cases were divided into three groups: non-microcalcification, mild-microcalcification and high-microcalcification groups according to the amount of microcalcification shown on mammography in breast cancer. The association of Runx2 and OPN expressions with microcalcification was further studied. Results The positive expression rate of Runx2 and OPN in human breast cancer tissue was 72.6% and 79.0%, respectively. The positive expression of Runx2 and OPN proteins was significantly correlated with the amount of microcalcification, but not with the morphology of microcalcification in breast cancer tissue. The positive rate of Runx2 and OPN was gradually elevated with the increase in the amount of microcalcification (χ2=15.686,P<0.05;χ2=16.161,P<0.05), respectively. Conclusion Runx2 and OPN proteins are highly expressed in human breast cancer tissue and they may participate in the process of microcalcification formation in breast cancer.
breast cancer; Runx2; osteopontin (OPN); immunohistochemistry; microcalcification; molybdenum target
2014-01-06
2014-03-22
陕西省科学技术研究发展计划项目(No.2013K12-03-19) Supported by the Science and Technology Research Development Plan Projects of Shaanxi Province (No.2013K12-03-19)
梁晓燕(1971-),女(汉族),副主任医师. 研究方向:X线诊断. E-mail: liangxiaoyan197101@163.com
时间:2014-09-16 11∶36 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140916.1136.006.html
R737.9
A
10.7652/jdyxb201406020

