观察脑啡肽在大鼠缺血再灌注脑组织中的表达特点
吴海琴,李燕玲,邵智星,王虎清,高 震,李 鹏,任宏伟,张 萌
(1. 西安交通大学医学院第二附属医院神经内科,陕西西安 710004;2. 西安市第九人民医院神经内科,陕西西安 710054)
◇基础研究◇
观察脑啡肽在大鼠缺血再灌注脑组织中的表达特点
吴海琴1,李燕玲1,邵智星2,王虎清1,高 震1,李 鹏1,任宏伟1,张 萌1
(1. 西安交通大学医学院第二附属医院神经内科,陕西西安 710004;2. 西安市第九人民医院神经内科,陕西西安 710054)
目的 观察大脑中动脉缺血再灌注大鼠脑皮层和海马CA1区脑啡肽的表达,探讨缺血时间和再灌注时间的改变对脑啡肽含量、分布的影响。方法 56只雄性SD大鼠,随机分为7组,通过线栓法制作双侧大脑中动脉栓塞大鼠模型,在预定的时间点取脑组织固定,进行免疫组化及免疫荧光染色评估脑组织中脑啡肽的表达。结果 假手术组与实验组皮层、海马CA1区均可见脑啡肽阳性表达及脑啡肽阳性细胞。实验组皮层及海马CA1区脑啡肽的含量与假手术组比较从再灌注8 h后开始增加,24 h增加明显,且缺血100 min组脑啡肽含量较缺血30 min组增加明显(P<0.05)。实验组海马CA1区阳性细胞数与假手术组比较无明显差异(P>0.05),皮层内脑啡肽阳性细胞数实验组在再灌注8 h开始增加,24 h增加明显,且缺血100 min组脑啡肽阳性细胞数较缺血30 min组增加明显(P<0.05)。结论 皮层和海马CA1区脑啡肽的表达随缺血时间和再灌注时间延长而增加;皮层内脑啡肽表达的增加既包括脑啡肽总含量的增加,也包括脑啡肽阳性细胞数的增加,而海马CA1区仅仅表现为脑啡肽总含量的增加。
脑啡肽;缺血/再灌注;神经保护;大鼠
世界卫生组织统计,全世界每5秒钟就会有一个人罹患卒中,每天大约有500万人死于脑血管病[1-4]。我国2004~2005年完成的全国第3次死因回顾抽样调查报告显示,脑血管病已跃升为国民死因的首位[5]。其中,缺血性卒中占全部脑卒中的80%左右。ASTRUP于1977年首次表述了缺血性卒中过程中缺血半暗区的存在[6]。1981年ASTRUP将缺血半暗区的概念具体为:围绕在梗死灶周围的缺血脑组织,处于电衰竭与能量衰竭之间,其结构尚且完整,但功能受到一定程度的损害,如果及时恢复灌注,则能够恢复其功能。缺血半暗带的提出为缺血性脑卒中的治疗提供了理论依据,即关键是如何最大限度的防止神经元死亡,挽救半暗区神经细胞,缩小梗死范围[7],促进神经元功能恢复,减轻遗留的神经功能缺损。因此,神经保护治疗也一直是缺血性卒中研究的重点之一。脑啡肽(enkephalin, ENK)作为一种内源性阿片样物质,已经被证实具有镇痛、调节免疫、调节细胞增殖、抗肿瘤等多种作用。已有研究证明激活δ阿片受体可以对抗缺血缺氧损伤,防止中枢神经元死亡。这种保护机制目前尚未明确,可能与激活某些信号通路、稳定缺血缺氧时的离子平衡有一定关系[8-14]。同时,有学者尝试给予实验动物一种人工合成脑啡肽(D-Ala2-D-Leu5-enkephalin, DADLE),发现同样可以产生神经保护作用[14-16]。因此,本实验选用SD大鼠制作大脑中动脉缺血再灌注模型,通过免疫组织化学和免疫荧光方法来观察内源性脑啡肽在脑缺血再灌注损伤过程中的表达情况,并比较不同缺血和不同再灌注时间对脑啡肽表达的影响。
1 材料与方法
1.1 实验动物 健康纯种Sprague-Dawley大鼠,雄性,体质量250~280g,由西安交通大学医学院实验动物中心提供。
1.2 主要仪器和试剂 Leica/CM1900Leica/CM1900冰冻切片机为德国徕卡(leica)公司生产,Nikon/Ti-E荧光倒置显微镜为日本尼康公司生产。Met/Leu-enkephalin单克隆抗体购自美国Santa Cruz公司;二抗试剂盒、DAB试剂盒、FIFC标记山羊抗小鼠IgG和山羊血清封闭液购自北京中杉金桥公司。
1.3 实验方法
1.3.1 动物分组 健康雄性SD大鼠56只(体质量250~300 g,购于西安交通大学医学院实验动物中心),随机分7组,包括假手术组(对照组)、栓塞30 min后再灌注4 h组(实验组A1)、栓塞30 min后再灌注8 h组(实验组A2)、栓塞30 min后再灌注24 h组(实验组A3)、栓塞100 min后再灌注4 h组(实验组B1)、栓塞100 min后再灌注8 h组(实验组B2)、栓塞100 min后再灌注24 h组(实验组B3),每组8只。
1.3.2 模型制备 使用改良LONGA[17]法制备大鼠双侧大脑中动脉栓塞模型(MCAO),具体操作步骤为:经腹腔注射100 g/L水合氯醛(剂量为0.3~0.35 mL/100 g),麻醉完全,仰卧位固定于手术台上,沿颈前正中线切开皮肤,完全暴露游离双侧颈总动脉(common carotid artery, CCA)、颈内动脉(internal carotid artery, ICA)、颈外动脉(external carotid artery, ECA)。眼科剪在CCA上剪一小口,将线栓插入ICA,继续向前推进,遇到阻力后停止。实验组A和B分别在栓塞30、100 min取出栓子恢复灌注。假手术组不插线栓。按照LONGA评分方法[17]进行评分,得分≥1分者判断为模型制备成功。解剖发现蛛网膜下腔出血或无神经功能缺损症状体征者(0分)均视为模型制作失败,不纳入实验。
1.3.3 组织标本采集 选择模型制备成功的大鼠,分别在再灌注4、8、24 h后麻醉灌注断头取脑。具体过程:经腹腔注射100 mL/L水合氯醛(剂量为0.3~0.35 mL/100 g),麻醉完全,剪开腹部皮肤,暴露剑突,沿剑突两侧外缘剪断肋骨,暴露心脏。从大鼠左心室插入输液针直达主动脉弓,剪开右心耳,注入生理盐水。待流出液体变清,改为注入40 g/L多聚甲醛至肢体僵硬。断头取脑,将脑组织置于40 g/L多聚甲醛中放入4 ℃冰箱过夜。之后将脑组织置于300 g/L蔗糖溶液直至沉底,取出保存于-80 ℃冰箱中备用。
1.3.4 组织切片制备 用OTC包埋剂包埋固定脱水的脑组织,使用Leica/CM1900冰冻切片机将脑组织沿冠状面切成厚度10μm的切片。组织切片置于-20 ℃冰箱保存。
1.3.5 免疫组化及免疫荧光染色检测脑组织中ENK的表达 具体步骤:①固定,4 ℃丙酮固定20 min;②封闭,0.01 mol/LPBS缓冲液加热95 ℃ 20 min,去离子水孵育,滴加山羊血清工作液;③加双抗,先后滴加一抗工作液、二抗工作液,免疫组化继续滴加辣根酶标记链霉卵白素工作液;④显色,免疫组化制片滴加DAB显色剂显色约6 min,苏木素复染30 s,10 mL/L盐酸乙醇分化,迅速氨水反蓝;⑤封片,免疫组化采用乙醇脱水、二甲苯透明、中性树胶封片,免疫荧光滴加缓冲甘油后盖玻片封片;⑥阴性对照,PBS缓冲液代替一抗,其他实验的操作步骤同前。
1.3.6 图像分析 采用Image-Pro Plus 6.0系统对免疫荧光染色及免疫荧光结果进行分析,检测ENK的表达。从每张切片中选择5个视野,各个视野相互不重叠,免疫组化切片计算每个视野的平均吸光度值,免疫荧光染色计算每个视野的平均阳性细胞数。
2 结 果
2.1 各组大鼠皮层及海马CA1区脑啡肽含量的变化 ENK阳性细胞表现为胞质呈棕黄色,胞核呈蓝色。假手术组及各个实验组大鼠皮层及海马CA1区均可见脑啡肽阳性细胞,其中皮层内阳性细胞呈点状散在分布,海马CA1区阳性细胞排列紧密,呈条带状分布。实验组中,皮层及海马CA1区再灌注4 h时脑啡肽的含量与假手术组比较无明显改变(P>0.05),再灌注8 h后开始增加,24 h增加明显;再灌注时间相同时,缺血100 min脑啡肽含量较缺血30 min增加明显(P<0.05,表1)。
2.2 各组大鼠皮层及海马CA1区脑啡肽的表达 ENK免疫荧光阳性细胞表现为胞质呈亮绿色,胞核不着色。假手术组及各个实验组大鼠大脑皮层及海马CA1区均可见脑啡肽阳性细胞分布,其中皮层内阳性细胞呈点状散在分布,海马CA1区阳性细胞排列紧密,呈条带状分布(图1、图2)。各个实验组海马CA1区ENK阳性表达与假手术组比较无统计学差异(P>0.05)。实验组皮层内脑啡肽阳性细胞数再灌注4 h与假手术组比较无明显差别(P>0.05),8 h开始增加,24 h时增加明显。再灌注时间相同时,缺血100 min脑啡肽阳性细胞数较缺血30 min增加明显(P<0.05,表2)。
表1 各组大鼠皮层及海马CA1区脑啡肽含量的比较

Tab.1 The expression of enkephalin in rat cortex and hippocampus CA1 area (±s)
与假手术组相比,*P<0.05;相同缺血时间不同再灌注时间组间比较,△P<0.05;相同再灌注时间不同缺血时间组间比较,#P<0.05。
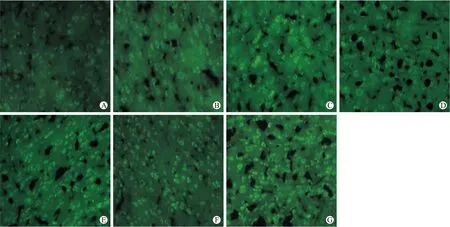
图1 ENK阳性细胞在皮层的表达
Fig.1 The expression of ENK positive cell in cerbral cortex of each group
A~G:分别显示的是假手术组、实验组A1~3、B1~3皮层内脑啡肽阳性细胞的表达。
3 讨 论
大脑中动脉(MCA)是人群缺血性脑卒中的好发部位。由于大鼠脑血管结构与人类较为接近,神经系统与人类相似,且具有价格低廉、变异性小等诸多优点,大鼠MCAO模型被认为是局灶性缺血的标准动物模型[18]。目前,Wistar-Kyoto大鼠和Sprague-Dawley大鼠是我国最常用的鼠种,SD大鼠梗死灶较恒定,变异系数更小,且已有大量相关资料可以提供参考,所以本实验选用SD大鼠制作缺血性脑卒中的实验动物模型。LONGA评分标准广泛应用于神经功能缺损,是大鼠MCAO模型评价的常用客观评价标准。有研究证明,LONGA评分与实际脑损伤大小并不能完全对应。但在本实验中,主要观察不同缺血再灌注脑组织病灶内脑啡肽表达的变化,而与神经功能恢复等无直接关系。所以,LONGA评分阳性者(即MCAO造模成功)均纳入本实验。
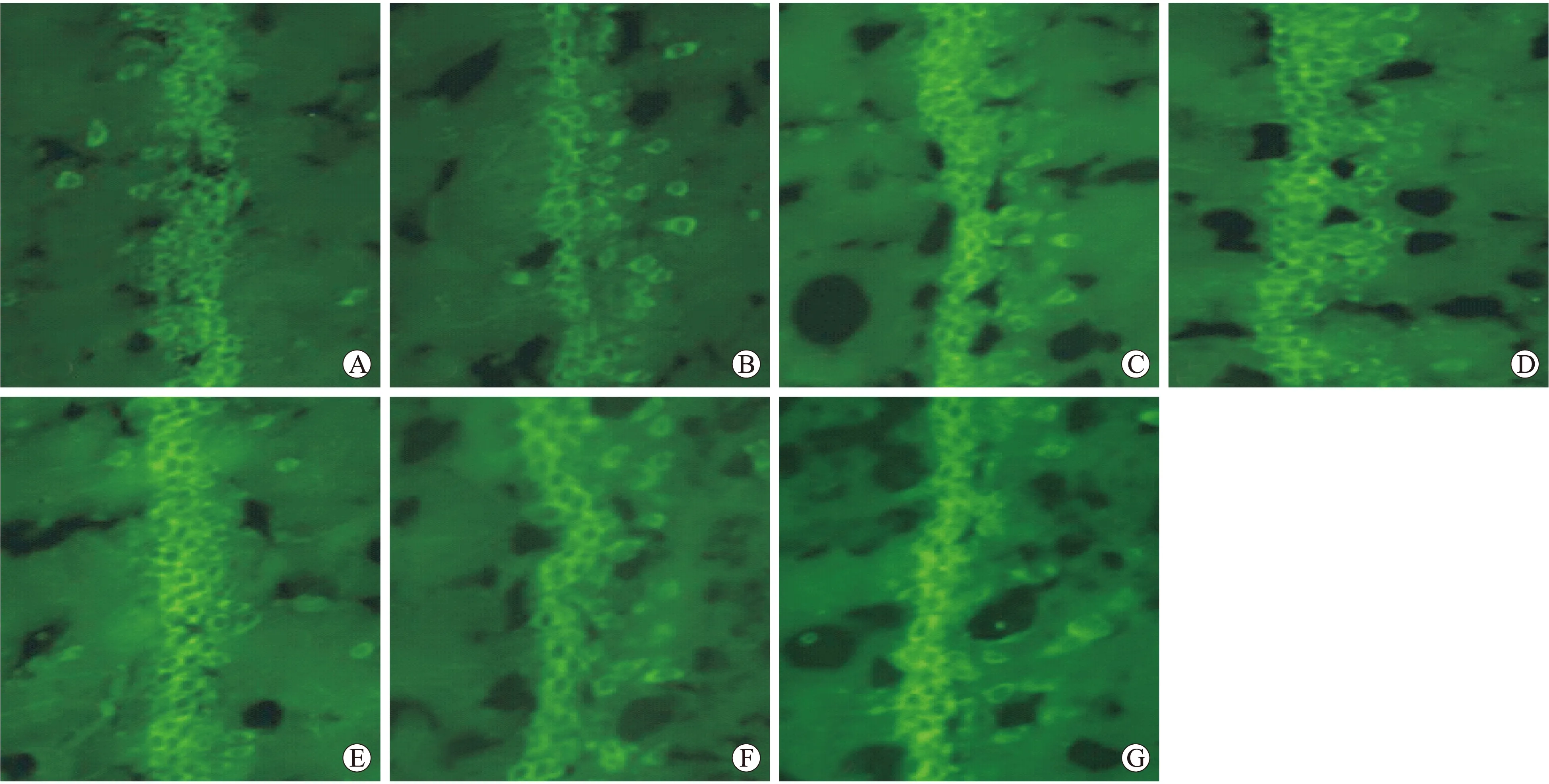
图2 ENK阳性细胞在海马CA1区的表达
Fig.2 The expression of ENK positive cells in hippocampus CA1 area
A~G:依次显示假手术组、实验组A1~3、B1~3海马CA1区脑啡肽阳性细胞的表达。
表2 各组大鼠皮层及海马CA1区内脑啡肽阳性细胞的表达

Tab.2 The expression of enkephalin positive cells in rat cortex and hippocampus CA1 area (±s)
与假手术组比较,*P<0.05;相同缺血时间不同再灌注时间组间比较,△P<0.05;相同再灌注时间不同缺血时间组间比较,#P<0.05。
中枢神经系统不同部位神经元对缺血损伤的耐受性不同,人们把这种特点称为选择易损性。以往研究发现,大脑皮层、海马CA1区对单纯性缺血损伤有很高的选择易损性,而对于缺血再灌注损伤来说,海马CA1区选择易损性则最高[19]。因此,本实验选择皮层及海马CA1区两个部位来观察缺血再灌注损害过程中脑啡肽表达的变化情况。既往免疫组织化学研究表明,脑啡肽在纹状体、下丘脑前区、中脑中央灰质、杏仁核等脑区含量最高,脑干网状结构、脊髓、延髓三叉神经脊束胶状质、孤束核、第四脑室底等处均有密集分布。本实验通过免疫组织化学及免疫荧光的方法对大脑皮层及海马CA1区内脑啡肽的分布进行研究,证明脑啡肽在大脑皮层及海马CA1区存在,进一步支持了脑啡肽在神经系统中广泛存在的论点。免疫组化结果显示,实验组中皮层及海马CA1区再灌注4 h时脑啡肽的含量与假手术组比较无明显改变,再灌注8 h后开始增加,24 h增加更明显,说明大鼠脑组织缺血再灌注损伤会导致损伤部位脑啡肽含量增加。不同缺血时间比较发现,再灌注时间相同的情况下,缺血100 min脑啡肽含量高于缺血30 min,说明缺血时间越长脑损伤越严重,脑啡肽含量增加越明显。免疫荧光结果显示,海马CA1区脑啡肽阳性细胞数在各实验组和假手术组之间无明显差异。在皮层脑啡肽表达的变化趋势与免疫组化结果相似,再灌注4 h时与假手术组比较无明显改变,再灌注8 h后开始增加,24 h增加更加明显。免疫荧光结果显示,海马CA1区脑啡肽阳性细胞呈条带状分布,排列紧密,皮层中阳性细胞点状散在分布。由此可以推断,在缺血再灌注刺激下,海马CA1区可以产生脑啡肽的细胞的活性明显增加,而皮层内部分本来不产生脑啡肽的细胞也可以转化并加工合成脑啡肽。顾洋等[20]研究神经元转录过程中人工合成脑啡肽在体外培养条件下能够可逆地、无损伤地抑制大鼠原代皮层神经元转录,而且被抑制的神经元各项生理活动均受到抑制,细胞代谢水平也明显降低,但不会造成神经元死亡[21]。而且,越来越多的动物实验证明脑啡肽具有出色的神经保护作用。本实验可以清楚地看到,在缺血再灌注早期(4 h以内),病灶处脑啡肽的含量的增加无明显统计学意义。所以,我们推测在大脑缺血再灌注的早期适量给予人工脑啡肽保护神经细胞,对于减轻缺血再灌注损伤及神经系统功能的恢复应该具有积极的作用。
总之,我们清楚地发现,脑啡肽广泛存在于脑组织中,并在缺血再灌注损伤中发挥肯定的脑保护作用,但在不同部位脑组织中其表达形式也不尽相同。我们有理由认为,无论脑啡肽的产生、脑缺血/再灌注损伤还是两者之间的相互作用,都可能涉及多种信号转导通路、离子平衡的改变和细胞毒性物质作用的复杂的病理生理过程,其具体机制仍有待进一步的研究。
[1] GUO Y, WANG L. An opioid growth factor receptor (OGFR) for [Met(5)]-enkephalin in Chlamys farreri[J]. Fish Shellfish Immun, 2013, 34(5):1228-1235.
[2] YOUNG KC, JAIN A, JAIN M, et al. Evidence-based treatment of carotid artery stenosis[J]. Neurosurg Focus, 2011, 30(6):E2.
[3] O’DONNELL M, XAVIER D, DIENER C, et al. Rationale and design of INTERSTROKE: a global case-control study of risk factors for stroke[J]. Neuroepidemiology, 2010, 35(1):36-44.
[4] 常明则,田晔,乔琳,等. 葛根素预处理对大鼠局灶性脑缺血再灌注损伤的保护作用及时间窗研究[J]. 吉林大学学报:医学版, 2014, 40(1):23-26.
[5] 陈竺. 全国第三次死因回顾抽样调查报告[M]. 北京:中国协和医科大学出版社, 2008:1-214.
[6] ASTRUP J, SIESJO BK. Thresholds in cerebral ischemia:the ischemic penumbra[J]. Stroke, 1981, 12:723-725.
[7] BARON JC. Mapping the ischemic penumbra with PET: Implications for acute stroke treatment[J]. Cerebrovasc Dis, 1999, 9(4):193-201.
[8] 展淑琴,郭新奎. 脑缺血大鼠脑皮层中强啡肽A(1~13)的经时表达及脑含水量的变化[J]. 西安交通大学学报:医学版, 2009, 30(2):145-148.
[9] COHEN MV, PHILIPP S, KRIEG T, et al. Preconditioning-mimetics bradykinin and DADLE activate PI3-kinase through divergent pathways[J]. J Mol Cell Cardiol, 2007, 42(4):842-851.
[10] GARCIA-FUSTER MJ, FERRER-ALCON M, MARTIN M, et al. Effects of constitutive deletion of opioid receptors on the basal densities of Fas and Fas-associated protein with death domain (FADD) in the mouse brain: A δ-opioid tone inhibits FADD[J]. Eur Neuropsychopharmacol, 2007, 17(5):366-374.
[11] ALVARO BARTOLOME M, ESTEBAN S, GARCIA GUTIERREZ MS, et al. Regulation of Fas receptor/Fas-associated protein with death domain apoptotic complex and associated signalling systems by cannabinoid receptors in the mouse brain[J]. Brit J Pharmacol, 2010, 160(3):643-656.
[12] CHAO D, XIA Y. Ionic storm in hypoxic/ischemic stress: can opioid receptors subside it?[J]. Prog Neurobiol, 2010, 90(4):439-470.
[13] 胡伊乐,曹靖,任秀花,等. pEGFP-C3-PENK/NIH3T3表达的脑啡肽对神经细胞PKA表达的影响[J]. 郑州大学学报:医学版, 2010, 45(2):269-272.
[14] DUAN YL, WANG SY, ZENG QW, et al. Astroglial reaction to delta opioid peptide [D-Ala2, D-Leu5] enkephalin confers neuroprotection against global ischemia in the adult rat hippocampus[J]. Neuroscience, 2011, 192:81-90.
[15] 杨柳青,符岳,方向韶,等. δ阿片受体激动剂DADLE对大鼠皮质神经元缺氧损伤的影响[J].中华急诊医学杂志, 2009, 18(1):34-37.
[16] 韩洁韵,梁子敬,范彦琦. δ阿片受体激动剂DADLE对全脑缺血-再灌注大鼠血清S-100B蛋白的影响[J]. 中华急诊医学杂志, 2008, 17(6):618-621.
[17] LONGA EZ, WEINSTEIN PR, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[18] FISHER M, SCHAEBITZ W. An overview of acute stroke therapy: Past, present, and future[J]. Arch Intern Med, 2000, 160(21):3196-3206.
[19] NEMETHOVA M, DANIELISOVA V, GOTTLIEB M, et al. Post-conditioning exacerbates the Mn-sod immune-reactivity after experimental cerebral global ischemia and reperfusion in the rat brain hippocampus[J]. Cell Biol Int, 2008, 32(1):128-135.
[20] 顾洋,孙柯. Delta阿片受体激动剂DADLE对神经元转录的影响[J]. 实用医学杂志, 2010, 26(24):4466-4468.
[21] 刘学伍,迟兆富,焉传祝. 神经病学新理论新技术[M]. 北京:人民军医出版社, 2009:85-95.
(编辑 韩维栋)
The expression of enkephalin in ischemia reperfusion brain injury in rats
WU Hai-qin1, LI Yan-ling1, SHAO Zhi-xing2, WANG Hu-qing1,GAO Zhen1, LI Peng1, REN Hong-wei1, ZHANG Meng1
(1. Department of Neurology, the Second Affiliated Hospital, Medical School of Xi’an JiaotongUniversity, Xi’an 710004; 2. Department of Neurology, Xi’an No.9 Hospital, Xi’an 710054, China)
Objective To observe the expression of enkephalin in rat cerebral cortex and hippocampus CA1 area with the middle cerebral artery ischemia injury so as to explore the correlation of ischemia/reperfusion time with the level and distribution of enkephalin. Methods We divided 56 Sprague-Dawley rats randomly into 7 groups. Suture occlusion method was used to establish focal middle cerebral artery (MCAO) and reperfusion models. All the animals were sacrificed and their brains were collected and fixed. Immunohistochemical and immunofluorescence stainings were performed to investigate the expression of enkephalin in brain tissues. Results Both enkephalin and enkephalin positive cells could be found in the cortex and hippocampus CA1 area in the sham and experimental groups. Compared with those in the sham group, the content of enkephalin in the cortex and hippocampus CA1 area in experimental groups increased at 8 h after reperfusion (P<0.05) and significantly increased at 24 h (P<0.05). Compared with that in the 30-min ischemia group, the content of enkephalin in 100-min ischemia group significantly increased (P<0.05). No obvious difference was found between the experimental group and sham group in positive cells of hippocampus CA1 area (P>0.05); however, enkephalin positive cells in the cortex in the experimental group began to increase at 8 h after reperfusion (P<0.05) and significantly increased at 24 h (P<0.05). And 100- min ischemia group had a significant increase in enkephalin positive cells than 30-min ischemia group (P<0.05). Conclusion As ischemia and reperfusion time prolongs, the expression of enkephalin in the cortex and hippocampus CA1 area increases. The increase of enkephalin expression in the cortex involves the increase of both content and positive cells; however, in the hippocampus CA1 area it involves merely content increase.
enkephalin; ischemia reperfusion; neuroprotection; rat
2014-03-08
2014-05-18
国家自然科学基金资助项目(No.81270415) Supported by the National Natural Science Foundation of China (No.81270415)
吴海琴(1960-),女(汉族),主任医师,教授,硕士生导师,主要从事脑血管疾病及老年相关疾病的研究. E-mail: whq60@sohu.com
时间:2014-09-19 17∶10 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140919.1710.006.html
R743.33
A
10.7652/jdyxb201406015

