SLC-Her-2/neu-p53-Fc融合基因重组腺病毒真核表达载体对荷黑色素瘤小鼠的免疫治疗效果
王慰敏,孙文欣,钱海利,王海娟,张叔人,林 晨
(1.西安交通大学医学院第一附属医院妇产科,陕西西安 710061;2.中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室,北京 100061)
◇基础研究◇
SLC-Her-2/neu-p53-Fc融合基因重组腺病毒真核表达载体对荷黑色素瘤小鼠的免疫治疗效果
王慰敏1,2,孙文欣2,钱海利2,王海娟2,张叔人2,林 晨2
(1.西安交通大学医学院第一附属医院妇产科,陕西西安 710061;2.中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室,北京 100061)
目的 扩增纯化携带融合基因SLC-Her-2/neu-p53-Fc(SLC-HP-Fc)的重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体,研究其对荷黑色素瘤小鼠的免疫治疗效果。方法 将重组腺病毒真核表达载体AdEasyTM-SLC-HP-Fc在人胚肾293细胞中扩增、纯化;向小鼠皮下注射表达Her-2/neu-p53融合基因的B16F10-psig-Her-2/neu-p53细胞(B16-HP细胞)建立荷黑色素瘤小鼠模型;将小鼠随机分成对照组、肌肉注射组和皮下注射组,用重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体进行治疗,观察肿瘤生长情况,测定细胞毒性活性、血清p53抗体。结果 纯化后重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体滴度8×108pfu/mL。目的基因SLC-HP在小鼠体内成功表达。重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体高剂量肌肉注射能有效抑制小鼠肿瘤的生长,瘤重与对照组比较差异有统计学意义(P=0.005),抑瘤率达到98.8%,细胞毒性T淋巴细胞(CTL)的特异性杀伤力有明显提高。结论 重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体高剂量肌肉注射能延长出瘤时间,抑制肿瘤的生长。
c-erbB-2;p53;趋化因子SLC;Fc段;重组腺病毒
肿瘤免疫治疗是目前抗肿瘤治疗研究的热点之一。有证据显示,多表位疫苗的效应要优于单一表位疫苗[1-2],因此目前融合基因肿瘤疫苗的研究是肿瘤免疫治疗的研究焦点。本研究探讨携带融合基因SLC-Her-2/neu-p53-Fc(SLC-HP-Fc)的重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体对荷黑色素瘤小鼠的的抗肿瘤作用,为该融合基因应用于临床肿瘤免疫治疗奠定实验基础。
1 材料与方法
1.1 细胞株、病毒、动物 B16F10-psig-Her-2/neu-p53细胞,简写为B16-HP细胞。B16F10为C57BL/6小鼠黑色素瘤细胞系,具有自发肺转移能力;向该细胞转化psig-Her-2/neu-p53质粒,成为B16-HP细胞;培养条件为1640培养基,含100 mL/L小牛血清,200 μg/mL G418,37 ℃、50 mL/L CO2孵箱培养;本实验室冻存。SLC-Her-2/neu-p53-Fc融合基因重组腺病毒真核表达载体(由作者构建),AdEasyTM-con空载腺病毒(本实验室冻存),人胚肾293细胞(本实验室冻存)。C57BL/6小鼠,7~8周龄,雌性,体质量18~22 g,购自中国医学科学院实验动物研究所,合格证号:No.0051714。
1.2 主要试剂 细胞培养基(GIBCO BRL公司),胎牛血清(GIBCO BRL公司),M-MLV逆转录酶(GIBCOBRL公司),TaqDNA聚合酶(TaKaRa生物公司),pfu高保真DNA聚合酶(上海生工),dNTP(Boehringer Mannheim公司),oligo-dT(Promega公司),RNA提取试剂盒(Trizol Reagent Kit)(Life Technologies公司),DNA快速纯化回收试剂盒(博大泰克公司)。p53兔抗人多克隆抗体(Santa Cruz公司),辣根酶标记山羊抗兔IgG(Santa Cruz公司),ECL-Plus Chemiluminescent Detection Kit(Amersharm Pharmacia Biotech),重组人p53蛋白(Santa Cruz公司)。
1.3 PCR引物 检测目的基因SLC-HER2-p53引物(扩增产物1.1 kb):引物上游:5′-CGGTACCACAGACATGGCTCAGTCAC-3′;引物下游:5′-TGATATCTTTCTTGCGGAGATTCTCTTC-3′。本室保存。
1.4 重组腺病毒真核表达载体AdEasyTM-SLC-HP-Fc的扩增及滴度测定 将含有原代重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体的人胚肾293细胞在-80 ℃冻1 h后,37 ℃溶解20 min,反复3次充分裂解细胞,4 ℃、12 000 r/min离心10 min,收集上清再次接种人胚肾293细胞,细胞出现完全病变时离心弃去培养液,细胞团块经少量PBS重悬后于-80 ℃保存。重复以上操作,使重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体在293细胞中不断扩增。将收集的细胞反复冻融裂解,采用氯化铯梯度离心法纯化腺病毒分装到Eppendorf管中,加入100 mL/L甘油,保存于-80 ℃。采用相同的方法将本室保存的AdEasyTM-con转染人胚肾293细胞进行扩增、纯化。采用有限稀释法测定滴度滴度,计算公式如下:病毒滴度(pfu/mL)=(1×104×稀释度×10个病毒/细胞)/0.1 mL(注:公式中假定每个细胞感染10个病毒,在48 h内能够导致细胞病变。)
1.5 荷黑色素瘤小鼠模型的制备
1.5.1 小鼠黑色素瘤细胞B16-HP的培养 已转染重组质粒pisg-Her-2/neu-p53 (psig-HP) 的小鼠黑色素瘤细胞B16-HP的培养:含100 mL/L胎牛血清的完全培养液1640,37 ℃、50 mL/L CO2孵箱培养,每2 d更换1次培养液,用5 g/L胰酶/EDTA消化传代。质粒psig-HP具有新霉素抗性基因,因此培养过程中应用氨基糖苷类抗生素G418保证细胞稳定性,培养过程中G418质量浓度维持200 μg/mL。
1.5.2 荷黑色素瘤小鼠模型的制备 7~8周的C57BL/6小鼠,雌性,体质量18~22 g。所有C57BL/6小鼠的处理都遵循实验动物管理条例。第0天向小鼠右腋下皮下接种3×104个B16-HP细胞。
1.6 重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体免疫治疗荷黑色素瘤小鼠
1.6.1 荷黑色素瘤小鼠肿瘤生长的观测 所有荷黑色素瘤C57BL/6小鼠按照是否给药、所给药物、给药方式[皮下注射(ih)、肌肉注射(im)]及剂量[高剂量(H)1×108pfu、低剂量(L)1×107pfu]不同随机分成9组,分别为对照组(不给药物组)、Ad-SLC-HP-Fc(H)im组、Ad-SLC-HP-Fc(L)im组、Ad-SLC-HP-Fc(H)ih组、Ad-SLC-HP-Fc(L)ih组、Ad-con(H)im组、Ad-con(L)im组、Ad-con(H)ih组、Ad-con(L)ih组,其中考虑到对照组小鼠可能生存期较短,而Ad-SLC-HP-Fc(H)ih组为重点疗效观察组,因此对照组和Ad-SLC-HP-Fc(H)ih组分别为6只小鼠,其余各组分别为5只小鼠。每只小鼠分别于第4天、第8天、第12天按照相应给药方式给药1次,对照组不处理。荷黑色素瘤C57BL/6小鼠动态观察4周,记录出瘤时间,每隔1 d测肿瘤的长径(a)、短径(b),计算肿瘤体积(V=a×b2/2),绘制肿瘤生长曲线。第28天处死小鼠后称量肿块质量,计算重量抑瘤率(对照组平均瘤质量-治疗组肿瘤质量/对照组肿瘤质量)×100%。
1.6.2 C57BL/6小鼠组织SLC-HP-Fc表达的鉴定 两组C57BL/6小鼠,每组5只,分别肌肉注射重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体和AdEasyTM-con 1×108pfu,48 h后,分别取小鼠注射部位周围的肌肉组织约50~100 mg,采用Life Technologies Inc的总RNA提取试剂盒Trizol Reagent提取组织RNA。将提取的RNA进行琼脂糖凝胶电泳,观察18S和28S条带鉴定RNA提取质量。进行反转录PCR,PCR产物经10 g/L琼脂糖凝胶电泳分离。
1.6.3 荷黑色素瘤小鼠脾淋巴细胞CTL杀伤实验 第0天向小鼠右腋下皮下接种3×104个B16-HP细胞后,动物分组、给药方式、剂量、给药时间同上治疗实验。第3次给药24 h后,即第13天,断颈处死小鼠,无菌条件下打开腹腔,取出脾,将脾浸入生理盐水,在80目钢网上轻轻研磨,收集脾细胞。1 500 r/min离心15 min,弃上清。加入红细胞裂解液(Tris-NH4Cl,0.16 mol/L的NH4Cl和0.17 mol/L的Tris按9∶1的比例混合,pH 7.2),作用1 min,迅速加入生理盐水,洗2遍。台盼蓝计数,用含50 mL/L胎牛血清的1640培养基稀释作为效应细胞。
采用Promega公司的CytoTox 96®Non-Radioactive Cytotoxicity Assay试剂盒将效应细胞与靶细胞B16F10-HP以不同的靶效比(40∶1、20∶1、10∶1)进行CTL杀伤活性测定。
1.6.4 荷黑色素瘤小鼠血清抗p53抗体的检测 在病毒治疗后第2周和4周时取小鼠外周血,分离血清,用ELISA法检测荷黑色素瘤小鼠血清抗p53抗体水平。即用重组人p53蛋白包被96孔板(250 ng/0.1 mL/孔)4 ℃过夜。200 mL/L牛血清37 ℃封闭1~1.5 h。除去封闭液,洗涤液(PBS pH 7.4-0.5 g/L Tween 20)洗涤3次,0.2 mL/孔。小鼠血清(一抗)按比例稀释(1∶100),0.1 mL/孔。室温放置1~1.5 h。洗涤液洗3次,0.2 mL/孔。加酶标二抗(羊抗小鼠IgG/辣根酶标记),以1∶1 000稀释加入,0.1 mL/孔,37 ℃放置1.5 h。除去二抗,洗涤液洗3次,蒸馏水洗1次。加底物缓冲液0.2 mL/孔(2 mg OPD邻苯二胺+5 mL底物缓冲液+7.5 μL/H2O2),0.2 mL/孔,37 ℃ 30 min,显色。加入终止缓冲液(2 mol/L H2SO4)0.05 mL/孔,490 nm测A值。
1.7 统计学处理 采用单因素方差分析方法比较28 d处死小鼠后,各组之间、AdEasyTM-SLC-HP-Fc各组之间、AdEasyTM-con各组之间肿瘤体积、瘤重的差异,计算抑瘤率。 采用双因素方差分析方法分别比较靶效比40∶1、20∶1、10∶1时各组之间CTL活性的差异。采用配对样本t检验方法分别比较2周和4周时各组p53抗体水平的差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 AdEasyTM-SLC-HP-Fc和AdEasyTM-con滴度 AdEasyTM-SLC-HP-Fc滴度为8×108pfu/mL,AdEasyTM-con滴度为4×109pfu/mL。
2.2 荷黑色素瘤小鼠肿瘤的生长情况 Ad-SLC-HP-Fc(H)im组出瘤时间较其他组最晚,至实验结束仅有1只小鼠出瘤,4只尚未出瘤,出瘤率20%(图1)。在实验的28 d内动态记录肿瘤体积变化,绘制生长曲线。结果显示,AdEasy-con各组与对照组及AdEasy-con各组之间未见统计学差异(P>0.05),Ad-SLC-HP-Fc(H)im组和Ad-SLC-HP-Fc(H)ih组的肿瘤生长明显慢于其他各组,肿瘤体积与空载腺病毒各组和对照组相比有统计学差异(P<0.05,图2)。第28天处死小鼠后称量瘤体重量,结果显示,各疫苗治疗组的平均瘤重低于其他组。各实验组的抑瘤率及瘤重的比较,其中Ad-SLC-HP-Fc(H)im组瘤重与对照组比较差异有统计学意义(P=0.005),抑瘤率达到98.8%,与Ad-con(H)im组比较差异也有统计学意义(P=0.003,表1)。
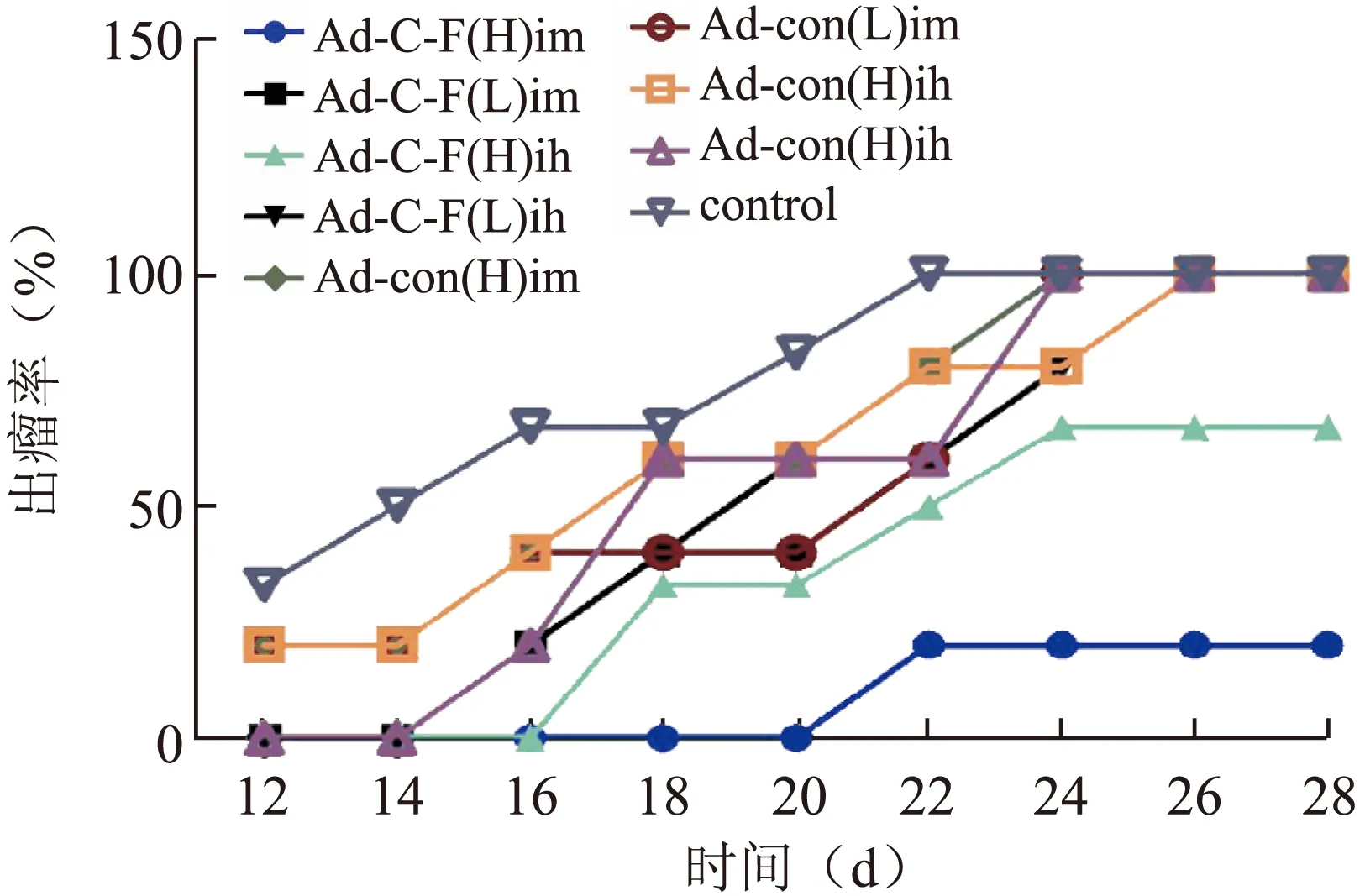
图1 各组小鼠不同时间的出瘤率
Fig.1 Tumor emergence rate at different time in each group of C57BL/6 mice
Ad-C-F:Ad-SLC-HP-Fc。
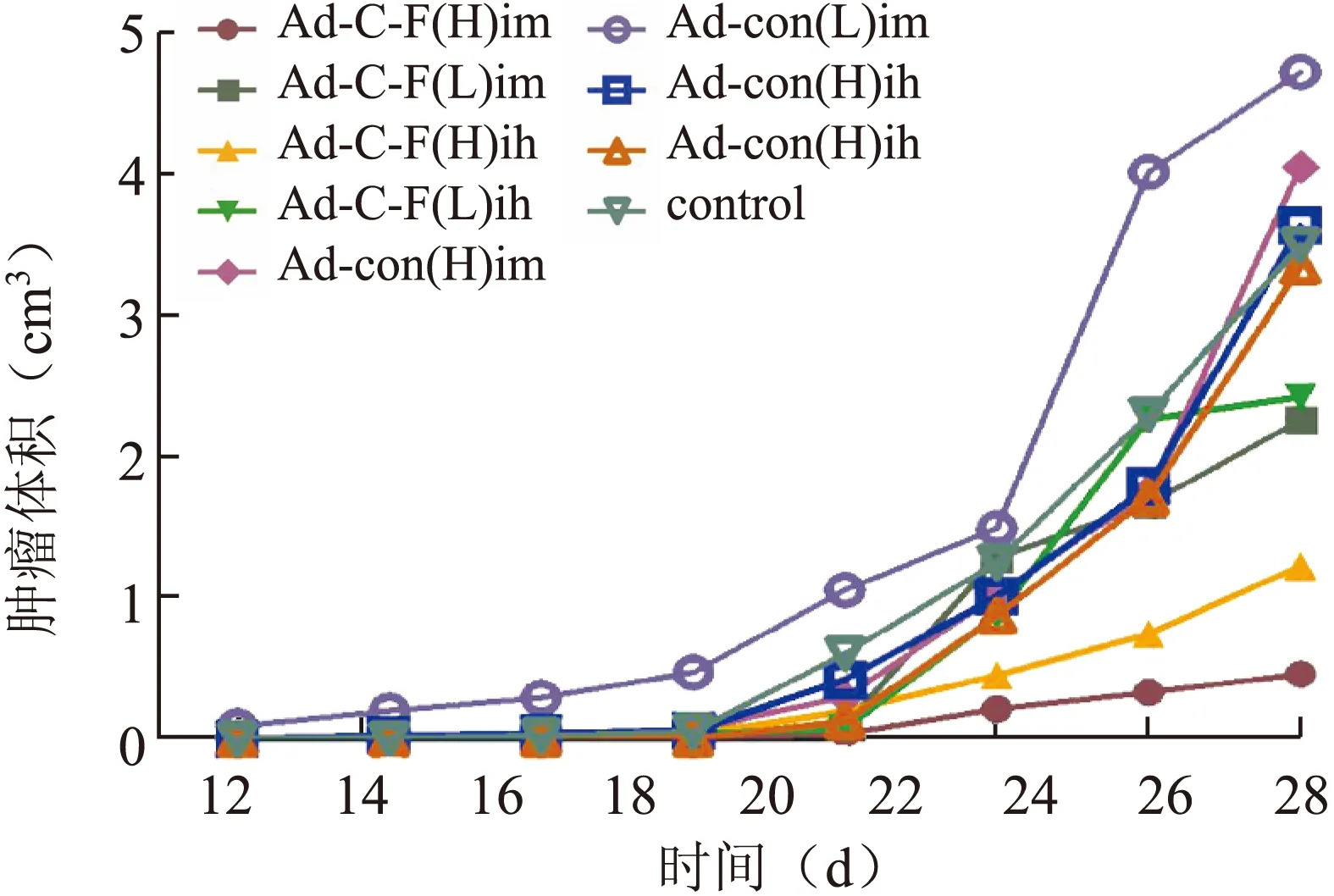
图2 各组小鼠的肿瘤生长情况
Fig.2 Tumor growth in each group of C57BL/6 mice
Ad-C-F:Ad-SLC-HP-Fc。
表1 各组小鼠的抑瘤率比较
Tab.1 Tumor inhibition in each group of C57BL/6 mice
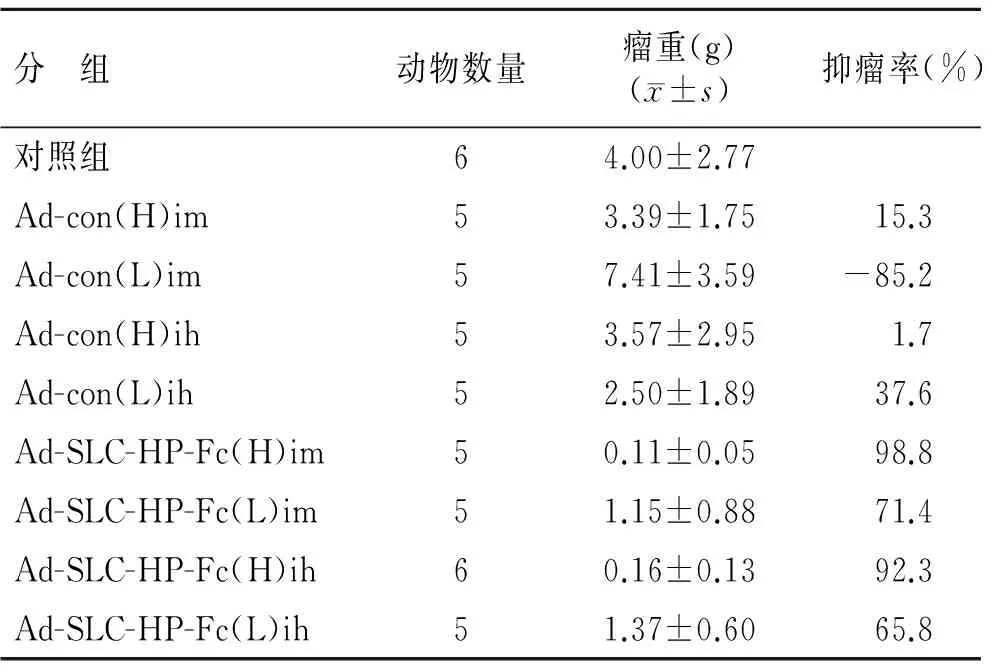
分 组动物数量瘤重(g)(x±s)抑瘤率(%)对照组64.00±2.77Ad-con(H)im53.39±1.7515.3Ad-con(L)im57.41±3.59-85.2Ad-con(H)ih53.57±2.951.7Ad-con(L)ih52.50±1.8937.6Ad-SLC-HP-Fc(H)im50.11±0.0598.8Ad-SLC-HP-Fc(L)im51.15±0.8871.4Ad-SLC-HP-Fc(H)ih60.16±0.1392.3Ad-SLC-HP-Fc(L)ih51.37±0.6065.8
2.3 SLC-HP-Fc能够在C57BL/6小鼠肌肉组织中表达 在两组小鼠分别肌肉注射重组腺病毒和空载腺病毒1×108pfu 48 h后,分别取注射部位周围肌肉组织提取RNA,对提取的RNA进行电泳检测,两组分别可见清晰的18 S和28 S条带,说明RNA提取质量良好(图3)。
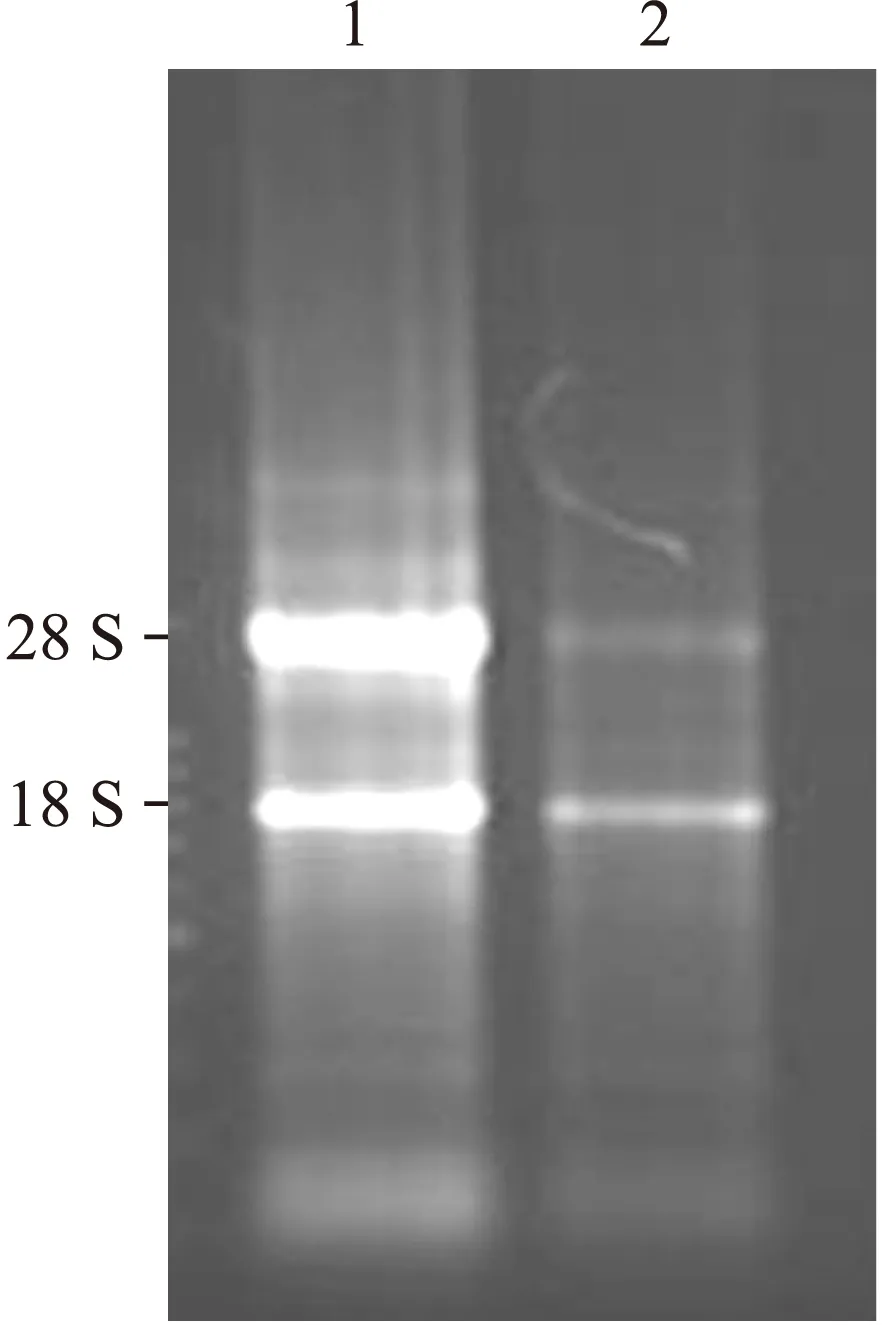
图3 小鼠注射部位周围组织RNA电泳
Fig.3 Electrophoresis of RNA from the tissue of C57BL/6 mice
1: Ad-SLC-HP-Fc im RNA; 2: Ad-con im RNA。
对提取的RNA进行反转录PCR,PCR条件为95 ℃ 5 min→(94 ℃ 30 s→45 ℃ 40 s→72 ℃ 30 s)×2→(94 ℃ 30 s→65 ℃ 40 s→72 ℃ 30 s)×30→72 ℃ 2 min, 目标扩增产物为1.1 kb。扩增后产物经电泳检测,AdEasyTM-SLC-HP-Fc im组可见1.1 kb的SLC-HP目标条带的表达,AdEasyTM-con组未表达(图4)。
2.4 各组荷黑色素瘤小鼠脾淋巴细胞CTL活性 在肿瘤的免疫治疗中,体液免疫并不能彻底消除肿瘤细胞,只有细胞介导的免疫反应,特别是CTL介导的细胞免疫反应才能发挥最根本的作用。因此,我们测定CTL的活性来反映AdEasyTM-SLC-HP-Fc真核表达载体诱导的细胞免疫水平。当靶效比为40∶1、20∶1、10∶1时,重组腺病毒高剂量皮下注射组诱导的CTL活性分别为67.2%、56.3%、32.9%,与其他各组相比没有统计学差异(P>0.05,图5)。
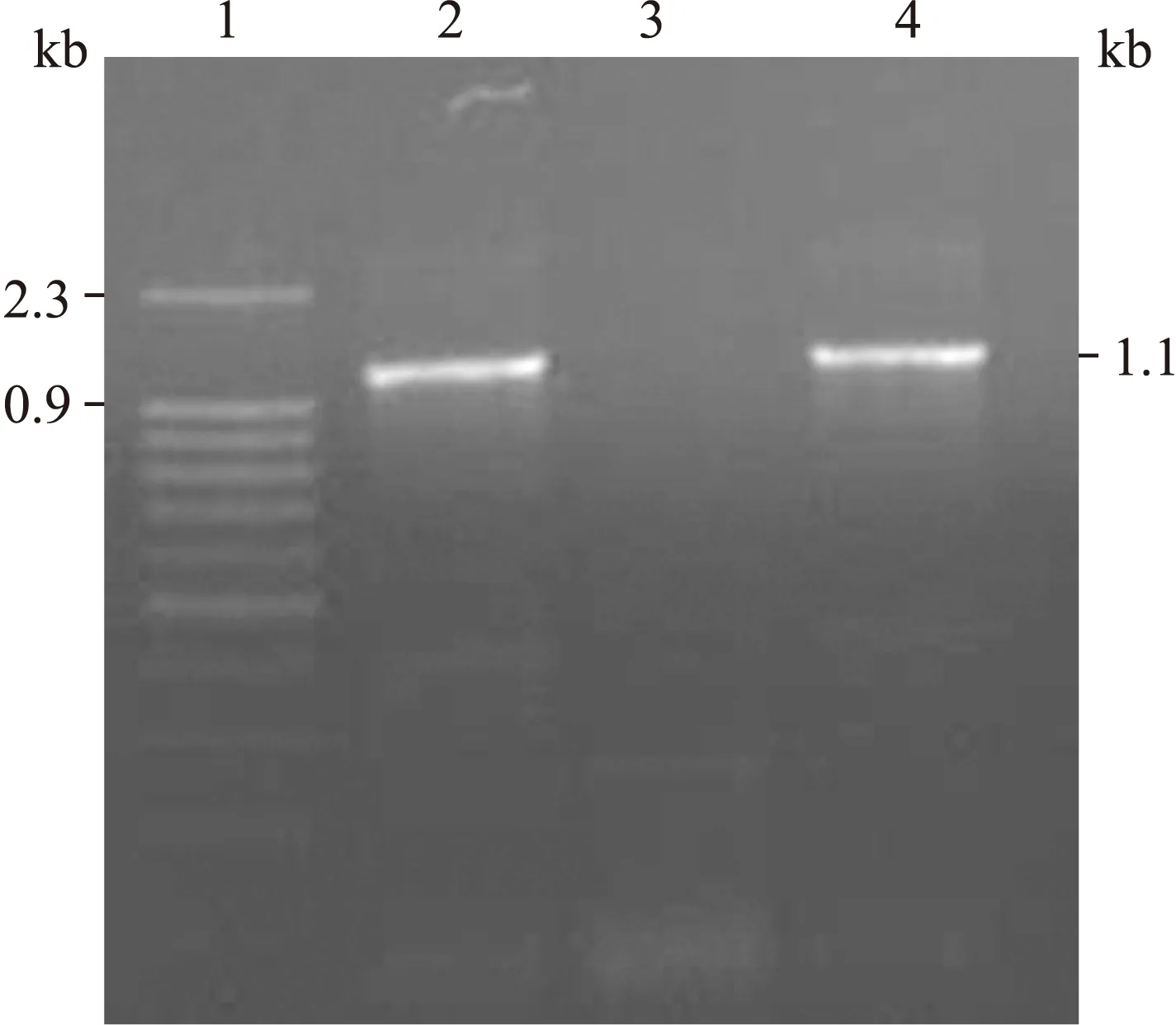
图4 RT-PCR产物的鉴定结果
Fig.4 Identification of the product of RT-PCR by electrophoresis
1: Marker(上样量3 μL);2: Ad-SLC-HP-Fc im RT-PCR产物(上样量6 μL);3: Ad-con im RT-PCR产物(上样量6 μL);4: SLC-HP目的基因阳性对照(上样量2 μL)。
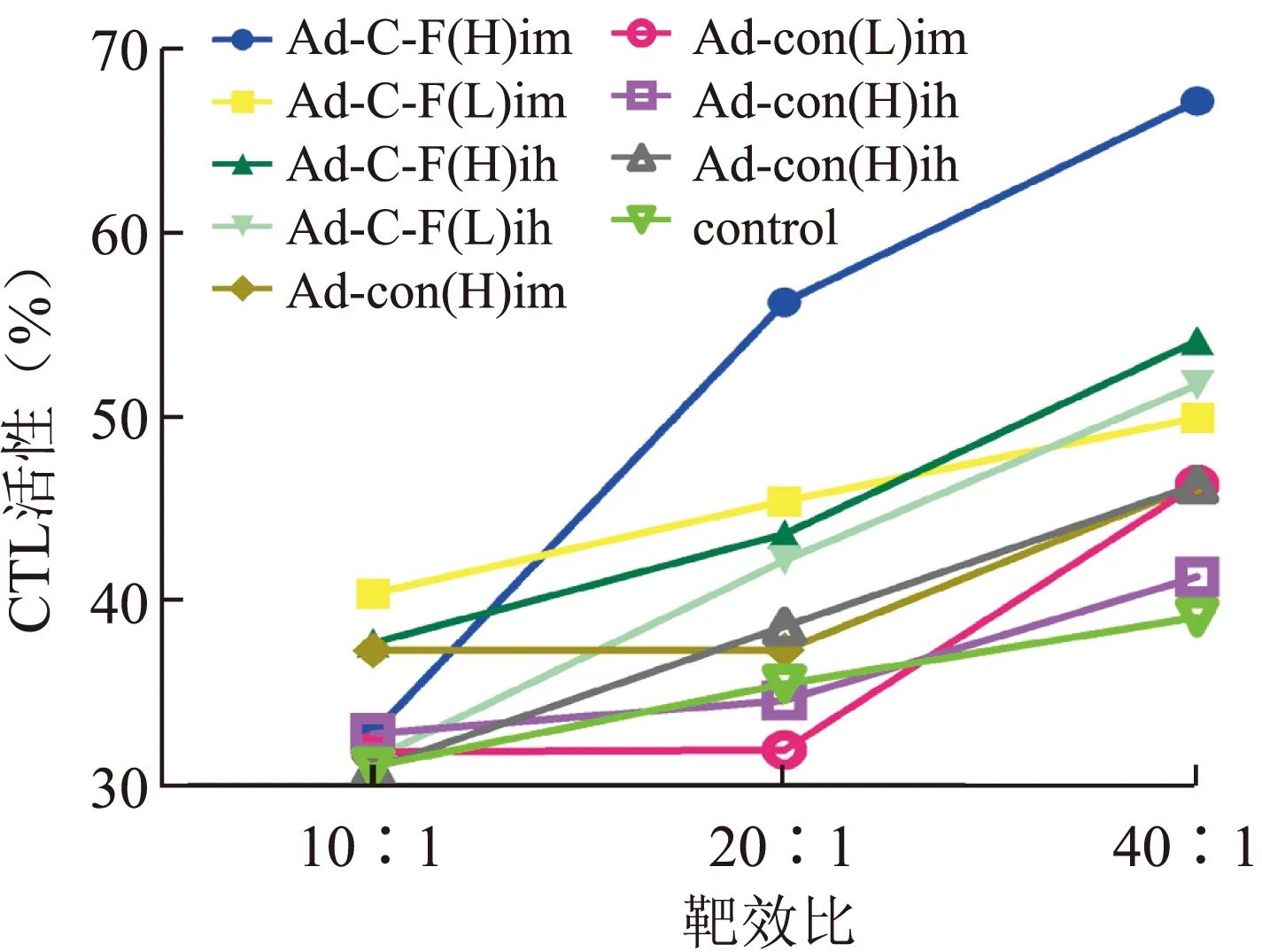
图5 各组小鼠脾细胞CTL活性的比较
Fig.5 CTL activity of the spleen cells in each group of C57BL/6 mice
2.5 荷黑色素瘤小鼠血清抗p53抗体的检测结果 各组小鼠经相应处理后,在2周和4周时取血清,ELISA法检测抗体反应。p53单克隆抗体作为阳性对照,正常小鼠血清作为阴性对照。结果显示,2周和4周时各组的抗体水平没有统计学差异(图6)。
3 讨 论
应用重组腺病毒疫苗对肿瘤进行免疫治疗在给药方式和给药剂量上尚待摸索。有文献报道,重组腺病毒疫苗通过肌肉注射的方式免疫小鼠可以诱导出特异性的体液免疫反应和细胞免疫反应[3-4]。JIANG等[5]实验证实,重组腺病毒皮下注射免疫小鼠也可诱导出特异性的体液免疫反应和细胞免疫反应,而且给药剂量一般在107~108pfu左右即可诱导出小鼠的免疫反应,较其他抑癌基因重组腺病毒瘤内注射的给药量109~1010pfu少1~2个数量级。本研究设计了重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体肌肉注射和皮下注射两种给药方式,低剂量(1×107pfu)和高剂量(1×108pfu)两种给药剂量,并设定了相应的空载腺病毒对照组AdEasyTM-con。AdEasyTM-SLC-HP-Fc高剂量肌肉注射组的出瘤时间明显延迟,出瘤率仅20%;出瘤者肿瘤生长缓慢,肿瘤体积与其他各组比较均有显著差异;瘤重与对照组比较有统计学差异(P=0.005),抑瘤率达到98.8%。与AdEasyTM-con高剂量肌肉注射对照组比较也有统计学差异(P=0.003)。AdEasyTM-SLC-HP-Fc低剂量肌肉注射组出瘤时间虽然并没有明显延迟,肿瘤体积与对照组的差异也没有统计学意义,但是瘤重与对照组比较有统计学差异(P=0.023),抑瘤率也达到了71.4%。AdEasyTM-SLC-HP-Fc高剂量皮下注射组的出瘤时间较空载腺病毒对照组和对照组延迟,至实验结束6只动物中有2只未出瘤,出瘤率为67%;肿瘤生长缓慢,肿瘤体积也与其他各组有显著差异;瘤重与对照组比较有统计学差异(P=0.005),抑瘤率达到92.3%,与AdEasyTM-con高剂量皮下注射对照组比较也有统计学差异(P=0.003)。但AdEasyTM-SLC-HP-Fc皮下注射低剂量组的瘤重与对照组比较则没有统计学差异(P=0.069)。AdEasyTM-SLC-HP-Fc高剂量肌肉注射组与AdEasyTM-SLC-HP-Fc高剂量皮下注射组之间没有统计学差异。这说明,就重组腺病毒疫苗免疫治疗肿瘤的给药途径而言,肌肉注射与皮下注射均有效;就其免疫治疗肿瘤的给药剂量而言,高剂量即1×108pfu效果显著,低剂量即1×107pfu也是有效的,存在着一定的量效关系,即疗效与剂量呈正相关。而且取得以上治疗效果的最大给药量仅为1×108pfu,较其他重组腺病毒瘤内注射治疗的给药量109~1010pfu降低了10~100倍,疗效却更为显著。
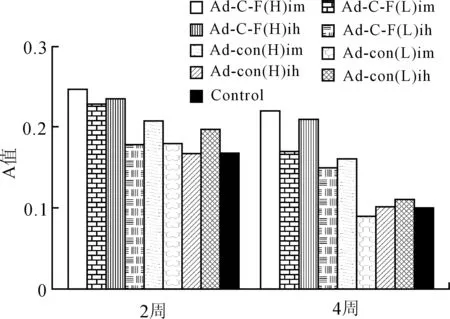
图6 ELISA法检测2周和4周时血清中的特异性抗p53抗体
Fig.6 Detection of serum specific anti-P53 antibody by ELISA method at week 2 and 4
为了检测小鼠体内目的基因的表达情况,我们提取了小鼠注射部位的肌肉提取RNA进行反转录PCR,证实了目的基因在小鼠体内得到了表达。
AdEasyTM-SLC-HP-Fc高剂量皮下免疫的小鼠脾淋巴细胞CTL杀伤活性与AdEasyTM-con组和对照组比较并没有统计学意义,表现为相对的活性增高,这一结果表明疫苗可以诱导出针对HP特异的CTL应答。CTL是免疫应答的主要效应细胞,在肿瘤免疫中起重要作用,可特异杀伤靶细胞[6-7],并能分泌细胞因子如IL-2、TNF和IFN-γ。已有证据显示,多表位疫苗的效应要优于单一表位疫苗[1-2],CTL在识别靶细胞(抗原)和攻击靶细胞时都受MHCⅠ类分子的约束。有实验证明,在肿瘤患者中可以诱导出表位特异的CTLs。我们使用的融合基因兼顾了c-erbB-2和p53的一些抗原表位,并是具有多个适用于多种MHCⅠ类及Ⅱ类分子呈递肽的基因,尤其是HLA-A2型抗原表位,正是该疫苗的多表位使得其在实验应用中产生了比较好的效果。
在抗肿瘤免疫研究中,CTL应答起主要的作用。然而有研究结果显示,对于c-erbB-2免疫后的小鼠,能同时诱导出特异性的CTLs和IgG反应,产生的保护动物抵抗肿瘤攻击的能力比单用二者中的任一种都强[8-9]。本实验通过ELISA法检测了免疫后2周和4周时小鼠血清中p53特异的抗体水平。结果显示,尽管治疗组抗体水平有所提高,各组的抗体水平并没有统计学的差异。
综上所述,携带融合基因SLC-Her-2/neu-p53-Fc(SLC-HP-Fc)的重组腺病毒AdEasyTM-SLC-HP-Fc真核表达载体的免疫可诱导出机体的细胞免疫应答,产生了很好的抗肿瘤作用,明显抑制了动物的肿瘤生长。虽未能治愈肿瘤,但是充分证实了这一免疫治疗方法辅助肿瘤治疗的有效性,说明趋化核酸疫苗的临床应用具有很好的前景。
[1] GHOSH MK, LI CL, FAYDLE C, et al. Induction of HLA-A2-restricted CTL responses by a tubular structure carrying human melanoma epitope[J]. Vaccine, 2002, 20(19-20):2463-2473.
[2] RICE J, BUCHAN S, STEVENSON FK. Critical components of a DNA fusion vaccine able to induce protective cytotoxic T cells against a single epitope of a tumor antigen[J]. J Immunol, 2002, 169(7):3908-3913.
[3] ZHOU GH, WANG HW, WANG F, et al. Recombinant adenovirus expressing type Asia1 foot-and-mouth disease virus capsid proteins induces protective immunity against homologous virus challenge in mice[J]. Res Veterinary Sci, 2013, 94(3):796-802.
[4] SEREGIN SS, ALDHAMEN YA, RASTALLD PW, et al. Adenovirus-based vaccination against Clostridium difficile toxin A allows for rapid humoral immunity and complete protection from toxin A lethal challenge in mice[J]. Vaccine, 2012, 30(8):1492-1501.
[5] JIANG WM, JIANG P, LI YF, et al.Recombinant adenovirus expressing GP5 and M fusion proteins of porcine reproductive and respiratory syndrome virus induce both humoral and cell-mediated immune responses in mice[J]. Veterinary Immunol Immunopathol, 2006, 133(1-2):169-180.
[6] BERKE G. The binding and lysis of target cells by cytotoxic lymphocytes: molecular and cellular aspects[J]. Annu Rev Immunol, 1994, 12:735-773.
[7] YU LZ, YAMAGISHI JA, ZHANG SF, et al.Protective effect of a prime-boost strategy with plasmid DNA followed by recombinant adenovirus expressing TgAMA1 as vaccines against Toxoplasma gondii infection in mice[J]. Parasitol International, 2012, 61(3):481-486.
[8] REILLY RT, MACHIELS JH, EMENS LA, et al. The collaboration of both humoral and cellular Her-2/neu-targeted immune responses is required for the complete eradication of Her-2/neu-expressing tumors[J]. Cancer Res, 2001, 61(2):880-883.
[9] 王建伟,高航,车广华,等. 携带鼠白细胞介素-12基因重组腺病毒载体的构建及其对致病性的影响[J]. 吉林大学学报:医学版, 2003, 29(3):291-293.
(编辑 卓选鹏)
The anti-tumor effect of recombinant adenovirus with fused gene ofSLC-Her-2/neu-p53-Fc on mice bearing melanoma
WANG Wei-min1,2, SUN Wen-xin2, QIAN Hai-li2,WANG Hai-juan2, ZHANG Shu-ren2, LIN Chen2
(1. Department of Gynecology and Obstetrics, the First Affiliated Hospital,Medical School of Xi’an Jiaotong University, Xi’an 710061; 2. State KeyLaboratory of Molecular Oncology, Tumor Research Institute of Tumor Hospital,the Chinese Academy of Medical Sciences, Beijing 100061, China)
Objective To amplify and purify the recombinant adenovirus with fused gene of SLC, Her-2/neu, p53 and Fc fragment (SLC-HP-Fc) and test its immunotherapeutic effect on mice bearing melanoma. Methods The adenovirus was given to the C57BL/6 mice model bearing melanoma to test its anti-tumor effect. Results By LDH assay, we found the cytolysis activity of mice spleen lymphocytes from the mice treated with high dosage of AdEasyTM-SLC-HP-Fc by intramuscular injection was higher than that of the spleen lymphocytes of the mice from other groups. Conclusion The fused gene transmission by the adenovirus vector is feasible. And the eukaryotic expression of the recombinant adenovirus AdEasyTM-SLC-HP-Fc, especially with high dosage by intramuscular injection, can delay tumor emergence and inhibit tumor growth.
c-erbB-2; p53; chemotactic factor SLC; Fc fragment; adenovirus
2014-02-24
2014-04-25
林晨,研究员,博士研究生导师. E-mail: clin@public.bta.net.cn
王慰敏(1978-),女(汉族),主治医师,博士. 研究方向:妇科肿瘤的分子机制. E-mail: wang_weimin2009@live.cn
时间:2014-09-18 09∶56 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140918.0956.003.html
R730.51
A
10.7652/jdyxb201406012

