硫化氢在大鼠弥漫性轴索损伤中的作用
王军锋,宋锦宁,李 宇,金 涛,刘晓斌,庞宏刚,黄廷钦,白立曦
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061;2.山东大学第二医院神经外科,山东济南 250033)
◇专题研究◇
硫化氢在大鼠弥漫性轴索损伤中的作用
王军锋1,2,宋锦宁1,李 宇1,金 涛1,刘晓斌1,庞宏刚1,黄廷钦1,白立曦1
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061;2.山东大学第二医院神经外科,山东济南 250033)
目的 探讨弥漫性轴索损伤(diffuse axonal injury, DAI)后脑组织内源性硫化氢(hydrogen sulfide, H2S)含量的变化及外源性H2S对DAI的作用,阐明H2S作为一种新的气体信号分子在脑组织中发挥的作用,为DAI后神经功能障碍的防治提供理论基础。方法 采用大鼠头颅瞬间旋转装置制备大鼠DAI模型,给予外源性H2S干预,以造模后6 h、24 h、7 d为时间点,分别用亚甲蓝分光光度法检测脑组织H2S含量的变化,流式细胞仪检测海马CA3区神经元的凋亡及Western blot检测脑组织β淀粉样前体蛋白(β-amyloid precursor protein, β-APP)的变化。结果 DAI模型组皮层、海马、脑干内源性H2S的含量较对照组均显著增加,且DAI+H2S干预组脑组织H2S含量增加更明显;DAI模型组较对照组海马神经元早期凋亡百分比明显增加,致伤时间越长,凋亡百分比越高,且DAI(7 d)+H2S干预组均较DAI(7 d)模型组的海马神经元凋亡百分比明显增高;DAI模型组皮层、海马、脑干β-APP的表达较对照组明显增高,且DAI+H2S干预组均较DAI模型组β-APP的表达更明显。结论 DAI后脑组织神经元凋亡及β-APP表达的增加可能与脑组织自身内源性H2S含量的增加有关,其可能作为一种新的神经递质参与DAI的继发性神经元损伤过程。
创伤性颅脑损伤;弥漫性轴索损伤;硫化氢;神经递质;凋亡;β淀粉样前体蛋白
弥漫性轴索损伤(diffuse axonal injury, DAI)是创伤性颅脑损伤(traumatic brain injury, TBI)中最常见、最重要的病理学过程之一,是指头部在剪应力的作用下,脑内发生的以神经轴索肿胀、断裂及轴索回缩球形成为特征的病理生理变化[1-2]。在TBI、脑缺血等急性神经损伤中,继发性神经元损伤起着决定性的作用,其病理过程与损伤的严重程度和临床预后密切相关。硫化氢(hydrogen sulfide, H2S)作为继一氧化氮和一氧化碳之后的第3种气体信号分子和神经递质,在中枢神经系统的生理及病理状态下发挥着重要作用。已有研究证实,H2S在继发性神经元损伤(secondary neuronal injury)中发挥多样性作用[3]:H2S通过激活ATP敏感钾离子通道复合体(ATP-sensitive K channels, KATP)扩张脑血管,通过抑制谷氨酸的兴奋毒性以及抗氧化、抗炎症和抗凋亡等在继发性神经元损伤中起保护作用。然而,H2S促进继发性神经元损伤中神经元钙超载的形成。此外,H2S还促使海马长程增强效应的形成,有益于急性神经损伤后学习记忆的恢复。既往有关H2S在神经科学领域的研究集中于体内外脑缺血模型,而在TBI方面的研究却鲜有报道。本研究采用大鼠头颅瞬间旋转装置制备大鼠DAI模型,在体观察DAI后脑组织内源性H2S含量的变化及外源性H2S对DAI的作用,旨在阐明H2S作为一种新的气体信号分子在脑组织中发挥的作用及可能的机制,为DAI后神经功能障碍的防治提供理论基础。
1 材料与方法
1.1 实验动物及主要试剂、器材 相同遗传背景的健康成年雄性SD大鼠35只,体质量250~350 g,由西安交通大学医学院实验动物中心提供(许可证号:SCXK(陕)2007-001)。小鼠抗大鼠β-APP抗体(22C11克隆,美国Merk Milipore公司),小鼠抗大鼠β-actin抗体(陕西先锋生物科技有限公司),抗小鼠二抗(美国Thermo公司),通用型鼠SP-9002检测试剂盒(北京中杉金桥生物技术有限公司),Annexin V-FITC细胞凋亡检测试剂盒(珠海健康元生物医药有限公司),硫氢化钠(美国Sigma公司),N,N-二甲基对苯二胺盐酸盐(天津傲然精细化工研究所);自动凝胶图像分析仪(上海培清科技有限公司),FACSCalibur流式细胞仪(美国BD Biosciences公司),全自动酶标仪(瑞士Tecan公司),微量紫外可见分光光度计(美国NanoDrop Technologies公司)
1.2 DAI模型的制备 随机分为对照组(假损伤组,5只)、DAI模型组(15只)、DAI+H2S干预组(15只),采用刘晓斌等[4-6]研制的大鼠头颅瞬间旋转损伤装置(图1),将100 g/L水合氯醛(2.0 mL/kg)麻醉后的大鼠头部固定于旋转损伤装置的固定部分,将大鼠俯卧于20 cm厚的海绵垫上,通过2个耳棒、头夹及门齿孔,将大鼠头颅固定于旋转损伤装置上,躯干与实验台面保持约30°夹角(图1)。待其清醒后,于挣扎间歇期,按下扳机,装置遂使大鼠头颅瞬间冠状面旋转90°,共打击8次,制作大鼠DAI模型。

图1 刘晓斌等制作的大鼠头颅瞬间旋转损伤装置(A)及大鼠固定状态(B)
Fig.1 The injury device for lateral head rotation in relaxant state (A) and its tensive state with a rat placed in (B)
1.3 实验动物分组及药物干预 以造模后6 h、24 h、7 d为时间点(即DAI模型组和DAI+H2S干预组分为3个亚组,n=5),用于分子学检验脑组织H2S、海马神经元凋亡及β-APP测定。其中对照组仅接受水合氯醛腹腔注射麻醉、头部固定于旋转装置的假损伤操作。DAI+H2S干预组的H2S干预由其供体NaHS经腹腔注射给药。NaHS(0.1 mmol/kg)第1次给药在致伤前10 min经腹腔注射,以后每隔24 h按0.1 mmol/kg的浓度给药1次,即DAI(6 h)+H2S干预组给药1次,DAI(24 h)+H2S干预组给药2次,DAI(7 d)+H2S干预组给药8次。
1.4 亚甲蓝分光光度法测定脑组织H2S的含量 用0~4 ℃预冷的50 mmol/L磷酸钾缓冲液(pH 8.0)制备组织匀浆(每1.2 g脑组织加10 mL磷酸钾缓冲液)。匀浆液离心(12 000 r/min,10 min,4 ℃),取75 μL上清液转移至另一离心管中。在室温下加入0.25 mL 10 g/L醋酸锌及0.45 mL去离子水,孵育10 min。加入100 g/L三氯乙酸0.25 mL,再次离心(7 000 r/min,10 min,4 ℃),收集上清。加入133 μL N,N-二甲基对苯二胺盐酸盐(20 mmol/L)/HCl(7.2 mol/L)缓冲液及133 μL FeC13(30 mmol/L)/HCl(1.2 mol/L)缓冲液,充分混匀,在室温下孵育20 min。用全自动酶标仪于670 nm波长处测定吸光度,根据H2S标准曲线计算出脑组织匀浆中H2S的含量,H2S含量以单位质量脑组织中H2S的量(nmol/g)表示。
1.5 流式细胞仪检测海马CA3区神经元的凋亡 从刚处死的大鼠新鲜脑组织中迅速分离出海马CA3区,剪切出大约20 mg实验组织块。将组织块放置在浸泡于预冷的0.01 mol/L PBS溶液中的一次性研磨器上,用研磨棒轻柔将组织研碎,制成组织细胞悬液。将组织细胞悬液过两次200目滤网。细胞计数后取5×105~1×106个细胞,1 000 r/min,4 ℃离心5 min,弃上清。反复悬浮细胞、离心2次。将细胞重悬于500 μL 1×Binding Buffer。加入5 μL Annexin V-FITC与5 μL PI轻轻混匀,室温避光反应15 min。FACS Calibur流式细胞仪检测。
1.6 Western blot检测脑组织β-APP的表达 生理盐水灌注后立即取部分皮层、海马、脑干,RIPA裂解液提取组织蛋白,取上清液用Nanodrop微量紫外可见分光光度计直接测定蛋白质量浓度(mg/mL)。取100 μg蛋白样品,SDS-PAGE电泳,半干法转移至PVDF膜,将膜放入50 g/L的脱脂牛奶中37 ℃封闭1~2 h后,一抗(β-APP,1∶10 000;β-actin,1∶1 000)4 ℃孵育过夜。TBST缓冲液洗膜后,将膜与辣根过氧化物酶标记的二抗(1∶10 000)室温孵育1 h,洗膜后化学发光法观察显影,凝胶成像系统拍照后采用Quantity One软件测定条带吸光度作定量分析。
2 结 果
2.1 大鼠脑组织H2S含量的变化 DAI模型组皮层、海马、脑干内源性H2S的含量均显著增加,与对照组相比差异有统计学意义。DAI后相同时间点的DAI+H2S干预组较DAI模型组皮层、海马、脑干H2S含量显著升高(图2~图4)。
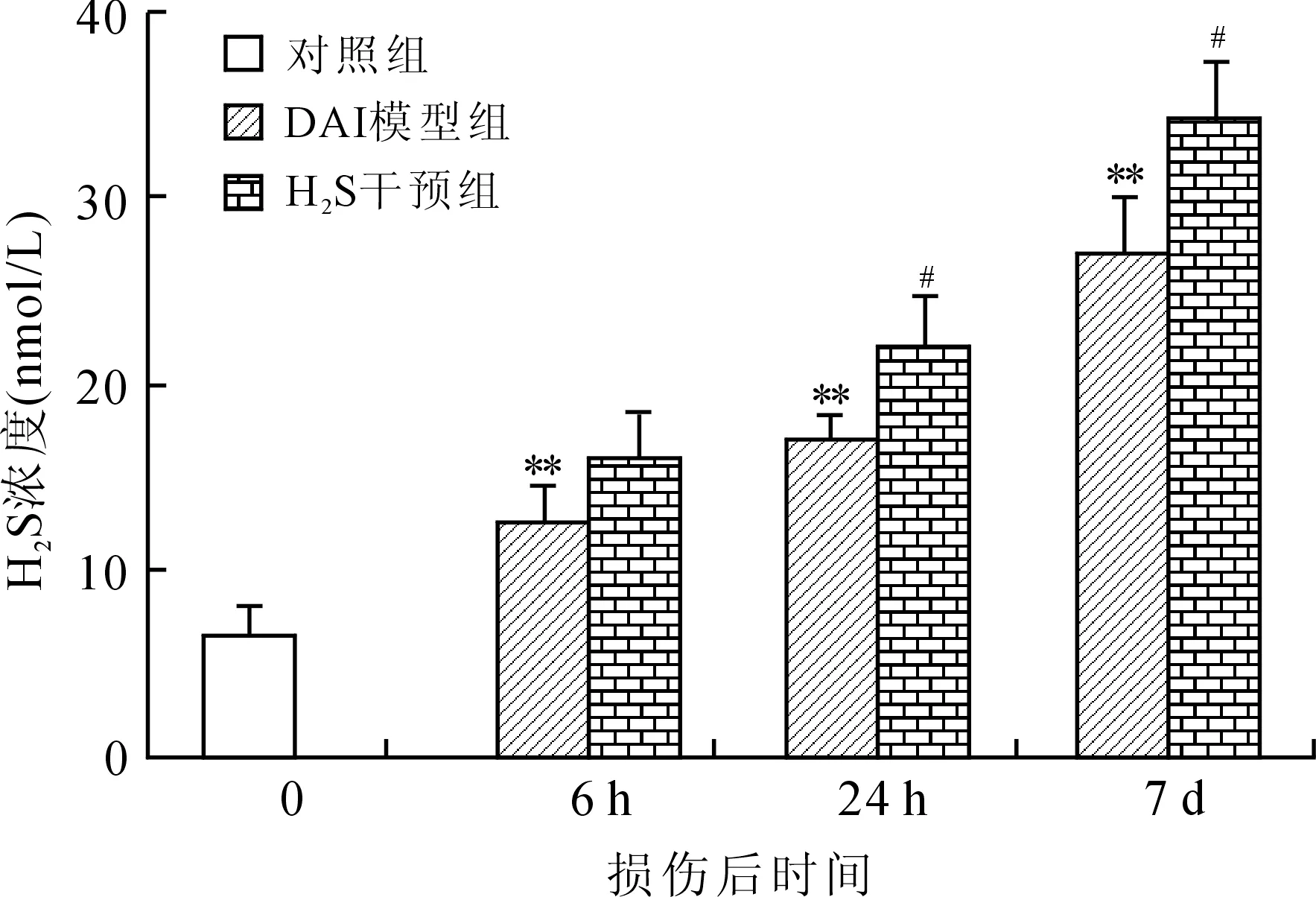
图2 各组大鼠皮层H2S浓度的比较
Fig.2 Comparison of H2S content in the rat cortex
DAI模型组各时间点与对照组相比,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,#P<0.05。
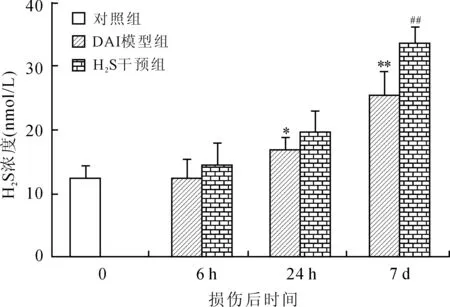
图3 各组大鼠海马H2S浓度的比较
Fig.3 Comparison of H2S content in the rat hippocampus
DAI模型组各时间点与对照组相比,*P<0.05,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,##P<0.01。
2.2 大鼠海马神经元凋亡情况 DAI模型组较对照组海马神经元早期凋亡百分比明显增加(P<0.01),致伤时间越长,凋亡百分比越高,且DAI(7 d)+H2S干预组均较DAI(7 d)模型组的海马神经元凋亡百分比显著增高(P<0.05,图5、图6)。
2.3 大鼠脑组织β-APP的测定 DAI模型组较对照组β-APP表达明显增高,损伤后相同时间点的DAI+H2S干预组均较DAI模型组的β-APP表达明显增高(图7~图9)。
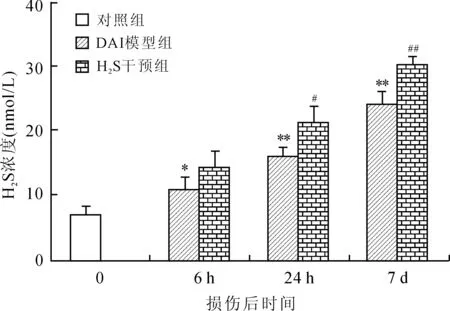
图4 各组大鼠脑干H2S浓度的比较
Fig.4 Comparison of H2S content in the rat brain stem
DAI模型组各时间点与对照组相比,*P<0.05,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,#P<0.05,##P<0.01。
3 讨 论
H2S能自由通过血脑屏障,且其在中枢的浓度显著高于外周[7-8],故其被认为是一种气体信号分子,可能参与中枢神经系统(central nervous system,CNS)生理和病理机制的调节。脑内H2S的合成主要由胱硫醚-β合成酶(cystathionine-β-synthase enzyme, CBS)合成[9-11]。关于中枢H2S合成的调节,ETO等[11]最早报道,脑内的兴奋性神经递质(谷氨酸)可以显著增加CBS酶的活性,进而促进H2S的合成,且CBS酶活性的增强是通过Ca2+/CaM的作用方式,故H2S的合成被认为是对神经元兴奋的一种应答。本研究参照QU等[12]的方法,通过亚甲蓝分光光度法测定脑组织H2S的含量,发现DAI模型组脑组织内源性H2S的含量均显著增加,与对照组相比差异有统计学意义,且损伤后相同时间点的DAI+H2S干预组较DAI模型组H2S含量显著升高。根据ETO的结论,DAI后脑组织内源性H2S含量增加可能与DAI后合成增加的兴奋性氨基酸的正调控作用有关,且DAI后神经元的钙超载亦可能促进H2S的合成。QU等[12]在大鼠大脑中动脉梗塞模型中,亦观察到脑缺血后皮层H2S水平及H2S合成酶活性明显升高,这一结果与本研究相符合。然而,LI等[13]在双侧颈总动脉闭塞导致的脑缺血模型中却得出相反的结论,脑缺血后H2S合成减少。REN等[14]则得出与上述均不同的结果:大鼠脑缺血再灌注后12 h H2S含量显著升高,24 h后下降,48 h后则恢复至正常水平。本研究通过给予外源性的H2S后,脑组织H2S含量进一步升高。这一结果符合H2S能够通过血脑屏障和自由扩散进入细胞的特点,且与QU等[12]给予外源性的半胱氨酸(H2S供体)及LI等[13]给予外源性的H2S使脑组织H2S含量升高的结果相一致。造成脑组织损伤后H2S结果各异的主要原因为亚甲蓝化学检测法的灵敏度低、稳定性差。脑组织H2S的存在形式分为非溶解游离型和HS-结合型,该研究检测的脑组织H2S应为非溶解游离型,而亚甲蓝化学检测法从脑组织中萃取的DAI模型组各时间点与对照组相比,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,#P<0.05。
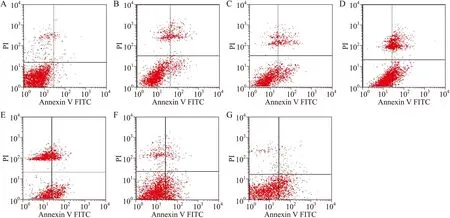
图5 大鼠海马CA3区神经元凋亡情况的比较
Fig.5 Comparison of neuronal apoptosis in the rat hippocampal CA3
A:对照组;B:DAI(6 h)模型组;C:DAI(6 h)+H2S干预组;D:DAI(24 h)模型组;E:DAI(24 h)+H2S干预组;F:DAI(7 d)模型组;G:DAI(7 d)+H2S干预组。4个象限分别表示:右上象限为晚期坏死的细胞,左上象限为晚期凋亡或早期坏死的细胞,左下象限为正常存活的细胞,右下象限为早期凋亡的细胞。图A右下象限早期凋亡细胞百分比最低,从图A→图G早期凋亡细胞百分比逐渐增高。
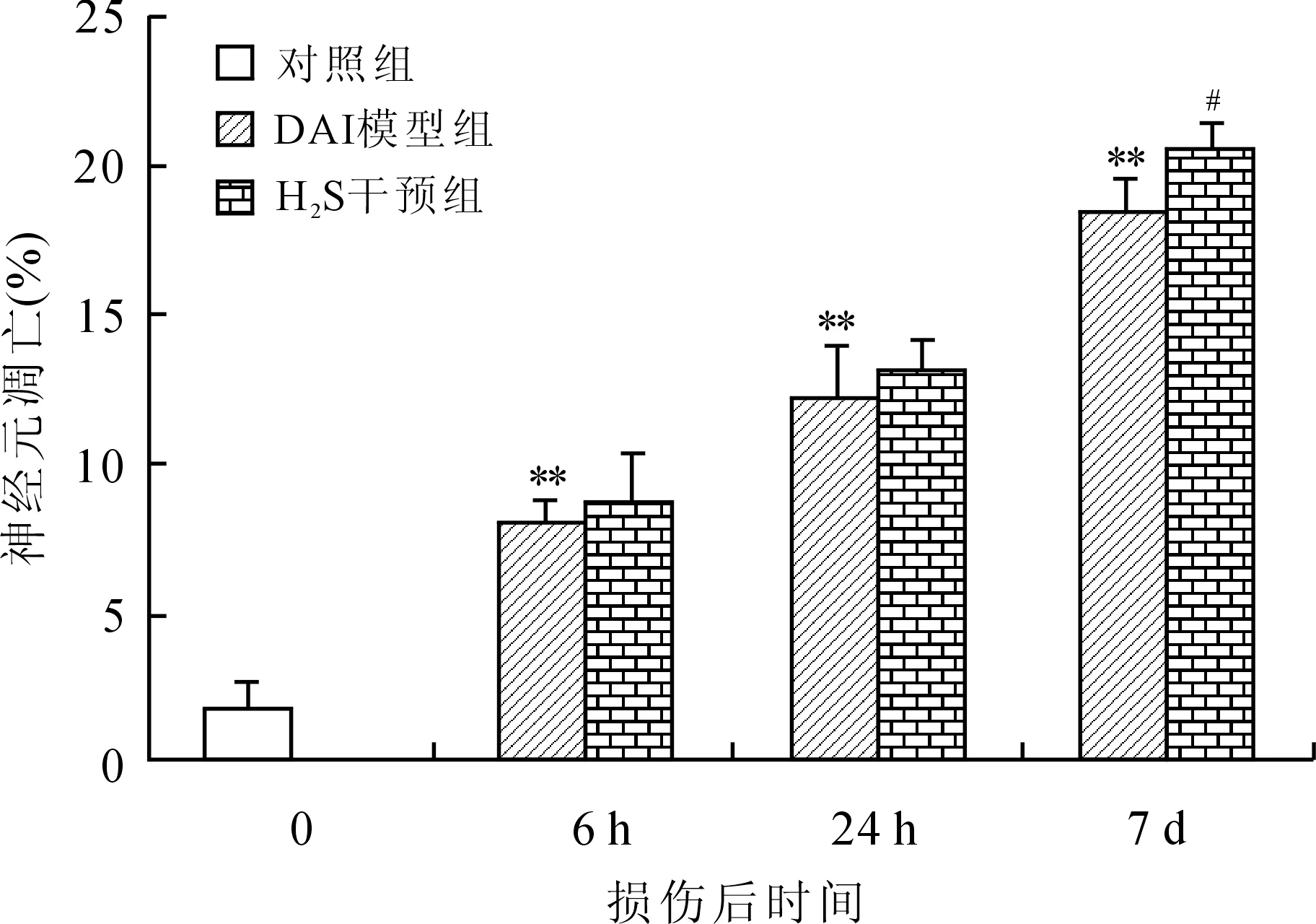
图6 各组大鼠海马CA3区神经元早期凋亡百分比的比较
Fig.6 Comparison of the percentage of early apoptotic neurons in the rat hippocampal CA3
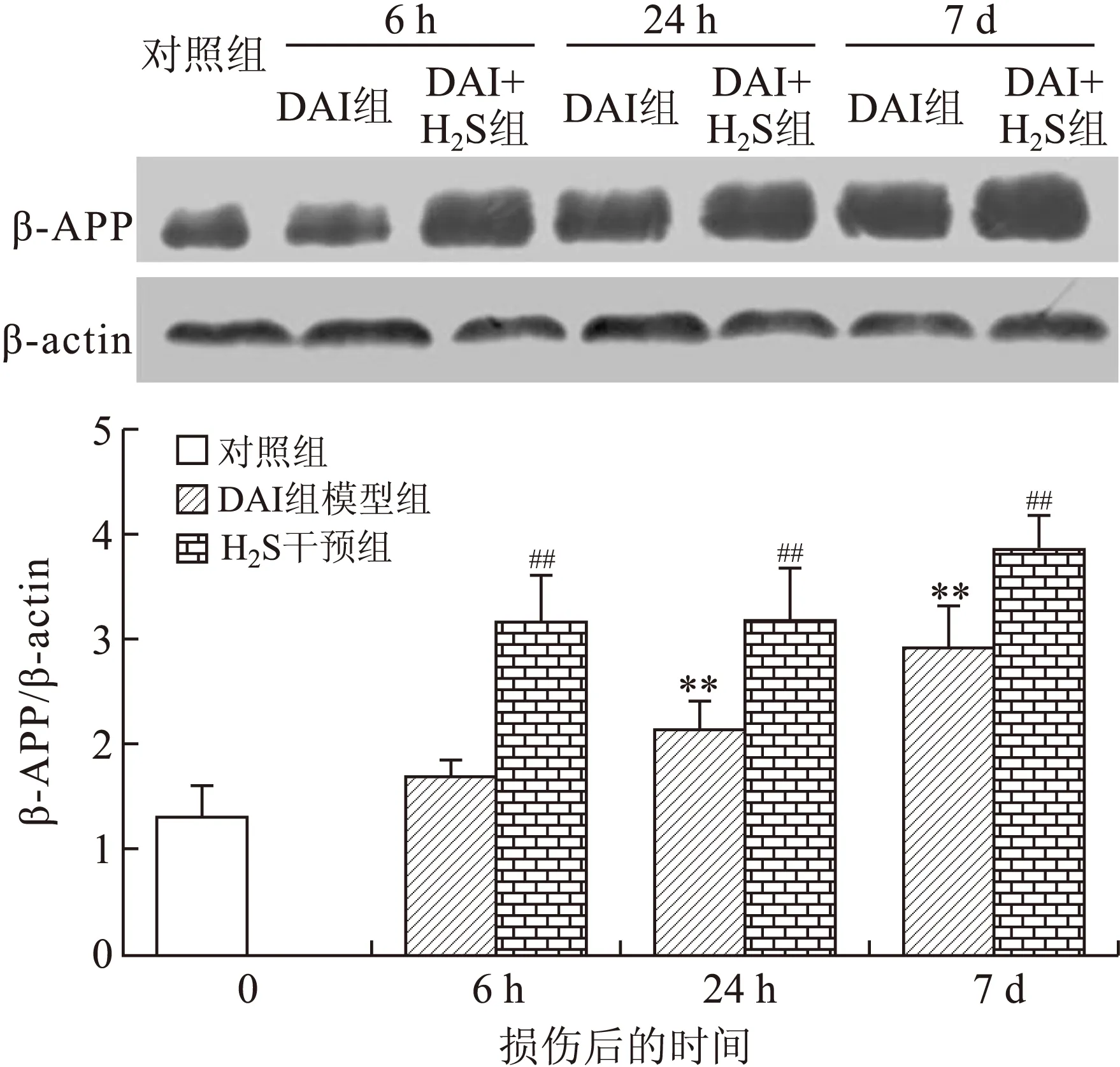
图7 各组大鼠皮层β-APP Western blot检测结果的比较
Fig.7 Comparison of β-APP expression determined by Western blot in the rat cortex
DAI模型组各时间点与对照组相比,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,##P<0.01。
H2S可能既包括结合型也包括游离型,故形成偏倚。因此,在不损伤细胞功能的前提下探索新颖、灵敏的H2S的检测方法对于进一步了解H2S在中枢的作用十分必要。
DAI的继发性神经元损伤涉及神经元延迟性的凋亡。本研究已证实了DAI后海马神经元的凋亡随时间进行性的增加,且在DAI的基础上给予外源性的H2S干预后,DAI后各时间点海马神经元的凋亡百分比均较单纯的DAI模型组有所增加,其中DAI(7 d)+H2S干预组较DAI(7 d)模型组的海马神经元凋亡百分比显著增高(P<0.05)。H2S对神经元DAI模型组各时间点与对照组相比,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,#P<0.05。
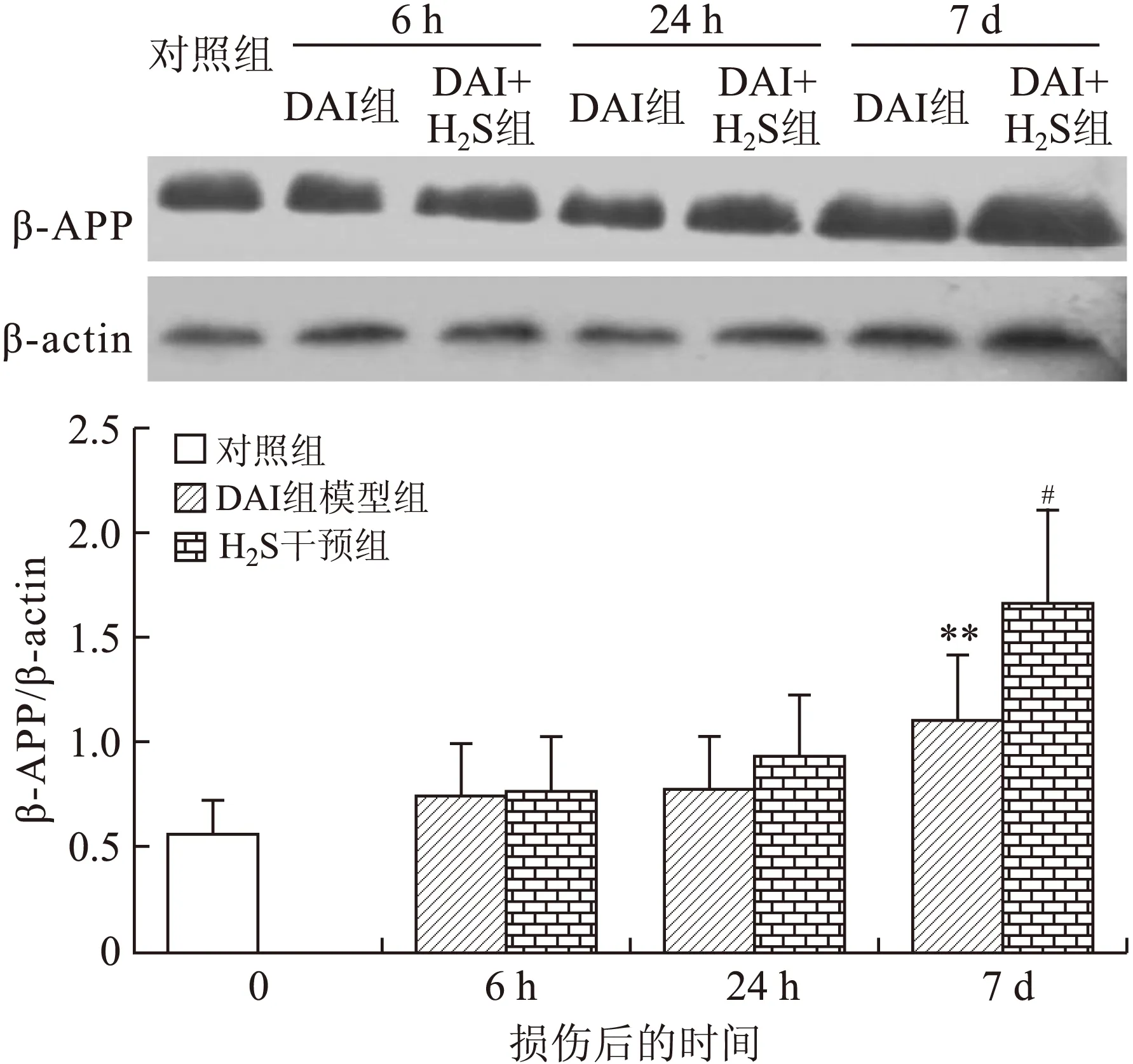
图8 各组大鼠海马β-APP Western blot测定结果的比较
Fig.8 Expression of β-APP determined by Western blot in the rat hippocampus
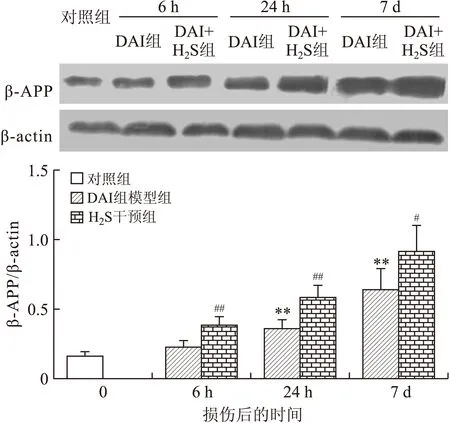
图9 各组大鼠脑干β-APP Western blot测定结果的比较
Fig.9 Expression of β-APP determined by Western blot in the rat brain stem
DAI模型组各时间点与对照组相比,**P<0.01;相同时间点DAI+H2S干预组与DAI模型组相比,#P<0.05,##P<0.01。
凋亡的抑制或促进作用均有报道。H2S在脑缺血、缺氧、及脑血管性痴呆等模型中通过抑制神经元凋亡发挥保护作用[13,15-16]。然而CHEUNG等[17]发现,浓度低于200 mmol/L的H2S可诱导皮层神经元的凋亡。RYAZANTSEVA等[18]则亦观察到H2S剂量依赖性的促进白细胞的凋亡。造成H2S对于神经元凋亡作用研究有相反结论的原因可能与H2S的干预剂量不同有关。LI等[19]则发现了不同浓度H2S对大鼠脑缺血后神经元凋亡的双重作用,2.8 mg/kg NaHS干预通过抑制线粒体的氧化应激,进而抑制神经元的凋亡;而11.2 mg/kg NaHS干预则起相反作用。此外,活性氧自由基(reactive oxygen species,ROS)诱导的氧化毒素及钙超载引起的线粒体功能障碍均可诱发神经元凋亡级联反应的发生,已发现H2S通过促进谷胱甘肽的合成而抑制氧化应激[20-21],但H2S亦可通过促进Ca2+内流及细胞内钙库的释放而增加神经元内Ca2+的浓度[22-23],故H2S既通过抑制氧化应激发挥抗凋亡作用,亦可促进钙超载加重神经元凋亡。
TBI、脑缺血等急性神经损伤事件引起的神经功能障碍不仅取决于原发性损伤,更大程度上与继发性神经元损伤有关[24]。近来越来越多的证据表明,H2S在继发性神经元损伤的病理机制中发挥着重要作用。本研究证实DAI后脑组织内源性的H2S含量与神经元凋亡数目、β-APP表达均显著增加。在DAI的基础上给予外源性H2S干预后,神经元凋亡数目及β-APP的表达进一步增加,提示H2S加重了DAI的损伤。基于以上DAI损伤后及给予外源性H2S干预后,脑组织H2S的含量变化与神经元凋亡、β-APP的表达变化趋势相同,得出DAI后脑组织神经元凋亡、β-APP的增加可能与脑组织自身内源性H2S的增加有关,其可能作为一种新的神经递质参与了DAI的继发性神经元损伤过程。
本研究首次阐述了H2S在DAI中的作用,而H2S在急性神经元损伤中的作用机制研究,目前主要集中于脑缺血、缺氧模型中。QU等[12]报道H2S加重了脑缺血,因为NMDA受体阻断剂MK801抑制了H2S引起的脑梗死体积的增加,故H2S可能通过促进NMDA受体介导的钙超载加重脑损伤。LI等[13]则得出相反的结论,H2S在脑缺血模型中通过改善大鼠空间学习记忆缺失,抑制海马神经元细胞的水肿、核固缩,以及促进海马生长相关蛋白的表达而发挥保护作用。REN等[14]在大鼠脑缺血再灌注模型中,发现180 mmol/kg的NaHS干预加重神经元损伤,而25 mmol/kg的NaHS干预则发挥保护作用。LI等[19]在线栓法导致的局部脑缺血模型中,同样观察到2.8 mg/kg NaHS干预显著减少了皮层梗死体积,而11.2 mg/kg NaHS干预发挥相反作用。本研究参照LI等[13]使用的5.6 mg/kg NaHS,这与QU等[12]使用的0.09 mmol/kg NaHS剂量相近,均得出H2S加重急性神经元损伤的结论。分析以上H2S作用各异的原因,首先是H2S剂量不同,生理浓度的H2S在神经元缺血、缺氧中发挥保护作用,而高浓度的H2S却导致神经毒性。其次,H2S在继发性神经元损伤中发挥双面作用,既可通过扩血管、抑制谷氨酸毒性、抗氧化、抗炎、抗凋亡发挥保护作用,又可能通过促进钙超载而加重神经元损伤[3]。最后,动物模型、实验方法及实验目的不同等亦可造成实验结果的不同。
综上所述,H2S作为一种化学活性物质,其在外周组织的作用研究已日趋完善,而在神经系统的研究尚属于起步阶段,其作用的对象为信号分子或者离子通道,提示H2S可能在神经系统中作为第一信使激活下游分子而发挥作用。本研究证实H2S可能作为一种新的神经递质参与DAI的继发性神经元损伤过程。然而,我们对H2S在神经系统的生理、病理状态下作用机制仍然不十分清楚,且H2S的许多作用还存在争议,因此其作用有待于进一步的系统研究,相信在不远的将来H2S在中枢神经系统的作用及机制将会得到系统合理的阐释,将会为疾病的防治提供新的理论依据。
[1] SMITH DH, MEANEY DF, SHULL WH. Diffuse axonal injury in head trauma[J]. J Head Trauma Rehabil, 2003, 18(4):307-316.
[2] 宋锦宁,刘守勋,戈治理,等.脑弥漫性轴索损伤的特点及临床诊断[J].中国神经精神疾病杂志,1997,23(3):141-144,197.
[3] WANG JF, LI Y, SONG JN, et al. Role of hydrogen sulfide in secondary neuronal injury[J]. Neurochem Int, 2014, 64:37-47.
[4] SONG JN, LIU XB, CHEN JY, et al. Dynamic changes in cerebral microcirculation and hypoxia in the early stages of diffuse axonal injury[J]. Neural Regen Res, 2011,6(20):1530-1536.
[5] LI Y, SONG J, LIU X, et al. High expression of STIM1 in the early stages of diffuse axonal injury[J]. Brain Res, 2013, 1495: 95-102.
[6] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008, 29(5):595-598.
[7] WARENYCIA MW, GOODWIN LR, BENISHIN CG, et al. Acute hydrogen sulfide poisoning. Demonstration of selective uptake of sulfide by the brainstem by measurement of brain sulfide levels[J]. Biochem Pharmacol, 1989, 38(6):973-981.
[8] ZHAO W, NDISANG JF, WANG R. Modulation of endogenous production of H2S in rat tissues[J]. Can J Physiol Pharmacol, 2003, 81(9):848-853.
[9] ABE K, KIMURA H. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. J Neurosci, 1996, 16(3):1066-1071.
[10] ETO K, KIMURA H. A novel enhancing mechanism for hydrogen sulfide-producing activity of cystathionine beta-synthase[J]. J Biol Chem, 2002, 277(45):42680-42685.
[11] ETO K, OGASAWARA M, UMEMURA K, et al. Hydrogen sulfide is produced in response to neuronal excitation[J]. J Neurosci, 2002, 22(9):3386-3391.
[12] QU K, CHEN CP, HALLIWELL B, et al. Hydrogen sulfide is a mediator of cerebral ischemic damage[J]. Stroke, 2006, 37(3):889-893.
[13] LI Z, WANG Y, XIE Y, et al. Protective effects of exogenous hydrogen sulfide on neurons of hippocampus in a rat model of brain ischemia[J]. Neurochem Res, 2011, 36(10):1840-1849.
[14] REN C, DU A, LI D, et al. Dynamic change of hydrogen sulfide during global cerebral ischemia-reperfusion and its effect in rats[J]. Brain Res, 2010, 1345:197-205.
[15] LUO Y, LIU X, ZHENG Q, et al. Hydrogen sulfide prevents hypoxia-induced apoptosis via inhibition of an H2O2-activated calcium signaling pathway in mouse hippocampal neurons[J]. Biochem Biophys Res Commun, 2012, 425(2):473-477.
[16] ZHANG LM, JIANG CX, LIU DW. Hydrogen sulfide attenuates neuronal injury induced by vascular dementia via inhibiting apoptosis in rats[J]. Neurochem Res, 2009, 34(11):1984-1992.
[17] CHEUNG NS, PENG ZF, CHEN MJ, et al. Hydrogen sulfide induced neuronal death occurs via glutamate receptor and is associated with calpain activation and lysosomal rupture in mouse primary cortical neurons[J]. Neuropharmacology, 2007, 53(4):505-514.
[18] RYAZANTSEVA NV, NOVITSKY VV, STARIKOVA EG, et al. Role of hydrogen sulfide in the regulation of cell apoptosis[J]. Bull Exp Biol Med, 2011, 151(6):702-704.
[19] LI GF, LUO HK, LI LF, et al. Dual effects of hydrogen sulphide on focal cerebral ischaemic injury via modulation of oxidative stress-induced apoptosis[J]. Clin Exp Pharmacol Physiol, 2012, 39(9):765-771.
[20] KIMURA Y, GOTO Y, KIMURA H. Hydrogen sulfide increases glutathione production and suppresses oxidative stress in mitochondria[J]. Antioxid Redox Signal, 2010, 12(1):1-13.
[21] KIMURA Y, KIMURA H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004, 18(10): 1165-1167.
[22] GARCIA-BEREGUIAIN MA, SAMHAN-ARIAS AK, MARTIN-ROMERO FJ, et al. Hydrogen sulfide raises cytosolic calcium in neurons through activation of L-type Ca2+channels[J]. Antioxid Redox Signal, 2008, 10(1):31-42.
[23] YONG QC, CHOO CH, TAN BH, et al. Effect of hydrogen sulfide on intracellular calcium homeostasis in neuronal cells[J]. Neurochem Int, 2010, 56(3):508-515.
[24] BORGENS RB, LIU-SNYDER P. Understanding secondary injury[J]. Q Rev Biol, 2012, 87(2):89-127.
(编辑 韩维栋)
Role of hydrogen sulfide in diffuse axonal injury in rats
WANG Jun-feng1,2, SONG Jin-ning1, LI Yu1, Jin Tao1, LIU Xiao-bin1,PANG Hong-gang1, HUANG Ting-qin1, BAI Li-xi1
(1. Department of Neurosurgery, the First Affiliated Hospital, Medical School ofXi’an Jiaotong University, Xi’an 710061; 2. Department of Neurosurgery,the Second Hospital of Shandong University, Jinan 250033, China)
Objective To detect the content changes of endogenous hydrogen sulfide (H2S) in the cerebral tissues after diffuse axonal injury (DAI) and observe the role of exogenous H2S in DAI so as to clarify the role of H2S as a new gas signaling molecule involved in the process of DAI and provide rationale supports for the prevention and treatment of neurological dysfunction after DAI. Methods The DAI model was established by a coronal rotation device and exogenous H2S was administered for intervention. Time points of 6 h, 24 h and 7 d after DAI were chosen for observation. Methylene blue spectrophotometric method was used for detecting H2S content change in the brain tissues after DAI, flow cytometry for measuring the apoptosis of hippocampal CA3 neurons, and Western blot for determining the change of β-amyloid precursor protein (β-APP) expression in the cortex, hippocampus and brain stem. Results Compared with that in the control group, endogenous H2S content in the cortex, hippocampus and brainstem significantly increased in DAI groups, with DAI+H2S intervention groups having significantly higher H2S content than DAI model groups. The apoptosis of hippocampal CA3 neurons showed an increased early apoptosis percentage in the DAI model groups and more apoptotic neuron cells were observed in the longer time post-injury in DAI model groups. Furthermore, DAI (7 d) + H2S group had a significantly higher early apoptosis percentage than DAI (7 d) group. More importantly, Western blot showed that β-APP in the cortex, hippocampus and brain stem in DAI model groups was expressed higher than in the control group, with DAI+H2S intervention groups having a significantly higher β-APP expression than DAI model groups. Conclusion The increase of neuronal apoptosis and β-APP expression may be related to the increase of endogenous H2S after DAI. It suggests that H2S may be involved in the secondary neuronal injury of DAI as a new neurotransmitter.
traumatic brain injury; diffuse axonal injury; hydrogen sulfide; neurotransmitter; apoptosis;β-amyloidprecursorprotein
2014-04-21
2014-06-27
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁,博士,教授,主任医师,博士生导师. E-mail: jinnings@126.com
王军锋(1988-),男(汉族),硕士研究生. 研究方向:颅脑损伤的基础与临床. E-mail: wjf007@stu.xjtu.edu.cn
时间:2014-09-19 15∶26 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140919.1526.003.html
R651.1
A
10.7652/jdyxb201406010

