PARP-1在大鼠弥漫性轴突损伤脑组织中的表达及意义
郗 磊,宋锦宁,赵 修,李丹东,刘晓斌,顾 华
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061;2. 阳泉市第一人民医院神经外科,山西阳泉 045000)
◇专题研究◇
PARP-1在大鼠弥漫性轴突损伤脑组织中的表达及意义
郗 磊1,2,宋锦宁1,赵 修1,李丹东1,刘晓斌1,顾 华1
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061;2. 阳泉市第一人民医院神经外科,山西阳泉 045000)
目的 探讨多聚腺苷二磷酸核糖聚合酶(PARP-1)在大鼠弥漫性轴突损伤(DAI)脑组织中的表达变化及意义。方法 健康成年雄性SD大鼠36只,随机分为6组:正常对照组、DAI后30 min组、DAI后6 h组、DAI后12 h组、DAI后24 h组、DAI后7 d组,每组各6只。采用大鼠头颅瞬间旋转损伤装置制作DAI模型。在预定时间点取大脑皮质、脑干进行HE染色、银染及PARP-1免疫组织化学染色,采用阳性细胞计数法进行半定量统计,用单因素方差分析和SNK-q检验进行统计学处理。结果 光镜下银染可见大鼠DAI后脑皮质及脑干存在轴突回缩球,HE染色可见不同程度的轴突肿胀、神经细胞核固缩、血管内皮细胞肿胀、血管周间隙增大。上述形态改变在DAI后12 h至24 h达到高峰。PARP-1在正常对照组脑皮质、脑干的神经元及神经胶质细胞的细胞核内有少量阳性表达。在DAI组的神经元及神经胶质细胞,以胞核阳性表达为主,同时存在胞质阳性表达。DAI后30 min时脑皮质及脑干阳性细胞数明显增加,12 h达到高峰,24 h开始下降,到7 d时脑皮质阳性细胞数仍高于正常水平(P<0.05),脑干阳性细胞数与正常对照组比较差异无统计学意义(P>0.05)。结论 PARP-1在DAI后皮质与脑干呈明显规律性表达;其变化规律与皮质和脑干的结构变化呈同步性动态改变;PARP-1可能在DAI后的继发性脑损伤中起重要作用。
脑损伤;弥漫性轴突损伤;多聚腺苷二磷酸核糖聚合酶-1
弥漫性轴突损伤(diffuse axonal injury, DAI)是原发性脑损伤的一种特殊类型[1]。现普遍认为,DAI是原发性损伤和继发性损伤共同作用的病理生理过程,但对其病理机制目前尚不十分清楚[2]。多聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase-1, PARP-1)作为一种DNA修复酶,可在DNA单双链断裂时激活。正常情况下,PARP-1主要是保持基因组的完整性。当DNA发生严重损伤时,PARP-1被广泛激活,引起大量ATP以及NAD+的消耗,最终导致终细胞死亡[3]。近年来,以PARP-1为治疗靶点的研究在急慢性脑损伤中越来越受到重视,而对PARP-1如何参与DAI的病理过程了解甚少。故此,本研究采用免疫组化SP法检测了在大鼠DAI后PARP-1表达的时程与分布变化,旨在探讨PARP-1在DAI后的病理生理作用。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠36只(西安交通大学医学院实验动物中心提供),体质量(278±12)g,在相同条件下饲养1周后进行实验。
1.2 实验试剂及药品 兔抗PARP-1纯化抗体(武汉博士德生物工程有限公司);山羊抗兔SP免疫组化染色试剂盒(北京博奥森生物技术有限公司);3,3-二氨基联苯胺(DAB)显色试剂盒(武汉博士德生物工程有限公司);40 g/L多聚甲醛固定液、100 g/L水合氯醛、手术器械均购自西安交通大学医学院器材供应科;0.01 mol/L枸橼酸盐缓冲液、0.02 mol/L PBS缓冲液均由西安交通大学地方病研究所提供。
1.3 实验分组 按随机数表法将36只大鼠随机分为6组:正常对照组、DAI后30 min组、DAI后6 h组、DAI后12 h组、DAI后24 h组、DAI后7 d组,每组各6只。制作模型过程中死亡的大鼠剔除并补做。
1.4 模型制作 采用刘晓斌等[4]大鼠头颅瞬间旋转损伤方法,制作大鼠头颅DAI模型。大鼠均采用100 g/L水合氯醛(2 mL/kg)腹腔麻醉,将大鼠俯卧于20 cm 厚的海绵床上,通过两个耳棒、头夹及门齿孔将大鼠头颅固定于头颅旋转致伤装置上,躯干与实验台面成30°斜角。待其清醒后(大鼠清醒的判断依据:出现较为剧烈的挣扎),于挣扎间歇期,对DAI组大鼠触发扳机,弹簧驱动旋转装置将大鼠头颅冠状面逆时针瞬间侧向旋转90°,共打击8次;对照组大鼠在出现挣扎后即从装置上取下,不行打击。
1.5 标本取材 在预定时间点,用40 g/L多聚甲醛溶液1 000 mL灌注固定。将脑组织完整取出。参照大鼠脑立体定位图谱[5],取视交叉及其后约0.5 cm大脑皮质并冠状位切开,取脑干的桥延脑部分沿正中矢状线切开并固定。脑组织行常规脱水、透明、浸蜡,包埋成块。冠状块由后向前切,矢状块由中线向外侧切,石蜡切片厚5 μm。
1.6 PARP-1的免疫组化测定及HE染色 常规脱蜡后,兔抗PARP-1纯化抗体按1∶200稀释,SP染色后行苏木素复染,常规脱水,树胶封片。0.02 mol/L的PBS代替一抗为阴性对照。另取相邻一张切片行常规HE染色,用图像信号采集与分析仪系统(Q550CW,德国LEICA公司)观察切片并图像采集。
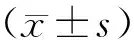
2 结 果
2.1 DAI后大鼠的行为表现和脑组织的大体观察 DAI组大鼠出现不同程度的原发昏迷,表现为无明显自主活动、刺痛反射减弱或消失、瞳孔对光反射迟钝,时间持续约1 min~2 h。其中2只大鼠出现尿失禁或便失禁。清醒后(清醒的指征[3]:①出现复正体位;②瞳孔对光反应恢复;③刺痛反应明显)表现为:反应迟钝、不思饮食、四肢活动减少、行走不稳,持续约2 h。正常对照组大鼠麻醉清醒后从装置上取下,生命体征正常,活动自如,反应敏捷,逃跑迅速。取脑观察:DAI后各组实验动物均未见蛛网膜下腔出血,未见明显的脑水肿、局部脑挫裂伤及血肿,与正常对照组相比无明显差异。
2.2 DAI后大鼠脑组织的病理形态学观察 银染可见,DAI后脑组织存在轴突回缩球。HE染色可见,DAI 30 min时脑皮质(额顶区,嗅皮质)、脑干的桥延脑(腹侧,小脑脚)等出现少量神经细胞胞核固缩,胞质深染,脑血管无明显改变。6 h时在以上各区域出现较多神经细胞核固缩深染、核仁不清,部分轴突肿胀并呈现波浪状,同时伴有明显的细胞周间隙。脑皮质血管内皮细胞肿胀,有较多血管周间隙。12 h时以上变化有所加重。24 h时脑皮质及桥延脑神经细胞核固缩稍减轻,但是仍伴随着细胞周间隙,而血管周间隙不明显。到7 d时脑额顶区及桥延脑区域存在少量神经细胞核固缩深染,细胞周间隙及血管周间隙均不明显,胶质细胞增生不明显。正常对照组HE染色如常,未出现明显的神经元核固缩深染,细胞肿胀及血管周间隙。
2.3 DAI后大鼠脑组织PARP-1的表达 PARP-1在正常对照组神经元及神经胶质细胞的细胞核有少量微弱的阳性表达,呈浅棕黄色(图1A,图2A)。在DAI组的神经元及神经胶质细胞,表现为胞核阳性表达为主,同时存在胞质阳性表达。DAI后脑皮质及桥延脑阳性细胞数在30 min时表达增加,与正常对照组比较有统计学差异(P<0.05),脑皮质区阳性细胞呈深棕黄色,桥延脑区阳性细胞呈浅棕黄色(图1B,图2B);6 h时脑皮质及桥延脑阳性细胞持续增加,阳性细胞染色均呈现为深棕黄色(图1C,图2C);12 h时以上各脑区阳性细胞数量达到高峰(图1D,图2D);24 h时以上各脑区阳性细胞数量开始下降,脑皮质区阳性细胞呈浅棕黄色,桥延脑阳性细胞呈深棕黄色(图1E,图2E);7 d时脑皮质阳性细胞数量仍高于正常水平(P<0.05),桥延脑阳性细胞数与正常组比较无统计学差异(P>0.05),7 d时脑皮质及桥延脑区阳性细胞染色仍较正常对照组明显(图1F,图2F)。脑皮质及桥延脑区PARP-1阳性细胞计数结果见表1和表2。

图1 皮质额顶区PARP-1表达的免疫组化染色
Fig.1 PARP-1 immunohistochemical staining in the frontoparietal cortex area (×400)
A:正常对照组;B:DAI 30 min组;C:DAI 6 h组;D:DAI 12 h组;E:DAI 24 h组;F:DAI 7 d组。
表1 实验各组大鼠脑皮层PARP-1阳性细胞的测定结果

Tab.1 Cell counts of PARP-1 positive cells in the rat cerebral cortex in each group (±s)
与正常对照组比较,*P<0.05; DAI组组间比较,#P<0.05。
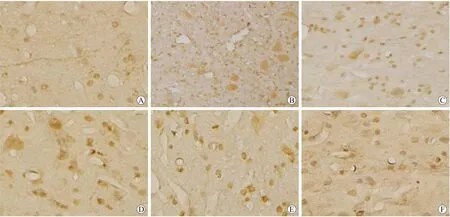
图2 桥延脑区腹侧PARP-1的免疫组化染色
Fig.2 PARP-1 immunohistochemical staining in the ventral side of pons and medulla oblongata (×400)
A:正常对照组;B:DAI 30 min组;C:DAI 6 h组;D:DAI 12 h组;E:DAI 24 h组;F:DAI 7 d组。
表2 实验各组大鼠脑桥延脑PARP-1阳性细胞的测定结果
Tab.2 Cell counts of PARP-1 positive cells in the rat pons and the medulla oblongata in each group

(±s)
与正常对照组比较,*P<0.05; DAI组组间比较,#P<0.05。
3 讨 论
PARP-1是一种核蛋白,可催化尼克酰胺二磷酸核糖NAD+转移ADP核糖基到底物蛋白并可催化合成多聚腺苷二磷酸核糖聚合物(poly ADP-ribose polymers, PAR),在维持基因完整性、控制细胞周期以及基因的表达方面起着关键的作用。PARP-1主要存在于真核细胞的细胞核中,同时亦存在于细胞质中[6]。实验证明,在病理条件下,如缺血、外伤、炎症、慢性中枢神经变性疾病中,PARP-1的过度激活可以消耗细胞内NAD+和ATP,诱导神经元的凋亡并导致中枢神经系统功能的障碍[7-8]。
ANG等[9]发现,人脑损伤后4 h出现神经元PARP-1除细胞核染色外显著的细胞质染色。本实验结果显示,在正常组神经元PARP-1存在弱表达,而在DAI组30 min时即开始表达增强,12 h达高峰且细胞质染色更强。将标本临近部位的切片进行比较可见,表达PARP-1的神经元区域与HE染色中核固缩深染的神经元区域类似。表明PARP-1作为细胞DNA链缺口探测器的作用可间接提示神经元的损伤程度,它的表达与脑皮质和桥延脑组织的结构变化呈同步性动态改变。
我们前期的研究发现,DAI后30 min即存在脑组织的缺氧表现,部分神经元轴突肿胀,线粒体电子密度降低、结构模糊[10-11]。本研究结果显示,在DAI超早期(30 min),HE染色并未出现明显的微循环障碍特征,但此时PARP-1在皮质的表达已经较为明显,表现为细胞核与细胞质同时表达。最近研究发现,在外伤性脑损伤大鼠脑组织中提取出来的线粒体内,其中参与呼吸链功能的蛋白质可被PAR化,并出现线粒体功能的抑制[12]。PARP-1抑制剂或者外源性的PARG可防止线粒体呼吸链功能的抑制。以上实验结果均提示,在DAI后超早期时PARP-1的表达增加可能与线粒体功能紊乱及缺氧有关。
在损伤较重的6 h至24 h期间,脑组织存在着较明显的血管周间隙,提示该脑损伤存在着明显的脑循环障碍的基础,脑皮质及桥延脑干腹侧表达阳性的神经元周围可看到大量的胶质细胞的核阳性表达。目前对胶质细胞在脑损伤中激活后的作用看法不一。众所周知,PARP-1可能通过影响胶质细胞内NF-κB的转录作用从而调节多种炎症因子的释放,使用PARP抑制剂可抑制小胶质细胞的活性表达。在脑局部缺血急性期,使用PARP抑制剂下调了神经可塑性蛋白及脑原性神经营养因子的表达[13],提示PARP-1在脑缺血早期即可通过胶质细胞的激活促进神经的再生。在D’AVILA[14]等的脑损伤研究中,应用PARP-1抑制剂12 d后,可减少损伤皮层的炎症反应,改善组织结构和功能的预后。我们认为,在DAI损伤较轻的脑组织中,PARP-1可能主要通过胶质细胞的激活促进神经营养因子的产生,从而促进神经的修复和再生;而在损伤较重的脑组织中,PARP-1的过度激活主要通过胶质细胞产生强烈的炎症反应,从而促进神经元的凋亡。
此外,LI等[15]发现在DAI损伤后早期通道蛋白STIM1在大鼠脑皮层高表达与本实验中PARP-1的时程变化一致,且均在DAI后12 h达高峰。STIM1感受内质网钙的释放,其高表达可增强钙池操控钙离子通道SOCC的作用,引起细胞内钙超载。PARP-1的激活也可通过其代谢终产物ADPR激动阳离子通道TRPM2介导钙离子的内流甚至钙超载[16]。因此,是否当PARP-1过度激活时,也可通过对通道蛋白STIM1的调节,诱导神经元细胞内钙离子超载及轴突损伤,尚需进一步探讨。
综上所述,本实验初步表明,PARP-1在DAI后皮质与脑干呈明显规律性表达;其变化规律与皮质和脑干的结构变化呈同步性动态改变;PARP-1可能在DAI后的继发性脑损伤中起重要作用。
此外,本研究尚有几点不足:①虽然本实验结果提示PARP-1参与了DAI后的继发性脑损伤作用,但PARP-1影响DAI后轴突结构改变的可能机制没有涉及,尚需进一步的研究;②PARP抑制剂对不同程度DAI中神经细胞功能的改善是否一致,以及临床应用的可能性,还有待进一步探讨。
[1] 宋锦宁,刘守勋,戈治理,等. 脑弥漫性轴索损伤的特点及临床诊断[J]. 中国神经精神疾病杂志, 1997, 23(3):141-144,197.
[2] WAXMAN SG, BLACK JA, RANSOM BR, et al. Anoxic injury of rat optic nerve: ultrastructural evidence for coupling between Na+influx and Ca(2+)-mediated injury in myelinated CNS axons[J]. Brain Res, 1994, 644(2):197-204.
[3] VIRAG L, SZABO C. The therapeutic potential of poly(ADP-ribose) polymerase inhibitors[J]. Pharmacol Rev, 2002, 54(3):375-429.
[4] 刘晓斌,宋锦宁,陈景宇,等. 弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学报:医学版, 2008, 29(5):595-598.
[5] PAXINOS G, WATSON C. 大鼠脑立体定位图谱[M]. 诸葛启钏,译.北京:人民卫生版社, 2005.
[6] COOKSON MR, INCE PG, USHER PA, et al. Poly(ADP-ribose) polymerase is found in both the nucleus and cytoplasm of human CNS neurons[J]. Brain Res, 1999, 834(1-2):182-185.
[7] BA X, GARG NJ. Signaling mechanism of poly(ADP-ribose) polymerase-1 (PARP-1) in inflammatory diseases[J]. Am J Pathol, 2011, 178(3):946-955.
[8] ALANO CC, GARNIER P, YING W, et al. NAD+ depletion is necessary and sufficient for poly(ADP-ribose) polymerase-1-mediated neuronal death[J]. J Neurosci, 2010, 30(8):2967-2978.
[9] ANG BT, YAP E, LIM J, et al. Poly (adenosine diphosphate-ribose) polymerase expression in human traumatic brain injury[J]. J Neurosurg, 2003, 99(1):125-130.
[10] 宋锦宁,刘晓斌,张芬茹,等. 大鼠脑弥漫性轴索损伤后脑组织乏氧代谢的实验研究[J]. 中华外科杂志, 2008, 46(5):395-396.
[11] 宋锦宁,陈景宇,刘晓斌,等. 大鼠弥漫性轴突损伤后脑血管微循环障碍的超微结构特征与动态变化[J]. 中国急救医学, 2007, 27(12):1106-1109.
[12] LAI Y, CHEN Y, WATKINS SC, et al. Identification of poly-ADP-ribosylated mitochondrial proteins after traumatic brain injury[J]. J Neurochem, 2008, 104(6):1700-1711.
[13] MADINIER A, BERTRAND N, MOSSIAT C, et al. Microglial involvement in neuroplastic changs following focal brain ischemia in rats[J]. PLoS One, 2009, 4(12):e8101.
[14] D’AVILA JC, LAM TI, BINGHAM D, et al. Microglial activation induced by brain trauma is suppressed by post-injury treatment with a PARP inhibitor[J]. J Neuroinflammation, 2012, 9:31.
[15] LI Y, SONG J, LIU X, et al. High expression of STIM1 in the early stages of diffuse axonal injury[J]. Brain Res, 2013, 1495:95-102.
[16] WYRSCH P, BLENN C, BADER J, et al. Cell death and autophagy under oxidative stress: roles of poly(ADP-Ribose) polymerases and Ca(2+)[J]. Mol Cell Biol, 2012, 32(17):3541-3553.
(编辑 卓选鹏)
The expression and significance of PARP-1 after diffuse axonal injury in the rat brain
XI Lei1,2, SONG Jin-ning1, ZHAO Xiu1, LI Dan-dong1, LIU Xiao-bin1, GU Hua1
(1. Department of Neurosurgery, the First Affiliated Hospital, Medical School ofXi’an Jiaotong University, Xi’an 710061; 2. Department of Neurosurgery,the First People’s Hospital of Yangquan City, Yangquan 045000, China)
Objective To investigate the dynamic expression and significance of poly(ADP-ribose) polymerase-1(PARP-1) after diffuse axonal injury (DAI) in the rat brain. Methods Thirty-six healthy adult male SD rats were divided into 6 groups randomly: normal control group, 30 min post-DAI group, 6 h post-DAI group, 12 h post-DAI group, 24 h post-DAI group, and 7d post-DAI group, with 6 rats in each group. The DAI model was produced by lateral head rotation device. The cortex and the brain stem were removed for HE staining, silver staining and PARP-1 immunohistochemistry. The positive cells counting method was applied to perform semiquantitatively statistical analysis. The data were determined by analysis of one-way ANOVA, followed by SNK-qtests. Results Axonal balls were observed in the cortex and the brain stem with silver staining under the light microscope. Axonal swelling, karyopyknosis, endothelial swelling, and peri-vascular space enlarging of various severity were seen in the cortex and the brain stem. The above-mentioned morphological changes reached the peak from 12 h to 24 h after DAI. PARP-1 was expressed a little in the nucleus of neuron and glial cells in the normal control group, while it was expressed mainly in the nucleus and also the positive staining existed in the cytoplasm in the DAI groups. The number of positive cells increased obviously in the cortex and the brain stem at 30 min, peaked at 12 h and decreased at 24 h in DAI groups. The number of positive cells in the cortex after DAI on the 7 d was still higher than the normal level (P<0.05), while in the brain stem it was not significantly different between the DAI groups and the normal control group (P>0.05). Conclusion PARP-1 is expressed regularly in the cortex and the brain stem after DAI, which dynamically varies with the structural changes of the cortex and the brain stem after DAI. PARP-1 may play an important role in secondary brain injury after DAI.
brain injury; diffuse axonal injury; poly (ADP-ribose) polymerase-1 (PARP-1)
2014-04-21
2014-07-05
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁,博士,教授,主任医师,博士生导师. E-mail: jinnings@126.com
郗磊(1982-),男(汉族),主治医师,硕士. 研究方向:脑血管病、颅脑外伤的基础及临床. E-mail: xileis@126.com
时间:2014-09-18 09∶51 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140918.0951.001.html
R651.1
A
10.7652/jdyxb201406009

