Lgr5在慢性浅表性胃炎中的表达*
周小嫔, 王佐妤, 刘彩红, 谢立群
(武警后勤学院附属医院消化内科,天津 300162)
Lgr5在慢性浅表性胃炎中的表达*
周小嫔, 王佐妤, 刘彩红, 谢立群△
(武警后勤学院附属医院消化内科,天津 300162)
目的: 探讨富含亮氨酸重复序列的G蛋白偶联受体5(Lgr5)在慢性浅表性胃炎中的表达及其临床意义。方法: 将30只Wistar大鼠随机分为空白组、模型组和对照组。采用0.02%氨水合并饥饱失常法对大鼠进行慢性浅表性胃炎造模,模型复制成功后,采用免疫组化、Western blotting和RT-PCR检测各组中Lgr5的mRNA及蛋白的表达水平。结果: Lgr5主要在细胞的胞膜和胞浆中表达,模型组中Lgr5 mRNA和蛋白表达水平高于对照组和空白组大鼠(P<0.01),对照组和空白组中Lgr5表达水平差异不显著(P>0.05)。结论: 持续的炎症刺激导致Lgr5表达增加,Lgr5可能是一种炎性的促肿瘤因子。
Lgr5蛋白; Wnt信号通路; 慢性浅表性胃炎
富含亮氨酸重复序列的G蛋白偶联受体5(leucine-rich repeat-containing G-protein-coupled receptor 5, Lgr5)又名GPR49,是一种G蛋白偶联受体,是Wnt信号通路的一种靶基因,还是一种潜在的人类肠干细胞标志物[1-3]。已有研究表明Lgr5在人类不同肿瘤的发生中起重要作用,包括肝癌、基底细胞癌、结肠癌、卵巢癌和食管癌等等[4-7]。近年来发现Lgr5与胃癌的发生发展也十分密切。慢性浅表性胃炎(chronic superficial gastritis, CSG)是多种诱因引起的慢性胃黏膜炎症,由攻击因子和/或防御因子失衡所导致部分浅表性胃炎,属于消化系统的常见病、多发病之一[8]。其失于治疗极易进展为慢性萎缩性胃炎继而发生癌变。本研究主要观察大鼠慢性浅表性胃炎胃组织中Lgr5表达的变化,从而在早期发现其与胃癌发展的相关性,起到早期发现并预防胃癌的进一步发展。
材 料 和 方 法
1 试剂
TRIzol试剂(Invitrogen);RT-PCR试剂盒(TransGen);β-actin抗体(中国博奥森公司);Lgr5抗体(Epitomics);II抗(Abgent)。
2 实验动物及分组
将30只成年雄性7周龄Wistar大鼠编号,称重,按随机数字表顺序分为3组、即空白(blank)组,对照(control)组和模型(model)组,每组10只。
3 主要方法
3.1 建立动物模型 参照王睿琦等[9]研究的慢性浅表性胃炎造模法,空白组的动物不做任何处理,正常饲养,自由饮水;对照组的大鼠正常饲养,并给予0.9%生理盐水每日自由饮用;模型组的大鼠0.02%氨水自由饮用(现配),饥饱失常(进食2 d,禁食1 d)。所有大鼠饲养6个月。
3.2 RT-PCR 模型复制成功后,每组取6只大鼠麻醉处死,无菌条件下取胃窦组织,用TRIzol法提取总RNA并逆转录为cDNA。利用Pubmed-blast设计目的基因引物(引物由北京鼎国生物科技公司合成)。Lgr5和内参照β-actin基因的引物序列见表1。RT-PCR反应条件为95 ℃5 min,94 ℃30 s、59 ℃30 s、72 ℃45 s,共35个循环。产物行2%琼脂糖凝胶电泳,用捷达图像分析系统捕获图像并用灰度扫描分析结果。

表1 RT-PCR引物序列
3.3 Western blotting检测 模型复制成功后取材,每100 mg组织样本加入100 μL裂解液,充分研磨后于冰上裂解10 min, 12 000 r/min离心10 min,取上清液。BCA试剂盒测定蛋白浓度后,取60 μg蛋白样本,经SDS-PAGE分离后转至硝酸纤维素膜,脱脂奶粉封闭1 h,加入Lgr5的 I 抗,4 ℃过夜,洗膜后加II抗,37 ℃孵育1 h。使用ECL液显色,最后进行显影、定影,用Bio-Rad凝胶成像系统扫描吸光度值,用Image-Pro Plus 6.0软件进行分析。定量结果应用GraphPad Prism 6.0统计软件作图。
3.4 HE染色 造模成功后,将大鼠麻醉处死,取胃窦组织置于10%多聚甲醛固定,石蜡包埋,切片放在60 ℃烘箱中烘烤30 min,常规脱蜡,流水冲洗10 min后,苏木素染色3 min。随后用流水冲洗10 min,伊红复染2 min,流水冲洗10 min,乙醇脱水,二甲苯2次透明,中性树胶封固。每张切片在200倍显微镜下随机选择4个视野进行观察。
3.5 免疫组织化学染色 造模成功后,应用兔超敏二步法免疫组化试剂盒行免疫组化染色,大鼠胃组织切片用3%的H2O2封闭10 min后,用pH 6.0的枸橼酸溶液加热孵育15 min行抗原修复。冷却至室温后用5 %的山羊血清37 ℃封闭30 min。滴加Lgr5的Ⅰ抗(工作浓度1∶150),4 ℃过夜。PBS清洗后滴加II抗37 ℃孵育45 min。PBS清洗后DAB显色剂显色,冲洗,苏木素复染,常规梯度乙醇脱水,二甲苯透明,中性树脂封片。在Nikon偏振光倒置显微镜下观察免疫阳性反应物的分布与定位。随机选取5个不重复视野,镜下计数形态完整的Lgr5阳性细胞,计算各组的平均阳性细胞数。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),两两比较采用Dunnett-t检验,以P<0.05为差异有统计学意义。
结 果
1 Lgr5 mRNA表达的变化
与空白组相比,模型组Lgr5 mRNA表达量增加3.53倍,两者差异显著(P<0.01),而空白组和对照组间差异无统计学意义(P>0.05),见图1。

Figure 1.The mRNA expression of Lgr5 determined by RT-PCR. Mean±SD.n=6.**P<0.01vsblank and control groups.
图1 Lgr5 mRNA的 表达
2 Lgr5蛋白的表达变化
经Western blotting实验进一步在蛋白水平验证,发现模型组中的Lgr5蛋白表达(23.5±0.7)较空白组(12.5±0.6)明显增高,两者差异显著(P<0.01),但空白组和对照组间差异无统计学意义(P>0.05),见图2。
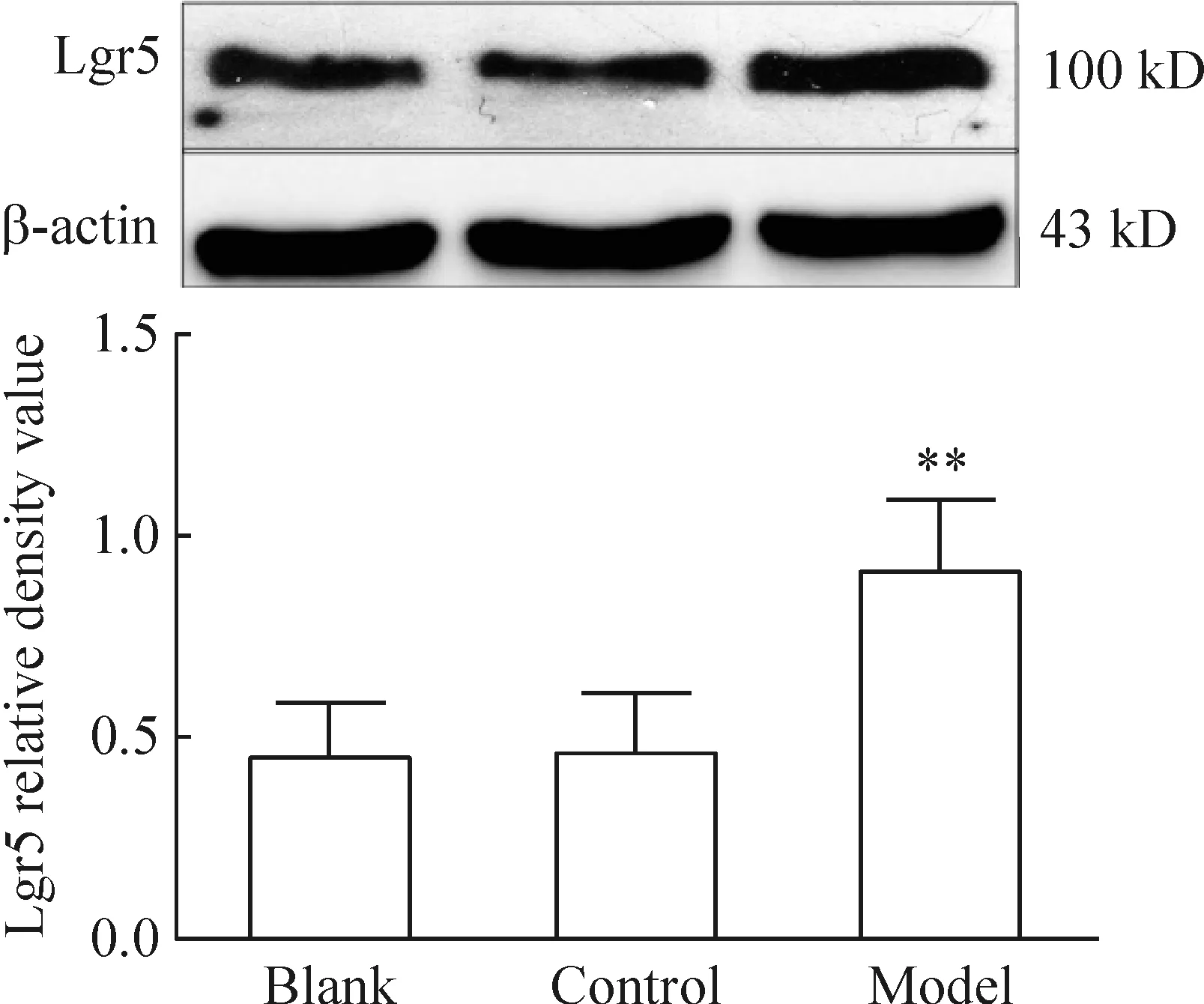
Figure 2.The protein expression of Lgr5 determined by Western blotting. Mean±SD.n=6.**P<0.01vsblank and control groups.
图2 Lgr5 蛋白的表达
3 HE染色结果胃窦组织的病理变化
空白组和对照组胃组织未见异常改变,模型组胃窦黏膜固有膜、黏膜肌及黏膜下见炎细胞浸润,见图3。
4 Lgr5免疫阳性产物染色结果
Lgr5阳性产物主要定位于细胞的胞质和胞浆中,空白组和对照组免疫阳性产物表达量较低,模型组(224±11)较空白组(76±5)和对照组(81±3)表达量明显增加(P<0.05),见图4。
讨 论
Lgr5是具有18个富含亮氨酸的重复单位和7个跨膜区域组成的大分子蛋白,是G蛋白偶联受体家族的成员之一,Lgr5在人体分布广泛,在大脑、脊髓、乳腺、毛囊、眼睛、生殖器官及胃肠道等都有表达[1,10-13]。
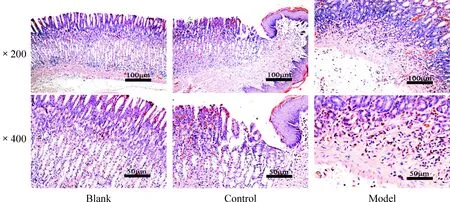
Figure 3.The gastric pathological changes in the 3 groups.
图3 各组大鼠胃组织的病理改变
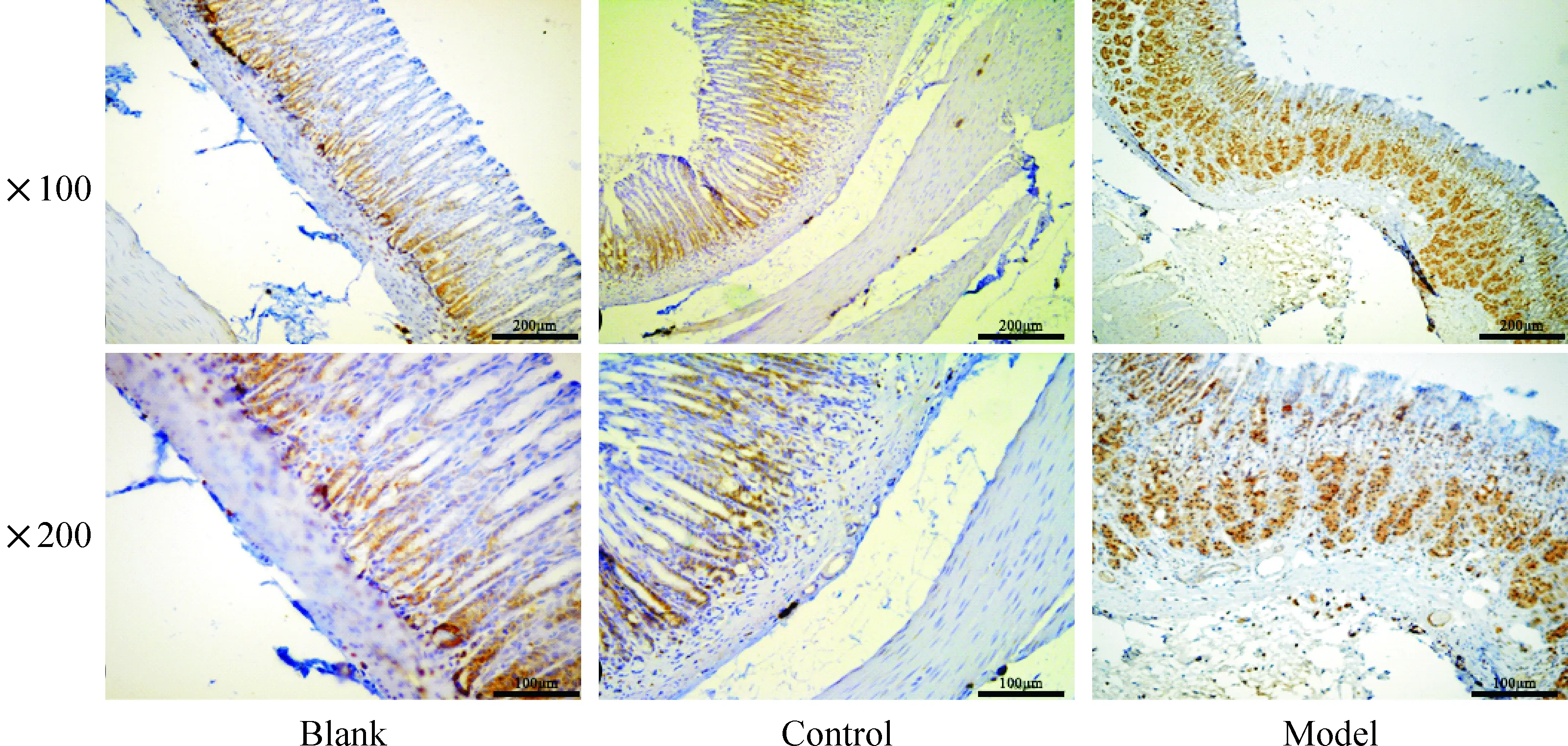
Figure 4.The protein expression of Lgr5 in gastric tissues (immunohistochemistry staining).
图4 各组大鼠胃组织的Lgr5表达
Wnt信号传导通路可影响和调控干细胞的自我更新和分化,在细胞增殖、分化、运动及凋亡过程中发挥重要作用,其异常表达或激活能引起肿瘤。经典的Wnt转导通路(Wnt/β-catenin)是Wnt蛋白与卷曲蛋白受体(Fizzled)结合,使活化的Fizzled作用于细胞浆的蓬乱蛋白,从而抑制由轴蛋白、肠腺瘤样息肉蛋白和糖原合成激酶GSK-3β组成的复合物的活性,使β-catenin不能被GSK-3β磷酸化。由于非磷酸化的β-catenin不能被蛋白酶体降解,从而导致β-catenin在胞浆内积聚,并移向核内。与转录因子TCF/LEF结合,激活TCF转录活性,调节Wnt靶基因的表达[14-15]。
Wnt信号通路都对肿瘤的发生、发展和预后起着关键性的作用,而Lgr5 不仅是Wnt信号通路的靶基因,而且在多种肿瘤组织中高表达,Fan等[16]采用免疫组织化学法在结肠癌组织中发现 Lgr5与β-catenin在结肠癌组织中高表达并且呈正相关, 由此推断Lgr5可能通过Wnt/β-catenin通路参与结肠癌的发生。近年来研究发现Lgr5在胃癌组织中也过度表达并伴有β-catenin核表达,Wnt通路异常激活引起靶基因Lgr5表达增高与胃癌的发生发展密切相关。Lgr5在各种肿瘤中过度表达,所以推测Lgr5是多种不同肿瘤干细胞标记物。Wnt通路不光与肿瘤相关,还参与一些炎症反应。Sen等[17]和Polzer等[18]证实Wnt信号参与一些慢性炎症疾病,如风湿样关节炎、动脉粥样硬化。有研究[19]表明损伤能驱动内源性Wnt通路, 激活Wnt信号参与损伤组织的修复、愈合和再生。慢性浅表性胃炎是慢性胃炎中的一种,消化系统多发病之一。部分浅表性胃炎不引起重视极易进展为慢性萎缩性胃炎而致胃癌发生,持续炎症可导致细胞微环境改变,干细胞长期积累突变,使得生物学行为永久性改变,最终导致肿瘤发生,干细胞和炎症均与胃癌的发生发展相关。我们主要想研究发现Lgr5在部分慢性浅表性胃炎中表达情况,在本研究中发现模型组大鼠胃组织中Lgr5蛋白及基因表达水平都高于正常组,且差异有统计学意义。长时间刺激药物灌胃对大鼠胃组织造成持续的炎症刺激,持续的炎症可能激活Wnt经典信号通路,而Lgr5又是Wnt通路的靶基因,从而引起Lgr5表达增加。所以我们推测Lgr5也可能为一种炎性促肿瘤重要因子。
[1] Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker geneLgr5[J]. Nature, 2007, 449(7165):1003-1007.
[2] Pinson KI, Brennan J, Monkley S, et al. An LDL-receptor-related protein mediates Wnt signalling in mice[J]. Nature, 2000, 407(6803):535-538.
[3] Van der Flier LG, Sabates-Bellver J, Oving I, et al. The intestinal Wnt/TCF signature [J]. Gastroenterology, 2007,132(2):628-632.
[4] Yamamoto Y, Sakamoto M, Fujii G, et al. Overexpression of orphan G-protein-coupled receptor, Gpr49, in human hepatocellular carcinomas with beta-catenin mutations[J]. Hepatology, 2003, 37(3):528-533.
[5] Tanese K, Fukuma M, Yamada T, et al. G-protein-coupled receptor GPR49 is up-regulated in basal cell carcinoma and promotes cell proliferation and tumor formation[J]. Am J Pathol, 2008,173(3):835-843.
[6] McClanahan T, Koseoglu S, Smith K, et al. Identification of overexpression of orphan G protein-coupled receptor GPR49 in human colon and ovarian primary tumors[J]. Cancer Biol Ther, 2006, 5(4):419-426.
[7] von Rahden BH, Kircher S, Lazariotou M, et al. LgR5 expression and cancer stem cell hypothesis: clue to define the true origin of esophageal adenocarcinomas with and without Barrett’s Esophagus?[J]. J Exp Clin Cancer Res, 2011, 30:23.
[8] 中华医学会消化病分会. 中国慢性胃炎共识意见[J]. 现代消化及介入诊疗, 2007, 12(1):55-62.
[9] 王睿琦,侯培珍,刘文滨,等. 疏肝和胃颗粒对大鼠实验性慢性浅表性胃炎的治疗研究[J]. 内蒙古中医药, 2008, 1(1):55-57.
[10]Plaks V, Brenot A, Lawson DA, et al. Lgr5-expressing cells are sufficient and necessary for postnatal mammary gland organogenesis[J]. Cell Rep, 2013, 3(1):70-78.
[11]Mardaryev AN, Meier N, Poterlowicz K, et al. Lhx2 differentially regulates Sox9, Tcf4 and Lgr5 in hair follicle stem cells to promote epidermal regeneration after injury[J]. Development, 2011, 138(22):4843-4852.
[12]Nakata S, Campos B, Bageritz J, et al. LGR5 is a marker of poor prognosis in glioblastoma and is required for survival of brain cancer stem-like cells[J]. Brain Pathol, 2013, 23(1):60-72.
[13]de Visser KE, Ciampricotti M, Michalak EM, et al. Developmental stage-specific contribution of LGR5+cells to basal and luminal epithelial lineages in the postnatal mammary gland[J]. J Pathol, 2012, 228(3): 300-309.
[14]Katoh M, Katoh M. WNT signaling pathway and stem cell signaling network[J]. Clin Cancer Res, 2007, 13(14):4042-4045.
[15]郭志雷,左 伋,金惠铭. Wnt-frizzled信号通路与心血管疾病关系的研究进展[J]. 中国病理生理杂志, 2004, 20(11):2134-2138.
[16]Fan XS, Wu HY, Yu HP, et al. Expression of Lgr5 in human colorectal carcinogenesis and its potential correlation with beta-catenin[J]. Int J Colorectal Dis, 2010, 25(5):583-590.
[17]Sen M, Lauterbach K, El-Gabalawy H, et al. Expression and function of wingless and frizzled homologs in rheumatoid arthritis[J]. Proc Natl Acad Sci U S A, 2000, 97(6):2791-2796.
[18]Polzer K, Diarra D, Zwerina J, et al. Inflammation and destruction of the joints: the Wnt pathway[J]. Joint Bone Spine, 2008, 75(2):105-107.
[19]Whyte JL, Smith AA, Helms JA. Wnt signaling and injury repair[J]. Cold Spring Harb Perspect Biol, 2012, 4(8): a008078.
Expression of Lgr5 in chronic superficial gastritis
ZHOU Xiao-pin, WANG Zuo-yu, LIU Cai-hong, XIE Li-qun
(DepartmentofGastroenterology,AffiliatedHospitalofLogisticsCollegeofChineseArmedPoliceForces,Tianjin300162,China.E-mail:xieliqun66@hotmail.com)
AIM: To investigate the expression and significance of Leucine-rich repeat-containing G-protein-coupled receptor 5 (Lgr5) in chronic superficial gastritis. METHODS: The Wistar rats (n=30) were randomly divided into blank group, model group and control group. The Wistar rat model of chronic superficial gastritis was established by intragastric administration of 0.02% ammonia and long-term irregular diet. All rats were sacrificed, and gastric tissues were harvested and stained with hematoxylin and eosin. The expression of Lgr5 at mRNA and protein levels was analyzed by reverse transcriptional polymerase chain reaction, Western blotting and immunohistochemistry. RESULTS: Lgr5 was mainly expressed in the cell membrane and cytoplasm. Lgr5 showed high expression in model group compared with blank group and control group. No obvious difference between blank group and control group was observed. CONCLUSION: Persistent inflammation leads to increased expression of Lgr5. Lgr5 may be a proinflammatory tumor promoting factor.
Lgr5 protein; Wnt signaling pathway; Chronic superficial gastritis
1000- 4718(2014)12- 2272- 04
2014- 06- 03
2014- 10- 15
武警后勤学院院级科学基金资助项目(No. WHM201311)
R573.3+1
A
10.3969/j.issn.1000- 4718.2014.12.028
△通讯作者Tel: 022-60578661; E-mail: xieliqun66@hotmail.com

