ROS/PKC/p38 MAPK途径在山茱萸多糖抑制心肌细胞缺氧/复氧损伤的作用*
来丽娜, 宋丽华, 张晓京, 张晓一, 雷静文, 刘 芳, 郭春花, 宋晓亮
(长治医学院药学系,山西 长治 046000)
ROS/PKC/p38 MAPK途径在山茱萸多糖抑制心肌细胞缺氧/复氧损伤的作用*
来丽娜, 宋丽华, 张晓京, 张晓一, 雷静文, 刘 芳, 郭春花, 宋晓亮△
(长治医学院药学系,山西 长治 046000)
目的: 观察山茱萸多糖(polysaccharide fromFructuscorni,PFC)对缺氧/复氧(hypoxia/reoxygenation,H/R)损伤心肌细胞的保护作用,并探讨其对ROS/PKC/p38 MAPK途径的影响。方法: 分离原代乳鼠心肌细胞,建立H/R模型,细胞分为7组:正常对照组(N组)、缺氧/复氧组(H/R组)、缺氧/复氧+PFC(终浓度20 mg/L、100 mg/L和200 mg/L)预处理组、缺氧/复氧+PFC(100 mg/L)预处理+蛋白激酶C特异性阻断剂chelerythrine(1 μmol/L)组及缺氧/复氧+PFC(100 mg/L)预处理+p38 MAPK特异性阻断剂SB203580(10 μmol/L)组。倒置显微镜下观察细胞形态和自发搏动频率,Hoechst 33258染色观察细胞凋亡率,酶标仪测定ROS含量、SOD活性及LDH漏出量,免疫印迹法检测PKC、p-p38 MAPK和HSP70的蛋白水平。结果: H/R组细胞活力下降,搏动频率减慢,细胞ROS含量、LDH漏出量、细胞凋亡率及p-p38 MAPK的水平均较N组显著增加(P<0.01)。经PFC预处理后,细胞搏动频率、SOD活性及PKC、HSP70的水平较H/R 组显著增加(P<0.05,),p-p38 MAPK的水平和细胞凋亡率均减少(P<0.05),而PFC的保护作用能被chelerythrine或SB203580抑制。结论: 山茱萸多糖可抑制心肌细胞缺氧/复氧损伤,其作用可能与增加SOD活性、抑制ROS产生、激活PKC并抑制p38MAPK的过度激活有关。
山茱萸; 多糖; 缺氧/复氧; 心肌细胞; 活性氧
许多研究表明蛋白激酶C(protein kinase C,PKC)激活是缺血预处理中细胞保护信号传导的中心环节[1],丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)可能也参与了缺血预处理对心肌的保护作用[2]。心肌缺血再灌注可诱发细胞内活性氧(reactive oxygen species,ROS)产生增多,氧化应激水平升高,发生细胞损伤[3]。但有研究表明,氧化应激也可激活PKC和MAPKs信号转导通路[4]。可见PKC和MAPKs信号转导通路的激活在不同情况下可能会产生不同的作用。山茱萸多糖(polysaccharide fromFructuscorni,PFC)有强大的抗氧化能力[5]。我们前期研究也证实PFC可以抑制心肌缺血再灌注损伤,其机制与显著的抗氧化性有关。本研究分离原代乳鼠心肌细胞,建立缺氧/复氧(hypoxia/reoxygenation,H/R)模型模拟在体心肌缺血再灌注(ischemia/reperfusion,I/R)的病变过程,并选用特异性通路抑制剂,从细胞水平观察PFC对心肌细胞缺氧复氧损伤的作用,探讨其对ROS/PKC/p38MAPK途径的影响。
材 料 和 方 法
1 动物
清洁级SD大鼠,出生1 d之内,雌雄不限。
2 主要试剂
山茱萸多糖由本实验室自制,经硫酸-苯酚法测定其多糖含量为81%。高糖DMEM培养基购自Gibco;胎牛血清购自杭州四季青生物有限公司;所用Ⅰ抗均购自Abcam;chelerythrine chloride和SB203580购自LC Laboratories;Western blotting所用相关试剂和Hoechst 33258均购自碧云天生物技术有限公司;ROS、SOD和LDH测定试剂盒购自南京建成生物工程研究所;厌氧产气袋购自上海新睿生物科技有限公司。
3 方 法
3.1 原代心肌细胞的分离、培养[6]应用胰蛋白酶和Ⅱ型胶原酶分离心肌组织,采用差速贴壁法,去除先贴壁的非心肌细胞,将尚未贴壁的心肌细胞悬液,调整细胞浓度为5.5×108/L,加入终浓度为0.1 mmol/L的BrdU,移入12孔培养板中培养48 h后换液以备后续实验。
3.2 心肌细胞纯度鉴定 取培养72 h心肌细胞爬片,PBS冲洗3次,-20 ℃冰丙酮固定20 min,α-actinⅠ抗37 ℃孵育3 h,辣根过氧化物酶标记的Ⅱ抗孵育1 h,DAB显色。
3.3 H/R损伤模型的建立及分组 将心肌细胞分为7组,每组3个复孔:①正常对照组(normal,N);② 缺氧/复氧组(H/R):在密闭的小空间内放入厌氧产气袋,待指示剂变色后开始计时,缺氧1 h,95% O2、5% CO2复氧2 h;③~⑤ PFC预处理组:提前24 h各孔加入PFC,其终浓度分别为20、100和200 mg/L(依次命名为PFC1+H/R、PFC2+H/R和PFC3+H/R组),然后进行第②组的步骤;⑥ 在PFC(100 mg/L)预处理前用chelerythrine(1 μmol/L)与细胞孵育30 min后,再进行PFC预处理操作,即为CHE+PFC2+H/R组;⑦ 在PFC(100 mg/L)预处理前用SB203580(10 μmol/L)与细胞孵育30 min后,再进行PFC预处理操作,即为SB+PFC2+H/R组。
3.4 心肌细胞活力和凋亡率 心肌细胞培养72 h,每孔任意5个视野镜下计数细胞的搏动频率。4%多聚甲醛固定细胞爬片30 min,PBS清洗,加Hoechst 33258(1 mg/L)37℃孵育20 min,封片,荧光显微镜观察细胞凋亡情况,以每个视野凋亡细胞数/细胞总数×100%为凋亡率。
3.5 LDH漏出量、ROS含量及SOD活性 复氧结束后,吸取细胞上清液羟胺法测定SOD活性,微板法测定LDH漏出量,裂解细胞,化学荧光法测定ROS含量,操作步骤严格按说明书进行,以上指标均在多功能酶标仪上(TECAN)检测。
3.6 Western blotting分析PKC、p-p38和HSP70的蛋白表达水平 冰上裂解细胞,蛋白定量,蛋白电泳后转移到NC膜上,5%脱脂奶粉封闭1 h后加入PKC、p-p38、HSP70Ⅰ抗,4 ℃过夜,次日与碱性磷酸酶偶联的Ⅱ抗(Promega)杂交,Western blue(Promega)显色。采用Image-Pro Plus 7.0图像分析软件测定目的蛋白条带的灰度值,计算与内参照GAPDH条带灰度值的比值。
4 统计学处理
采用SPSS 13.0软件进行数据分析。数据均用均数±标准差(mean±SD)表示,组间数据采用单因素方差分析,以P<0. 05为差异有统计学意义。
结 果
1 原代心肌细胞的形态及纯度鉴定
培养6 h后细胞开始贴壁,24 h后已有心肌细胞伸出伪足,形态多样,培养72 h后,细胞成簇生长,出现明显节律性搏动。细胞爬片α-actin免疫组化染色阳性细胞达95%以上,见图 1。

Figure 1.Culture and identification of neonatal rat primary cardiomyocytes. A: primary cardiomyocytes cultured for 24 h (×200); B: primary cardiomyocytes cultured for 72 h (×200); C: identification of cardiomyocytes by immunohistochemistry for the cardiac-specific α-actin (×400).
图1 原代培养乳鼠心肌细胞的培养及鉴定
2 心肌细胞搏动频率
倒置显微镜下观察N组细胞成簇生长,折光性良好,搏动明显且规律;H/R组细胞折光性下降,伪足缩短或消失,与N组比较搏动频率明显下降(P<0.01); 给予PFC(20、100和200 mg/L)后,各组细胞折光性良好,搏动有力且规律,搏动频率与H/R组相比有显著差异(P<0.01),且有一定的剂量依赖性;CHE+PFC2+H/R组细胞形态与H/R组相似,搏动频率与H/R组接近;SB+PFC2+H/R组细胞生长状态与CHE+PFC2+H/R组相似,搏动频率明显减慢,与H/R组相比无显著差异(P>0.05),见表1。
3 细胞凋亡百分率
经Hoechst 33258染色,荧光显微镜下N组细胞呈均匀弥散的蓝色荧光,凋亡率仅为2.4%,而H/R组细胞荧光颜色不均匀,凋亡细胞出现明显致密的强蓝色荧光且呈块状聚积,其发生率达到38.3%,较N组明显增高(P<0.01);分别以浓度为20 mg/L、100 mg/L和200 mg/L的PFC预处理细胞后,细胞凋亡率分别为22.1%、10.7%和10.2%,与H/R 组相比凋亡率显著降低(P<0.05);而CHE+PFC2+H/R组与SB+PFC2+H/R组细胞凋亡率较PFC各组明显升高(P<0.05),与H/R组比较无显著差异(P>0.05),见图2、表1。
表1 细胞搏动频率及凋亡率的比较
Table 1.Comparison of apoptotic rates and beating frequencies in the rat cardiomyocytes with different treatments (Mean±SD.n=6)
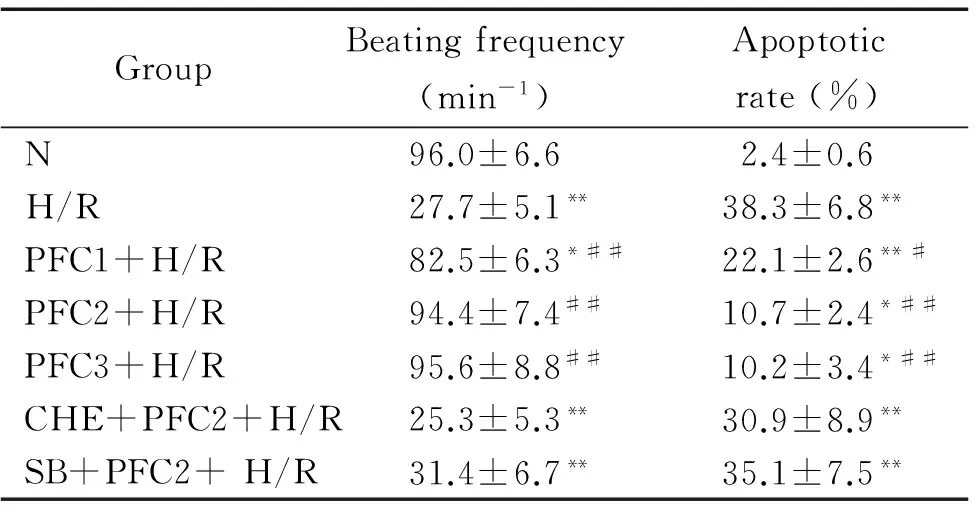
GroupBeatingfrequency(min-1)Apoptoticrate(%)N96.0±6.62.4±0.6H/R27.7±5.1**38.3±6.8**PFC1+H/R82.5±6.3*##22.1±2.6**#PFC2+H/R94.4±7.4##10.7±2.4*##PFC3+H/R95.6±8.8##10.2±3.4*##CHE+PFC2+H/R25.3±5.3**30.9±8.9**SB+PFC2+H/R31.4±6.7**35.1±7.5**
TableP<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsH/R group.
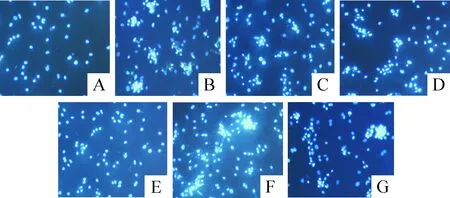
Figure 2.Hoechst 33258 staining of neonatal rat cardiomyocytes (×100). A: normal group; B: H/R group; C: PFC1+H/R group; D: PFC2+H/R group; E: PFC3+H/R group; F: CHE+PFC2+H/R group; G: SB+PFC2+H/R group.
图2 乳鼠心肌细胞Hoechst 33258染色
4 LDH漏出量和SOD活力
N组细胞生长状态良好,细胞培养液LDH活性为404.32 U/L;H/R组细胞经过缺氧/复氧后膜通透性增高,培养液LDH活性显著升高至924.01 U/L,与N组比较差异显著(P<0.01);以不同浓度PFC预处理后,其细胞培养液LDH活性均较H/R组降低(P<0.01),且呈剂量依赖性;而CHE+PFC2+H/R组与SB+PFC2+H/R组LDH漏出量较PFC各组明显升高(P<0.01),与H/R组比较无显著差异(P>0.05)。N组细胞培养液SOD活性为35.13×103U/L;H/R组培养液SOD活性显著下降至17.45×103U/L,与N组比较差异显著(P<0.01);而PFC各组细胞培养液SOD活性均较H/R组升高(P<0.05);CHE+PFC2+H/R组与SB+PFC2+H/R组SOD活性均较PFC各组显著下降(P<0.01),与H/R组比较无显著差异(P>0.05),见表2。
表2 各组LDH漏出量和SOD活力的比较
Table 2.Comparison of LDH leakage and SOD activity in the rat cardiomyocytes with different treatments (Mean±SD.n=6)
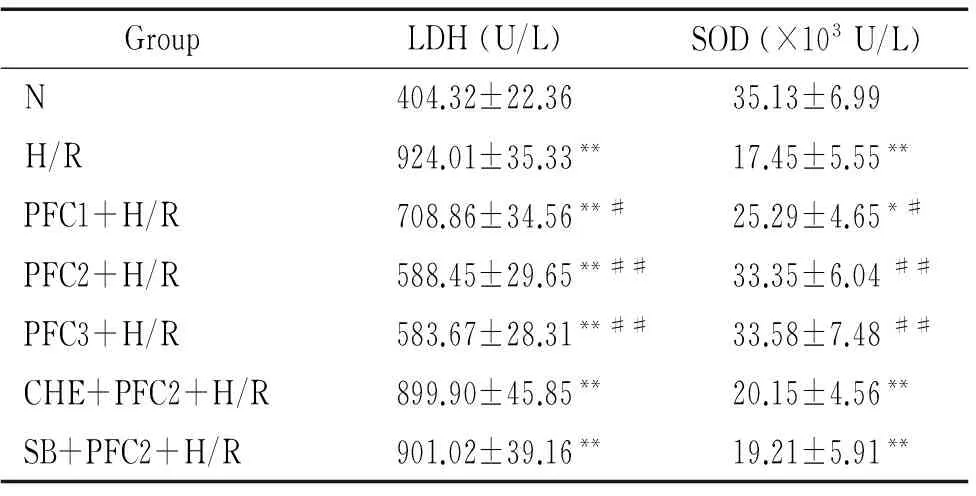
GroupLDH(U/L)SOD(×103U/L)N404.32±22.3635.13±6.99H/R924.01±35.33**17.45±5.55**PFC1+H/R708.86±34.56**#25.29±4.65*#PFC2+H/R588.45±29.65**##33.35±6.04##PFC3+H/R583.67±28.31**##33.58±7.48##CHE+PFC2+H/R899.90±45.85**20.15±4.56**SB+PFC2+H/R901.02±39.16**19.21±5.91**
TableP<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsH/R group.
5 细胞ROS释放量
把N组的荧光强度定为1,与N组相比,H/R组细胞内ROS 释放量增加(P<0.01);以不同浓度PFC预处理后,其细胞裂解液中的荧光强度较H/R组显著下降(P<0.05),但仍高于N组(P<0.05);而CHE+PFC2+H/R组与SB+PFC2+H/R组细胞内ROS 释放量较PFC各组明显升高(P<0.01),与H/R组比较无显著差异(P>0.05),见图3。
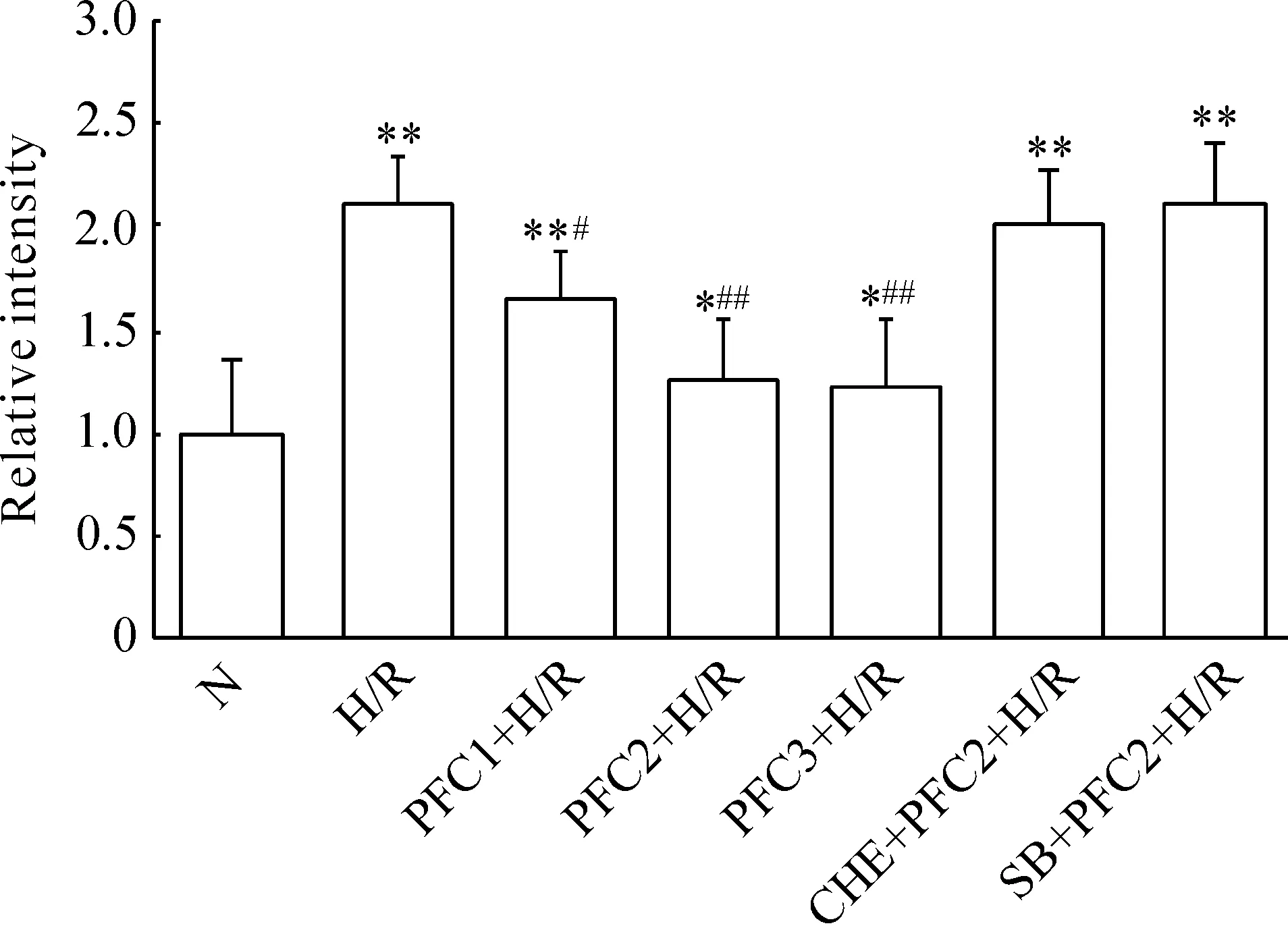
Figure 3.ROS content in the rat cardiomyocytes with different treatments. Mean±SD.n=6.*P<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsH/R group.
图3 心肌细胞的ROS含量
6 心肌细胞PKC、p-p38 MAPK和HSP70蛋白表达水平的变化
H/R损伤后,心肌细胞的HSP70和p-p38 MAPK均升高,与正常组相比差异显著(P<0.01),而PKC蛋白水平与正常组比较未见升高(P>0.05);应用PFC(100 mg/L)后,HSP70和PKC的蛋白水平显著升高,与H/R组比较差异显著(P<0.01),而p-p38 MAPK 较H/R组的水平下降(P<0.05)。CHE+PFC2+H/R组和SB+PFC2+H/R组的HSP70与PFC2+H/R组相比显著下降,CHE+PFC2+H/R组的PKC蛋白水平较PFC2+H/R组显著下降(P<0.01),p38磷酸化水平也有降低(P<0.05),表明PKC抑制剂chelerythrine对磷酸化p38表达水平也有影响。SB+PFC2+H/R组的HSP70和磷酸化p38水平较PFC2+H/R组显著下降(P<0.01),而PKC水平降低不明显(P>0.05),表明p38抑制剂SB203580对PKC蛋白表达的影响不明显,见图4。
讨 论
心肌细胞缺氧导致能量代谢障碍,复氧后,氧自由基随着大量氧的涌入产生增多,造成细胞损伤[7-8]。结合预实验结果,本研究选择PFC的实验浓度为20、100 和200 mg/L。实验以细胞培养液中LDH漏出量作为心肌细胞损伤的指标。结果显示,H/R组细胞培养液中LDH漏出量明显增加,而PFC各剂量组均可减少H/R后培养液中LDH漏出量,尤以100 和200 mg/L PFC组显著,表明PFC各剂量组均可减轻细胞膜的损伤。
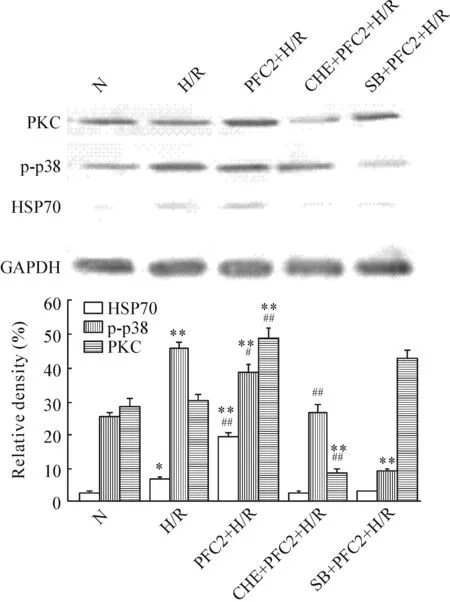
Figure 4.The protein levels of PKC, p-p38 and HSP70 in the rat cardiomyocytes detected by Western blotting. Mean±SD.n=3.*P<0.05,**P<0.01vsN group;#P<0.05,##P<0.01vsH/R group.
图4 心肌细胞PKC、p-p38和HSP70蛋白的表达
SOD可清除氧自由基,其值高低反映了机体清除氧自由基的能力[9]。实验结果表明,H/R组ROS含量明显增高,SOD的活力降低,心肌细胞形态发生变化,活力下降,而PFC各剂量组均可明显增强SOD的活力,降低细胞ROS量,提高细胞活力,也以100 和200 mg/L PFC组显著,说明PFC可通过增强细胞清除氧自由基的能力发挥对心肌细胞H/R损伤的保护作用。细胞凋亡也是心肌细胞H/R损伤的一种表现[10],实验中用Hoechst 33258染色细胞,荧光显微镜下测定表明PFC各剂量组均可降低缺氧复氧后心肌细胞凋亡率。
HSP70可参与胞内蛋白质的折叠和转运以维持机体自身的稳定性,使细胞在应激状态下能进行正常的生化反应和代谢[11],属应激状态下产生的一种内源性保护蛋白。实验中可以看到H/R组HSP70高于N组,浓度为100 mg/L PFC预处理后HSP70的表达量高于H/R组,说明PFC可以诱导HSP70的产生从而使心肌细胞耐受缺氧复氧损伤。
诱发细胞内ROS产生增多,致使氧化应激水平升高是缺血再灌注损伤的重要机制之一[12]。ROS作为信号分子可以影响多种信号转导通路,如蛋白激酶C通路、JAK/STAT通路、MAPKs等信号转导通路。它既可产生细胞损伤作用,同时也可诱导内源性抗氧化酶、诱导型一氧化氮合酶、HSP70等的表达,产生抗损伤效应[13],可见ROS的作用是双向的。有研究表明ROS可直接激活p38 MAPK通路,参与靶细胞损伤[14]。实验中可以看到H/R组ROS明显增多,PKC表达较正常组没有明显变化,而p-p38表达显著增多,说明大量的ROS可以使p38过度激活,而PFC预处理可减少ROS的产生,同时PFC预处理组PKC的表达较H/R组增高,而p-p38的表达较H/R组下降,说明PFC可上调PKC的表达,抑制过强的氧化应激,减轻p-p38的过度激活。有研究认为MAPKs和HSPs等有可能作为PKC的底物介导了心脏缺血预处理的保护作用[4]。本研究实验还观察到应用PKC抑制剂后p38的表达下调,可见抑制PKC可以阻断p38的表达,同时PFC的保护作用消失,而应用特异性的p38 MAPK信号转导通路阻断剂SB203580预处理后,PKC蛋白水平变化不大,也支持p38位于PKC的下游。然而阻断PKC并不能完全阻断p38,说明PKC可能只是p38上游信号分子之一。实验中采用chelerythrine阻断PKC活化及SB203580阻断p38磷酸化,发现PFC的保护作用可被抵消,提示PKC及p38参与了PFC对H/R的保护作用。
综上所述,PFC的抗心肌细胞H/R损伤作用的机制涉及PKC/p38 MAPK途径,其可通过增加SOD活性,降低细胞内ROS含量,上调PKC 蛋白表达水平,阻止p38 MAPK的过度激活,诱导HSP70表达来发挥保护作用。
[1] Mitchell MB, Meng X, Ao L, et al. Preconditioning of isolated rat heart is mediated by protein kinase C[J]. Circ Res, 1995, 76(1):73-81.
[2] Zhang Y, Gu EW, Zhang J, et al. Role of p38 mitogen-activated protein kinases in cardioprotection of morphine preconditioning[J]. Chin Med J (Engl), 2007, 120(9):777-781.
[3] Raat NJ, Shiva S, Gladwin MT. Effects of nitrite on modulating ROS generation following ischemia and reperfusion[J]. Adv Drug Deliv Rev, 2009, 61(4):339-350.
[4] Otani H. Reactive oxygen species as mediators of signal transduction in ischemic preconditioning[J]. Antioxid Redox Signal, 2004, 6(2):449-469.
[5] 李 平, 王艳辉, 马润宇. 山茱萸多糖 PFCAⅢ的理化性质及生物活性研究[J]. 中国药学杂志, 2003, 38(8):583-586.
[6] 张晓京, 张建栋, 来丽娜,等. SD乳鼠原代心肌细胞培养方法的改进[J]. 长治医学院学报, 2012, 26(3):171-173.
[7] Mu YL, Xie YY, Zhou L, et al. Cardioprotective effect of ‘methylamine irisolidone’, a new compound, in hypoxia/ reoxygenation injury in cultured rat cardiacmyocyte[J]. Chem Biodivers, 2009, 6(8):1170-1177.
[8] Elizabeth D, Danz B, Skramsted J, et al. Resveratrol prevents oxorubicin cardiotoxicity through mitochondrial stabilization and the Sirt1 pathway[J]. Free Rad Biol Med, 2009, 46(12):1589-1597.
[9] 喻守佳,王海英,喻 田,等. Nrf2-ARE 通路在缺氧/吡那地尔后处理减轻大鼠心肌细胞缺氧/复氧损伤中的作用[J]. 中国病理生理杂志,2013, 29(9):1696-1699.
[10]汤 蕾,彭易安,胥甜甜, 等. PKCε信号通路介导槲皮素拮抗心肌细胞缺氧/复氧损伤[J]. 中国病理生理杂志,2013,29(9): 1567-1572.
[11]Coaxum SD, Griffin TM, Martin JL, et al. Influence of PKC-alpha overexpression on HSP70 and cardioprotection[J]. Am J Physiol Heart Circ Physiol, 2007, 292(5):H2220-H2226.
[12]Gao Q, Yang B, Ye ZG, et al. Opening the calcium-activated potassium channel participates in the cardioprotective effect of puerarin[J]. Eur J Pharmacol, 2007, 574( 2-3):179-184.
[13]Alvarez-Jaimes L, Feliciano-Rivera M, Centeno-González M, et al. Contributiom of the mitogen-activated protein kinase and protein kinase C cascades in spatial learning and memory mediated by the nucleus accumbens[J]. J Pharmcol Exp Ther, 2005, 314(3):1144-1157.
[14]Kumphune S, Chattipakorn S, Chattipakorn N. Role of p38 inhibition in cardiac ischemia/reperfusion injury[J]. Eur J Clin Pharmacol, 2012, 68(5):513-524.
Role of ROS/PKC/p38 MAPK pathway in protective effects of polysaccharide fromFructuscornion rat cardiomyocytes against hypoxia-reoxygenation injury
LAI Li-na, SONG Li-hua, ZHANG Xiao-jing, ZHANG Xiao-yi, LEI Jing-wen, LIU Fang, GUO Chun-hua, SONG Xiao-liang
(DepartmentofPharmacology,ChangzhiMedicalCollege,Changzhi046000,China.E-mail:songxiaoliang62@sina.com)
AIM: To investigate the effect of polysaccharide fromFructuscorni(PFC) on cardiomyocytes against hypoxia/reoxygenation (H/R) injury and its possible relationship with ROS/PKC/p38 MAPK pathway.METHODS: Primary cardiomyocytes were isolated from neonatal SD rats and randomly divided into normal group, H/R group, PFC (20 mg/L, 100 mg/L and 200 mg/L) preconditioning+H/R groups, chelerythrine+PFC (100 mg/L)+H/R group and SB203580+PFC (100 mg/L)+H/R group. The cell viability was measured by inverted microscopic observation. Apoptosis in the cardiomyocytes was detected by Hoechst 33258 staining and fluorescence microscopy. The levels of lactate dehydrogenase (LDH) and superoxide dismutase (SOD) in the cell culture supernatants, and the reactive oxygen species (ROS) in the cells were also measured by microplate reader. The protein levels of PKC, p-p38 MAPK and HSP70 in the cells were detected by Western blotting.RESULTS: Compared with normal group, the cell viability and beating frequency were decreased in H/R group. LDH and ROS contents, apoptotic rate and p-p38 MAPK level increased significantly (P<0.01). Compared with H/R group, PFC preconditioning increased beating frequency, SOD activity and the protein level of PKC and HSP70, and decreased ROS production, the protein level of p-p38 MAPK and cell apoptotic rate. However, the effect of PFC was inhibited by chelerythrine or SB203580.CONCLUSION: PFC may protect cardiomyocytes from hypoxia/reoxygenation injury. Its mechanism is possibly involved in the inhibition of ROS via increasing the activity of SOD and the activation of PKC, and suppression of excessive activation of p38 MAPK.
Fructuscorni; Polysaccharide; Hypoxia/reoxygenation; Cardiomyocytes; Reactive oxygen species
1000- 4718(2014)12- 2201- 05
2014- 08- 14
2014- 09- 11
山西省高校重点学科建设项目(No.20131007);山西省高等学校“131”领军人才工程项目(No.604)
R285.5
A
10.3969/j.issn.1000- 4718.2014.12.015
△通讯作者 Tel: 0355-3151036; E-mail: songxiaoliang62@sina.com

