相转移催化合成邻乙氧基苯酚技术研究
马永丽,章亚东
(郑州大学化工与能源学院,河南郑州 450001)
0 前言
邻乙氧基苯酚[1]是合成高档香料乙基香兰素的重要精细化工中间体。随着消费市场迅速增长,合成邻乙氧基苯酚具有很广阔的的市场前景[2-6]。
邻乙氧基苯酚的主要合成方法有4种[7-13]:①邻苯二酚法。分为溴乙烷法、硫酸二乙酯法,其中硫酸二乙酯法中硫酸二乙酯毒性大,不宜工业化生产;②邻氨基苯乙醚法。缺点是产率低,三废多。③邻硝基氯苯和乙醇法。在三苯基膦存在条件下合成邻乙氧基苯酚,缺点是产率低。④邻硝基苯酚法。以邻硝基苯酚和溴乙烷或氯乙烷为原料,经醚化、还原、重氮化、水解等合成邻乙氧基苯酚,缺点是合成路线长,工艺复杂,且污染严重。而以PEG-400为相转移催化剂,邻苯二酚与溴乙烷为主要原料合成邻乙氧基苯酚的工艺条件温和,易于操作。PEG及其单醚类高分子相转移催化剂受到人们的普遍重视,这是因为PEG类物质不仅具有较高的化学稳定性,毒性小,而且又有来源方便、价格低廉、使用简便等优点,有利于工业应用[14]。为此,本次研究选用PEG-400为催化剂绿色合成邻乙氧基苯酚[15-16]。
1 实验部分
1.1 试剂
溴乙烷,化学纯,国药集团化学试剂有限公司;邻苯二酚,化学纯,国药集团化学试剂有限公司;环己烷,分析纯,永大试剂;氢氧化钠,分析纯,天津市风船化学试剂科技有限公司;PEG-400化学纯,郑州德众化学试剂厂。
1.2 仪器
控温磁力搅拌器(SZCL-2),巩义市予华仪器有限责任公司;循环水式多用真空泵(SHB-Ⅲ),郑州长城科工贸有限公司;DZF真空干燥箱,北京市永光明医疗仪器厂;ZAR-1T阿贝折光仪,东南科创科技有限公司;GC-9800TFP气相色谱分析仪,上海色谱仪器有限公司;FT-IR傅立叶变换红外光谱仪,上海市实验仪器厂;AVII-400核磁共振仪,德国Bruker公司。
1.3 邻乙氧基苯酚
在装有磁子、温度计及直形冷凝管的三口瓶中加入一定量的水,通氮气几分钟,加入一定量的邻苯二酚在一定温度下搅拌溶解,加入一定量质量分数为10%的氢氧化钠溶液(自配),反应一段时间,再缓慢加入一定量的溴乙烷、环己烷、PEG-400,反应数小时,冷却至室温,酸化,使用一定量环己烷萃取,在分液漏斗中分出有机相,得含有产品的粗产物。使用GC检测[17],测定产品含量。主要反应方程式如下:

1.4 收率测定方法
1.4.1 计算公式
本文在计算反应收率时采用内标法计算,以邻苯二酚为关键组分,并以此计算邻乙氧基苯酚的收率Y。

注:Y,邻乙氧基苯酚的收率。
1.4.2 内标分析方法
为了准确定量分析反应产物邻乙氧基苯酚的收率,选取内标物与邻乙氧基苯酚的面积比为横坐标,内标物与邻乙氧基苯酚的质量比为纵坐标,通过气相色谱分析做出标准曲线。

图1 邻乙氧基苯酚的内标标准曲线
2 结果与讨论
2.1 影响因素的考察
邻乙氧基苯酚的相转移催化合成过程主要包括碱化以及亲核取代反应两步。反应过程可能出现一些副反应,如:碱化过程两个酚羟基均发生反应,在第二步中与溴乙烷在相转移催化剂作用下发生反应生成邻二乙氧基苯,溴乙烷碱性条件下的消除反应等。所以本文主要是针对参与反应的物质配比、反应时间、反应温度及催化剂用量做了考察。
2.2 正交实验以及结果分析
具体方案拟定如下:以邻苯二酚为基准,根据预实验及文献,固定如下因素:①加料方式;②搅拌速度;③溶剂环己烷用量;④溶剂水的用量。设计了五因素四水平L16(45)正交实验,考察了氢氧化钠与邻苯二酚的物质的量比(A)、溴乙烷与邻苯二酚的物质的量比(B)、反应时间(C)、反应温度(D)、催化剂PEG-400用量(E)对合成工艺的影响。L16(45)正交实验见表1和表2。

表1 L16(45)因素水平表
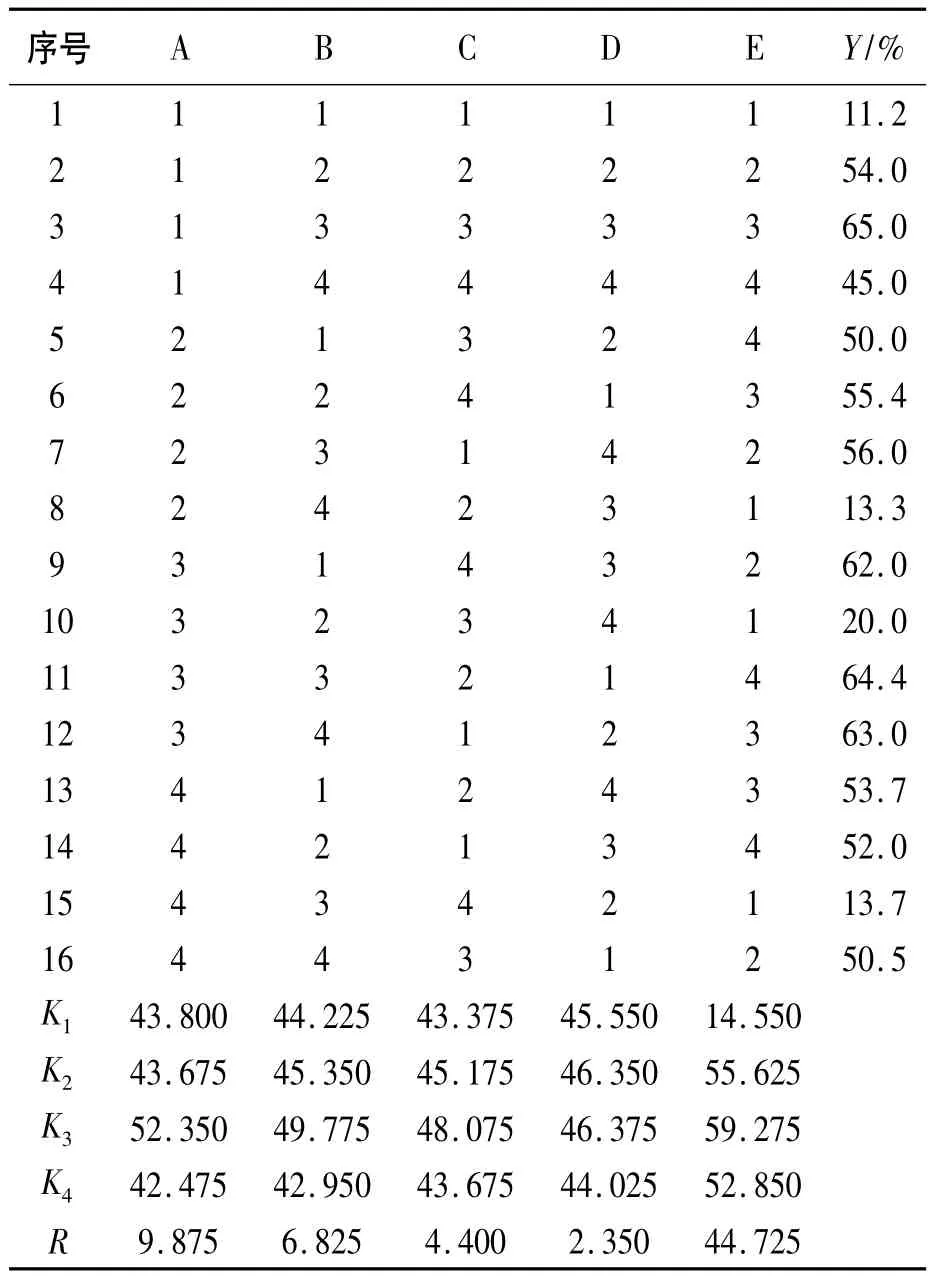
表2 正交实验结果
由表2可知:①收率随各因素的变化关系。随着氢氧化钠以及溴乙烷与邻苯二酚的物质的量比分别由0.8增至1.4过程中,邻乙氧基苯酚的收率均先增大后减小,在1.2处达到最大;随着反应时间的延长,邻乙氧基苯酚收率先增加后减小,在反应时间为6 h时达到最大;随着反应温度的提高,邻乙氧基苯酚收率先增加后减小,在反应温度为65℃ 时达到最大;随着催化剂用量的增加,邻乙氧基苯酚收率先增加后缓慢减小,在催化剂用量为2%(质量分数)时达到最大;②各因素指标的影响大小关系。极值R的大小表明了各个因素影响的主次关系,其主次顺序为:E>A>B>C>D;根据各个因素影响的主次关系,选定最优的方案A3B3C3D3E3。
2.3 单因素实验
为了更全面的考察各因素对该反应体系的影响,进一步进行工艺优化。进行了单因素实验,详细地考察了氢氧化钠与邻苯二酚的物质的量比、溴乙烷与邻苯二酚的物质的量比、催化剂用量、反应温度、反应时间等因素对该反应的影响,优化了的合成条件。实验过程中每考察完一个因素,在后续的实验中均取该因素的适宜值。
①氢氧化钠与邻苯二酚的物质的量比。控制溴乙烷与邻苯二酚的物质的量比为1.2∶1,反应温度为65℃,反应时间为6 h,催化剂用量为2%,考察氢氧化钠与邻苯二酚的物质的量比对反应收率的影响。

图2 氢氧化钠与邻苯二酚的物质的量比与邻乙氧基苯酚收率的关系
由图2知,在氢氧化钠与邻苯二酚物质的量比渐渐增大的过程中,邻乙氧基苯酚的收率现增加后减小,在n(NaOH)∶n(C6H6O2)=1.2∶1时最大,可能是因为在初始碱浓度增加时,邻苯二酚与氢氧化钠反应的量增大即烷氧负离子的量增加,增加了亲核反应的邻苯二酚量,当氢氧化钠量继续增加时,溴乙烷会发生消除反应,减小了参与主要反应的溴乙烷量,所以碱浓度的最适宜量为:n(NaOH)∶n(C6H6O2)=1.2 ∶1。
②溴乙烷与邻苯二酚的物质的量比。控制氢氧化钠与邻苯二酚与物质的量比为1.2∶1,反应温度为65℃,反应时间为6 h,催化剂用量为2%,考察溴乙烷与邻苯二酚的物质的量比对反应收率的影响。

图3 溴乙烷与邻苯二酚物质的量比与邻乙氧基苯酚收率的关系
由图3知,在溴乙烷与邻苯二酚的物质的量比渐渐增大的过程中,邻乙氧基苯酚的收率先增加后减小,在n(C2H5Br)∶n(C6H6O2)=1.2∶1时最大,由反应动力学知,当溴乙烷初始增加浓度时,反应向正反应方向进行,n(C2H5Br)∶n(C6H6O2)=1.2∶1时达到最大,当溴乙烷浓度再增加时,会促使邻二乙氧基苯醚的生成,邻乙氧基苯酚收率降低。所以最佳的 n(C2H5Br)∶n(C6H6O2)=1.2∶1。
③反应温度的影响。控制氢氧化钠与邻苯二酚与物质的量比为1.2∶1,溴乙烷与邻苯二酚的物质的量比为1.2∶1,反应时间为6 h,催化剂用量为2%,考察反应温度对反应收率的影响。
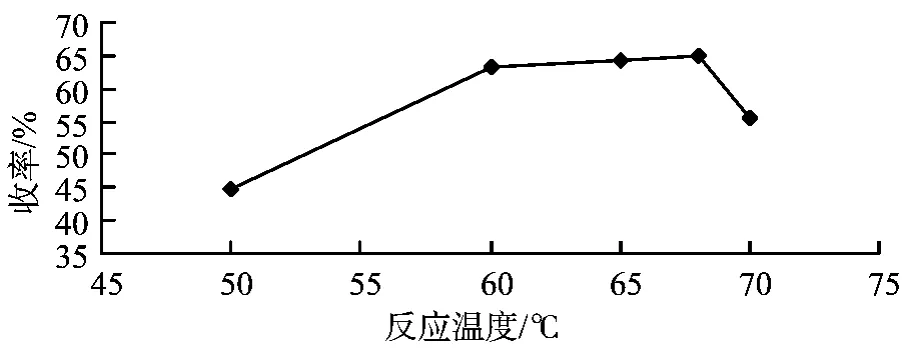
图4 反应温度与邻乙氧基苯酚收率的关系
随着反应温度的增加,邻乙氧基苯酚的收率先增加后减小,与正交试验相比,在65~70℃又增加几个温度的分布点,以更加准确确定最佳的反应温度。结果表明,在温度为68℃ 时达到最大,温度再增加时,会促使副反应的进行,如:溴乙烷的消除反应等。即最佳的反应温度为68℃。
④反应时间对反应收率的影响。控制氢氧化钠与邻苯二酚与物质的量比为1.2∶1,溴乙烷与邻苯二酚的物质的量比为1.2∶1,反应温度为68℃,催化剂用量为2%,考察反应时间对反应收率的影响。

图5 反应时间与邻乙氧基苯酚收率的关系
随着反应时间的增加,邻乙氧基苯酚的收率先增加后减小,在反应时间为6 h时达到最大,时间再增加时,会促使副反应的进行,如:生成的邻乙氧基苯酚与溴乙烷反应生成双醚。所以最佳的反应时间为6 h。
⑤催化剂用量对反应收率的影响。控制氢氧化钠与邻苯二酚与物质的量比为1.2∶1,溴乙烷与邻苯二酚的物质的量比为1.2∶1,反应温度为68℃,反应时间为6 h,考察催化剂用量对反应收率的影响。

图6 催化剂用量与邻乙氧基苯酚收率的关系
随着催化剂用量的增加,邻乙氧基苯酚的收率先增后减,在催化剂用量达到2.0%时,反应收率最大,催化剂用量再增加时,收率降低,这可能是因为在催化剂过量时,逆反应同样加速进行。即催化剂的最适宜条件为2.0%。
2.4 小结
最终确定最佳反应的工艺条件:
n(C6H6O2)∶n(NaOH)∶n(C2H5Br)=1∶1.2∶1.2,反应温度为68℃,反应时间为6 h,催化剂用量为2.0%,此条件下进行三次重复实验。

表3 重复实验结果
3 产品表征

图7 邻乙氧基苯酚红外图谱
由图7可知:3 536.22 cm-1,O—H 的伸缩振动值(理论值 3 633 cm-1)。2 982、2 932 cm-1,—C H2, — C H3的伸缩振动值(理论值2982、2 935 cm-1)。3 062.71、921.63 cm-1,苯环的C — H 键伸缩振动值(理论值3 064、926 cm-1)。1259.98 cm-1,C—O 的伸缩振动值(理论值1 259 cm-1)。1 501.67、743.8 cm-1,苯环的邻位取代值(理论值 1 502 cm-1,744 cm-1),和 Spectral Database for Organic Compounds SDBS标准谱图基本一致。
4 结论
以PEG-400为催化剂合成邻乙氧基苯酚,以邻乙氧基苯酚的收率为参考指标,确定合成邻乙氧基苯酚的最佳工艺条件为n(C6H6O2)∶n(NaOH)∶n(C2H5Br)=1∶1.2 ∶1.2,反应温度为68 ℃,反应时间为6 h,催化剂用量为2%;该反应条件下,邻乙氧基苯酚收率65%;此工艺条件简单,污染小,有关催化剂的回收研究正在进行中。
[1]徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1998.
[2]李雪梅,张文祥,朱小梅,等.Al-P-Ti-Si-O体系催化剂上乙醇和邻苯二酚的o-乙基化反应[J].高等学校化学学报,2002,23(8):1552-1555.
[3]张能芳,谭祝捷,梁桂芸.乙基香兰素的合成[J].河北化工,1990(2):13-14.
[4]刘万民,陈范才,叶一鸣,等.乙基香兰素合成方法研究方法进展[J].四川化工,2004(7):22-24.
[5]张莉琼,柴多里.邻乙氧基苯酚的合成研究[J].广东化工,2009,36:43-45.
[6]Hans-Rene B,Lucia L,Francesco M.High selectivity in the oxidation of mandelic acid derivatives and in omethylation of protocatechualdehyde:new processes for synthesis of vanillin,iso-vanillin,and heliotropin[J].Organic Process Research&Development,2000(4):534-543.
[7]Heinz K.Heterocyclic growth regulators:US,5104443[P].1992.
[8]Erika P.Methods and compositions:US,20100160451[P].2010.
[9]盛 光,吴广峰,黄金霞,等.邻乙氧基苯酚的合成与精制[J].化工科技,2007,15(5):41-44.
[10]程文峰.乙基愈疮木酚合成方法研究[J].精细化工,2011,42:8-10.
[11]薛 冰,简相杰.碳酸二乙酯与邻苯二酚乙基化反应合成邻乙氧基苯酚[J].石油化工,2008,37:296-299.
[12]吴 臣,李连贵,朱翠兰.邻乙氧基苯酚的合成[J].长春工业大学学报,2002,23(增):125-127.
[13]宋锡瑾,王常申 .合成苯甲醚的新工艺[J].精细化工,2000,17(1):42-44.
[14]章亚东,高晓蕾,蒋登高,等.聚乙二醇相转移催化合成对硝基苯甲醚工艺[J].郑州大学学报:工学版,2002,23(2):23-26.
[15]李英春,滕俊江.乙基香兰素的相转移催化合成[J].应用化工,2004,33:26-27.
[16]张珍明.相转移催化合成邻乙氧基苯酚的研究[J].淮海工学院学报,1999,7(4):43-45.
[17]王多余.邻羟基苯乙醚的气相色谱分析研究[J].安徽化工,2008,34:67-69.

