Claudin5、MMP-13在食管鳞癌中的表达及临床意义
李红伟 李多杰 江 浩 汪朝歌 崔 珍
(蚌埠医学院第一附属医院放疗科,安徽 233003)
食管癌是我国常见的消化道恶性肿瘤之一,在我国主要是以鳞癌为主。食管癌早期症状不明显,出现疼痛及梗阻症状已经是晚期,临床上该肿瘤易局部浸润及淋巴结转移。本实验通过检测食管鳞癌组织中claudin5及MMP-13的蛋白表达情况,旨在寻找与食管鳞癌发生、发展、浸润及转移相关的免疫标记物,为临床早期诊断及判定预后提供分子学依据。
材料和方法
1.一般材料
收集2007-2008年临床病理科食管鳞状细胞癌石蜡包埋组织90例,其中女性21例,男性69例;年龄在38-79岁之间,中位年龄59岁。其中高分化鳞癌24例,中分化鳞癌45例,低分化鳞癌21例;肿瘤局限在粘膜层至浅肌层的20例,浸润至深肌层到外膜层的70例;无淋巴结转移患者52例,有局部和远处淋巴结转移患者38例;同时挑选手术标本距肿瘤边缘5.0cm以上远端切缘组织28例做正常对照。
2.主要试剂
claudin5及 MMP-13一抗(兔抗人)均购自NeoMarkers公司。免疫组化试剂盒购自福州迈新生物有限公司。
3.实验方法
采用免疫组化Elivision方法对90例食管鳞癌组织及28例癌旁正常黏膜组织进行claudin5及MMP-13染色。抗体滴度分别为1∶100;1∶200,具体操作参见免疫组化试剂盒说明书,用PBS代替一抗做阴性对照,用皮肤和乳腺癌组织分别做阳性对照。
4.结果判定及统计学分析
claudin5及MMP-13的染色定位于细胞浆,胞浆内出现黄色及棕黄色颗粒为阳性细胞。结果观察采用双盲法,每张切片随机观察10个高倍视野,每个视野计数200个细胞,计算阳性细胞数及观察显色程度,阳性强度用半定量法,按阳性细胞所占得百分数评分:阳性细胞<10%为0分,10%-50%为1分,51%-75%为2分,>75%为3分。细胞不着色为0分,浅黄为1分,黄色为2分,棕褐色为3分。两者分数相乘0-2分为阴性(-),≥3分为阳性(+)。
5.统计学处理
采用spass 17.0软件进行统计学分析,计数资料采用卡方检验,两变量相关分析采用spearman等级相关检验,P<0.05具有统计学意义。
结 果
1.claudin5及 MMP-13蛋白在食管鳞癌及食管癌旁上皮组织中的表达
在食管鳞癌细胞中,claudin5及MMP-13蛋白均定位于细胞浆。claudin5蛋白在90例食管鳞癌组织及正常黏膜组织中的阳性表达率分别为85.56%(77/90)、25.00%(7/28)在食管鳞癌中的表达明显高于正常黏膜组织(P<0.05)。MMP-13蛋白在90例食管鳞癌组织及正常黏膜组织中的阳性表达率分别为82.22%(74/90)、21.43%(6/28),在食管鳞癌中的表达显著高于正常黏膜组织,差异具有统计学意义(P<0.05)(表1、图1-4)。
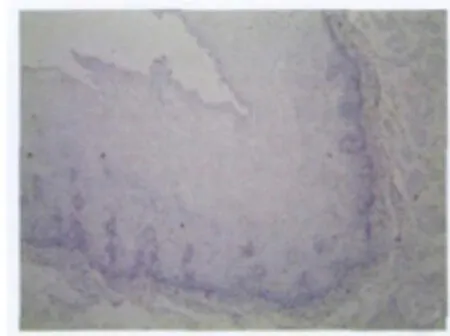
图1 Clandin5在食管粘膜组织中的阴性表达(Elivision法 ×400)Fig.1 Negative expression of clandin5in normal tissues(Elivision method×400)
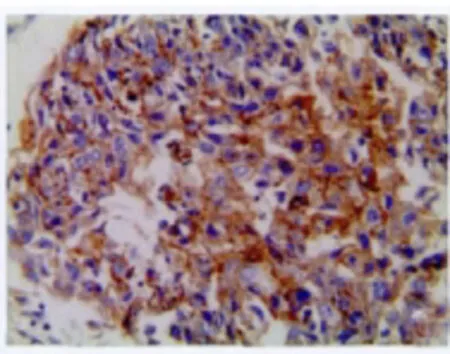
图2 Clandin5在食管鳞癌中的强阳性表达,(Elivision法 ×400)Fig.2 Strong positive expression of clandin 5in ESCC(Elivision method×400)

图3 MMP-13在食管正常粘膜组织中的弱阳性表达,(Elivision法 ×100)Fig.3 Weak positive expression of MMP-13in normal tissues(Elivision method×100)
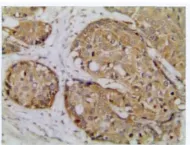
图4 MMP-13在食管鳞癌中的强阳性表达,(Elivision法×400)Fig.4 Strong positive expression of MMP-13in ESCC MMP-13(Elivision method×400)
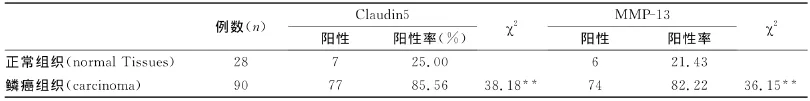
表1 Claudin5和MMP-13蛋白在正常组织及食管鳞癌中的表达Table1 Expression of Claudin5and MMP-13protein from normal tissue and ESCC
2.食管鳞癌中claudin5及 MMP-13蛋白的表达及临床病理参数之间的关系
在90例食管鳞癌中,MMP-13蛋白在无淋巴结转移的50例患者中有35例阳性表达,有淋巴结转移的40例患者中有39例阳性表达;临床分期为Ⅰ期患29例中有19例阳性表达,Ⅱ期患者40例中有37例阳性表达,Ⅲ+Ⅳ期患者21例中有18例阳性表达,MMP-13蛋白与食管鳞癌的淋巴结转移及临床分期密切相关,差异具有统计学意义(P<0.05),而与患者年龄、性别、浸润深度及分化程度无关。在90例食管鳞癌中,claudin5蛋白的表达程度与患者年龄、性别、浸润深度、分化程度、有无淋巴结转移及临床分期均无相关性(P>0.05)(表2)。
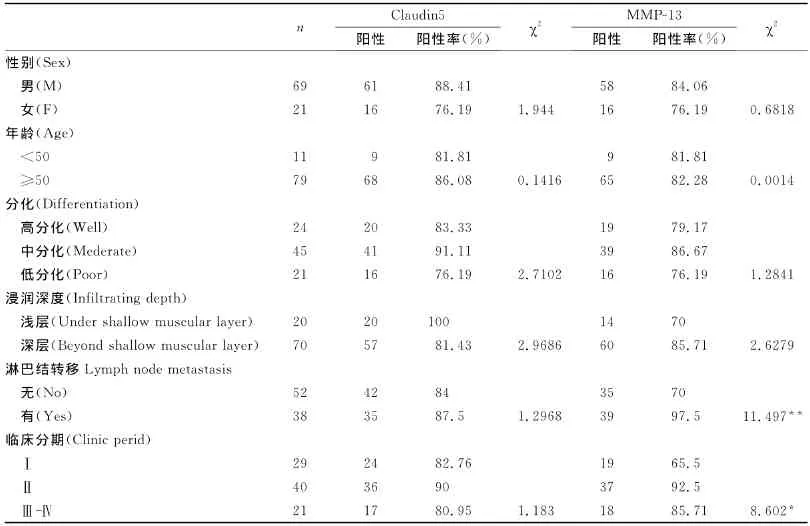
表2 食管癌中Claudin5和MMP-13蛋白的表达水平与临床病理参数之间的关系Table2 The relationship of Claudin5and MMP-13expression and clinicopathological manifestations in ESCC
3.claudin5及 MMP-13蛋白在食管鳞癌中表达的相关性分析
在90例食管鳞癌组织中,claudin5及MMP-13蛋白均阳性表达的71例,均阴性表达的10例,claudin5阳性而MMP-13阴性表达的6例,claudin5阴性而MMP-13阳性表达的3例。claudin5及MMP-13蛋白在食管鳞癌中的表达呈正相关(r=0.6356,P<0.05)(表3)。

表3 Claudin5和MMP-13蛋白在食管癌中表达的相互关系Table3 Correlation of Claudin5and MMP-13in ESCC
讨 论
肿瘤的浸润和转移是肿瘤预后较差的主要原因,食管癌早期症状不明显,易发生局部浸润及淋巴结转移。肿瘤的局部浸润和转移是多步骤、多基因共同改变的结果。细胞紧密连接的破坏和细胞外基质的降解是肿瘤浸润转移的必备条件。
claudin蛋白家族是分子量从17-27kDa的跨膜紧密连接蛋白,到目前为止已发现有24个成员[1]。它们构成了紧密连接的主要骨架,与连接黏附分子和Occludin构成了细胞间紧密连接的主要膜蛋白。Claudin蛋白对维持细胞极性,形成屏障,阻止液体、膜蛋白及小分子的侧向扩散及细胞顶部和基底部的完整性起到重要作用。同一种Claudin蛋白可以在不同的组织中表达,同一种组织也可以表达几种Claudin蛋白。不同的Claudin蛋白可能会形成不同结构的紧密连接。Claudin蛋白是通过形成多聚体并和周围细胞的Claudin蛋白相互作用构成了细胞间的连接骨架。人体正常的细胞紧密连接的构成是比较规律的,在肿瘤组织中claudin蛋白的表达异常或与其他蛋白连接异常,组织学上表现为分化差,细胞极性紊乱或消失。紧密连接的完整性破坏是导致肿瘤细胞浸润和转移的重要原因之一。claudin5是claudin蛋白家族的重要成员,最初研究发现claudin5在良性脉管肿瘤及血管肉瘤中高表达[2],但随着研究的深入发现claudin5在前列腺癌、肺癌、乳腺癌[3-5]等多种恶性肿瘤中均有表达。本研究发现,在正常食管黏膜组织中claudin5蛋白的阳性表达率为25.00%,而在食管鳞癌组织中的阳性表达率为85.56%,claudin5蛋白在食管鳞癌组织中表达明显增强,其蛋白表达可能与食管鳞癌的发生、发展有关,可能会成为食管鳞癌早期诊断的重要分子标记物。但claudin5蛋白的表达与临床各病理参数之间均无相关性。
MMP-13是基质金属蛋白酶家族(MMPS)的重要成员之一,在1994年首先从乳腺癌中被分离出来[6]。MMP-13属于胶原酶,以酶原的形式分泌到细胞外基质中,其主要功能是降解基底膜及细胞外基质,促进肿瘤细胞突破基底膜和细胞外基质构成的组织学屏障,促进肿瘤细胞侵袭及转移[7]。除此之外它还具有激活家族其他基质金属蛋白酶及促进肿瘤血管生成的作用。研究发现[8]MMP-13可激活MMP-2、9,同时 MMP-2、9也可以激活 MMP-13。MMP-13在多种恶性肿瘤中均有表达。Wang[9]等研究发现在甲状腺乳头状癌中MMP-13表达增强而周围正常甲状腺滤泡不表达,有局部淋巴结转移的病人MMP-13的表达率明显增加,且转移至淋巴结边缘的癌细胞 MMP-13的表达量明显增强。Yang[10]等在结直肠癌中研究发现 MMP-13在癌组织中高表达,且其表达率与肿瘤的分化程度、临床分期及淋巴结转移密切相关,此外MMP-13的表达与结直肠癌的生存时间有关。本研究实验发现在食管鳞癌组织中MMP-13的阳性表达率为82.22%,在食管黏膜组织中的阳性表达率为21.43%,在食管鳞癌中的表达明显高于正常黏膜组织,差异具有统计学意义。MMP-13可能在食管鳞癌发生、发展过程起重要作用。研究还发现有淋巴结转移的病人MMP-13的阳性表达高于没有淋巴结转移的病人,TNM分期Ⅲ+Ⅳ期患者MMP-13蛋白的表达明显高于Ⅰ和Ⅱ期患者,MMP-13的阳性表达与淋巴结转移及临床分期有关,差异具有统计学意义。因此MMP-13可能为判断食管癌预后提供重要的分子学依据。
本研究还发现随着clandin5蛋白的表达增强MMP-13蛋白的表达水平增加,两者存在正相关,差异具有统计学意义。可能因为clandin5蛋白的过表达激活了 MMP-13,使其功能增强。Agarwal等[11]研究MMP和Claudin在卵巢癌细胞中的表达与本研究结果类似,,他们发现Claudin3、4的表达促进肿瘤细胞的侵袭及运动,而这种表现可能是Claudin3、4增加了基质金属蛋白酶-2(MMP-2)的活性,具体机制有待于进一步研究。
[1]Tsukita S,Furuse M,Itoh M.Multifunctional strands in tight junctions.Nat Rev Mol Cell Biol,2001,2(4):285-293
[2]Hara H.Endoglin(CD105)and claudin-5expression in cutaneous angiosarcoma.Am J Dermatopathol,2012,34(7):779-782
[3]Coutinho-Camillo CM,Lourenco SV,da Fonseca FP,et al.Claudin expression is dysregulated in prostate adenocarcinomas but does not correlate with main clinicopathological parameters.Pathology,2011,43(2):143-148
[4]Merikallio H,Kaarteenaho R,PääkköP,et al.Zeb1and twist are more commonly expressed in metastatic than primary lung tumours and show inverse associations with claudins.Clin Pathol,2011,64(2):136-140
[5]Szasz AM,Tokes AM,Micsinai M,et al.Prognostic significance of claudin expression changes in breast cancer with regional lymph node metastasis.Clin Exp Metastasis,2011,28(1):55-63
[6]FreijeJMP,Diez2Itza I,BalbinM,et al.1Molecular cloningandexpres2sionofcollagenase23,anovel human matrixmetalloproteinase produced by breast carcinomas.Biol Chem,1994,269(24):16766-16773
[7]Kleiner DE,Stetler-Stevenson WG.Matrix metalloproteinases and metastasis.Cancer Chemother Pharmacol,1999,43(Suppl):42-51
[8]Leeman MF,Curran S,Murray GI1The structure,regulation, andfunctionof humanmatrixmetalloproteinase213.Critical Reviews inBiochemistryandMolecular Biology,2002,37(3):149-166
[9]Wang JR,Li XH,Gao XJ,et al.Expression of MMP-13 is associated with invasion of papillary thyroid carcinoma.Eup Rev Med Pharmacol Sci,2013,17(4):427-435
[10]Yang B,Gao J,Rao Z,et al.Clinicopathological significance and prognostic value of MMP-13expression in colorectal cancer.Scand J Clin Lab Invest,2012,72(6):501-505
[11]Agarwal R,D′Souza T,Morin PJ.Claudin-3andclaudin-4expression in ovarian epithelial cells enhances invasion an disassociated with increased Matrixmetalloproteinase-2activity.Cancer Res,2005,65:7378-7385

