DNA-PKcs在铂类耐药形成过程中的动态表达及临床因素的相关性分析
石丽君李梦迪李 力 王 琪
作者单位:530021 南宁 广西肿瘤防治研究所实验研究部;广西区域性高发肿瘤教育部重点实验室;△广西医科大学研究生学院
基础研究
DNA-PKcs在铂类耐药形成过程中的动态表达及临床因素的相关性分析
石丽君△李梦迪△李 力 王 琪
作者单位:530021 南宁 广西肿瘤防治研究所实验研究部;广西区域性高发肿瘤教育部重点实验室;△广西医科大学研究生学院
目的 动态检测裸鼠铂类耐药模型DNA依赖蛋白激酶催化亚单位(DNA-PKcs)在铂类耐药形成过程的变化,分析卵巢癌患者DNA-PKcs的表达水平与临床因素的相关性,为肿瘤患者的个体化治疗提供实验依据。方法 以实时荧光定量PCR技术检测DNA-PKcs mRNA的表达;Pearson相关分析卵巢癌患者DNA-PKcs的表达量与卵巢癌患者临床因素的相关性,Kaplan-Meier法分析临床因素及DNA-PKcs的表达对患者无疾病进展生存时间和总生存时间的影响;Cox回归模型分析卵巢癌预后相关因素对患者生存的影响。结果 裸鼠体内铂类耐药移植瘤DNA-PKcs的表达显著低于铂类敏感对照(P=0.003),铂类敏感细胞在获得性耐药形成过程中DNA-PKcs的表达逐渐下降,耐药细胞产生以后,DNAPKcs基因的表达始终在较低的水平。Pearson分析表明DNA-PKcs的表达与患者对铂类药物初始治疗的反应和铂类耐药的产生呈显著负相关(P=0.000)。Kaplan-Meier法分析显示,FIGO分期越早、无术后残余病灶、对铂类初次治疗有效、铂类治疗敏感、DNA-PKcs高表达的患者的生存时间显著延长(P<0.05)。Cox回归模型分析发现纳入影响卵巢癌患者总生存时间的危险因素为铂类初始治疗反应(P=0.047)和铂类耐药产生(P=0.047),铂类药物治疗完全有效和部分有效患者的DNA-PKcs表达量显著高于肿瘤无消退和肿瘤增长的两组患者(P=0.000),铂类敏感患者DNA-PKcs平均表达量显著高于铂类耐药患者(P=0.000)。结论 DNA-PKcs的表达下降与铂类耐药形成相关,可能作为判断卵巢癌铂类耐药产生的潜在标志分子。
卵巢肿瘤;耐药性,铂类;DNA依赖蛋白激酶催化亚单位
卵巢癌是死亡率居首位的女性生殖道恶性肿瘤。虽经过规范的肿瘤细胞减灭术和以铂类/紫杉醇为基础的化疗,但仍有70%的患者面临复发或疾病进展,晚期患者的5年生存率不足40%。肿瘤细胞对于化疗药物产生耐药性是影响患者预后的重要因素,临床上对铂类耐药进行预测,对于指导患者的个体化治疗和改善卵巢癌的预后具有重要意义。
DNA依赖蛋白激酶催化亚单位(DNA-PKcs)是DNA修复基因家族成员,研究表明,各种恶性肿瘤中普遍存在DNA-PKcs表达的变化,提示该酶可作为一种肿瘤标志物,其表达水平不但与肿瘤的发生、发展有关,还与某些肿瘤的病理类型、分期及侵袭性有关,并与肿瘤放化疗敏感性和预后有重要关系。本研究利用前期建立的裸鼠体内耐药模型,动态观察铂类耐药形成过程中DNA-PKcs动态表达的变化,并分析临床大样本量卵巢癌患者DNA-PKcs的表达水平与患者的临床分期、初次化疗敏感性和生存时间的关系,为患者的个体化治疗提供实验依据。
1 材料和方法
1.1 材料
1.1.1 病例标本来源 收集2009年9月至2013年4月在广西医科大学附属肿瘤医院行手术后辅助铂类为基础化疗的初治上皮性卵巢癌患者冰冻组织256例,详细记录患者相关的临床资料,其中铂类耐药89例,铂类敏感167例。患者的临床资料见表1。以8例年龄50~55岁的子宫肌瘤患者的正常卵巢组织为对照。
1.1.2 实验动物及细胞株 SKOV3-GFP为带有绿色荧光标记(green fluorescent protein,GFP)标记的SKOV3亲本细胞,SKOV3/DDPⅱ是本课题组前期在裸鼠体内由顺铂诱导的SKOV3-GFP耐药细胞株[1],耐药指数达2.42倍。裸鼠(SPF级,BalB/C系)由广西医科大学动物实验中心提供,均为4周龄左右的雌性裸鼠,体重为18~20 g。
1.1.3 主要试剂 顺铂为山东齐鲁制药有限公司生产,Trizol Reagent为美国Invitrogen公司产品,M-MLV Reverse Transcriptase由美国 Promega公司提供,SYBR Premix Ex TaqⅡ购自日本TAKARA公司,实时荧光定量PCR仪购自美国Bio-Rad公司。

表1 256例以铂类为基础化疗的上皮性卵巢癌患者的临床资料
1.2 方法
1.2.1 铂类耐药裸鼠模型的建立 动物模型的建立按本实验前期探索条件完成[1],SKOV3-GFP和SKOV3/DDPⅱ细胞接种于18~20 g裸鼠腹股沟皮下,成瘤后用游标卡尺测量皮下肿瘤的长(a)和宽(b),肿瘤体积(mm3)=0.52×a×b2,待肿瘤生长至400 mm3后,隔天腹腔内注射顺铂,剂量为4 mg/kg,分别在0次、2次、5次和8次注射顺铂后于次日取出瘤组织,-80℃保存。
1.2.2 QRT-PCR检测DNA-PKcs的表达 取裸鼠移植瘤和患者卵巢癌的冰冻组织,以Trizol法提取总RNA,逆转录为cDNA,以QRT-PCR技术检测DNA-PKcs的表达。DNA-PKcs上游引物为5′-TTTCCAGAGATTTCGGTTTGC-3′,下游引物为5′-AATTTCAACAGAGTAAGGTGCGAT-3′;退火温度54℃。以GAPDH基因为内参,采用2-△△Ct法计算实验组目的基因的表达相对于对照组表达量变化的倍数。
1.2.3 DNA-PKcs的表达与临床预后的相关性分析以Pearson相关分析卵巢癌组织DNA-PKcs的表达量与临床因素的关系,包括FIGO分期、病理分级、术后残余灶、铂类初始治疗反应、无疾病进展生存时间(progression free survival,PFS)、总生存时间(overall survival,OS)、无进展状态、铂类耐药产生、1年内复发和1年内死亡等。
根据铂类化疗结束后是否在6个月内复发,将卵巢癌患者分为铂类化疗敏感组和铂类耐药组,根据铂类化疗敏感组和铂类耐药组DNA-PKcs的平均表达量,将患者分为DNA-PKcs值≥耐药组均值和DNAPKcs值≤敏感组均值两组,以Kaplan-Meier法分析各临床因素及DNA-PKcs的表达对PFS和OS影响。Cox回归模型分析与PFS相关的临床因素。
1.3 统计学方法
采用SPSS 17.0统计学软件对数据进行统计处理。DNA-PKcs表达量差异的比较采用t检验。用Pearson相关分析DNA-PKcs的表达量与临床因素之间的关系。Kaplan-Meier法采用long-rank进行检验。Cox回归模型分析采用相对风险比(RHR)及其95%置信区间(95%CI)对多种指标的共同效应进行评价,若RHR>1时,则不利因素占主导地位,若RHR<1时,则保护因素占主导地位;若RHR=1或以95%CI包含1时,则两者处于平衡状态。P<0.05作为显著性检验水准。
2 结果
2.1 顺铂给药后DNA-PKcs在裸鼠肿瘤组织中的动态表达
顺铂作用于裸鼠体内移植瘤后,随时间推移虽然肿瘤重量增加,但是SKOV3/DDPⅱ形成的瘤块重量始终明显大于SKOV3-GFP移植瘤,而且第8次注射顺铂以后,SKOV3-GFP移植瘤变小(图1A)。QRT-PCR法检测结果显示,给药初期SKOV3/DDPⅱ瘤块的DNA-PKcs表达量显著低于SKOV3-GFP(P=0.003),DNA-PKcs的表达量随顺铂给药次数的增加而下降(图1B)。但以DNA-PKcs的表达为纵坐标,瘤块重量为横坐标绘制散点图,结果表明SKOV3-GFP瘤块中DNA-PKcs相对表达量的降低速度明显大于SKOV3/ DDPⅱ,SKOV3-GFP的斜率是SKOV3/DDPⅱ的7.9倍(图1C)。

图1 连续予顺铂注射处理后,裸鼠移植瘤重量和DNA-PKcs基因表达量的变化
2.2 卵巢癌组织DNA-PKcs的表达量与临床预后因素的相关性分析
以Pearson相关分析卵巢癌组织DNA-PKcs的表达量与临床预后因素的相关性。结果表明DNA-PKcs的表达与患者对铂类药物初始治疗的反应和铂类耐药的产生呈显著负相关(P=0.000)。见表2。根据卵巢癌患者对铂类药物初始治疗的反应情况,分为完全有效、部分有效、肿瘤无消退和肿瘤增长4个组,结果显示铂类药物治疗完全有效和部分有效组DNA-PKcs的表达量显著高于肿瘤无消退和肿瘤进展两组患者(图2A,P=0.000);根据铂类化疗结束后6个月内是否复发,将卵巢癌患者分为铂类敏感组和铂类耐药组,结果可见铂类敏感组的DNA-PKcs平均表达量为3.678±0.225,显著高铂类于耐药组的2.327±1.048(P=0.000,图2B)。

图2 铂类药物治疗不同效果的卵巢癌患者DNA-PKcs的表达比较

表2 卵巢癌组织DNA-PKcs的表达量与临床预后因素的Pearson相关分析
用Kaplan-Meier法分析卵巢癌患者FIGO分期、病理分级、术后残余灶、铂类初始治疗反应和铂类耐药产生对OS和PFS的影响,结果显示,FIGO分期越早、术后无残余病灶、对铂类初次治疗有效,并且铂类治疗敏感的患者其OS和PFS显著增长(P<0.05),反之生存时间则较短(图3、图4)。根据铂类化疗敏感组和铂类耐药组的DNA-PKcs平均表达量,将患者分为DNA-PKcs值≥3.678和DNA-PKcs值≤2.327两组,以Kaplan-Meier法分析DNA-PKcs的表达对OS和PFS的影响,结果DNA-PKcs值≥3.678组的OS和PFS均显著长于DNA-PKcs值≤2.327组(图5)。Cox回归模型分析上述Kaplan-Meier法分析具有差异显著性的因素,发现纳入影响卵巢癌患者的OS和PFS的危险因素为铂类初始治疗反应(P=0.047)和铂类耐药产生(P=0.047),DNA-PKcs虽然没有被纳入,但差异接近显著性水平(P=0.067)。
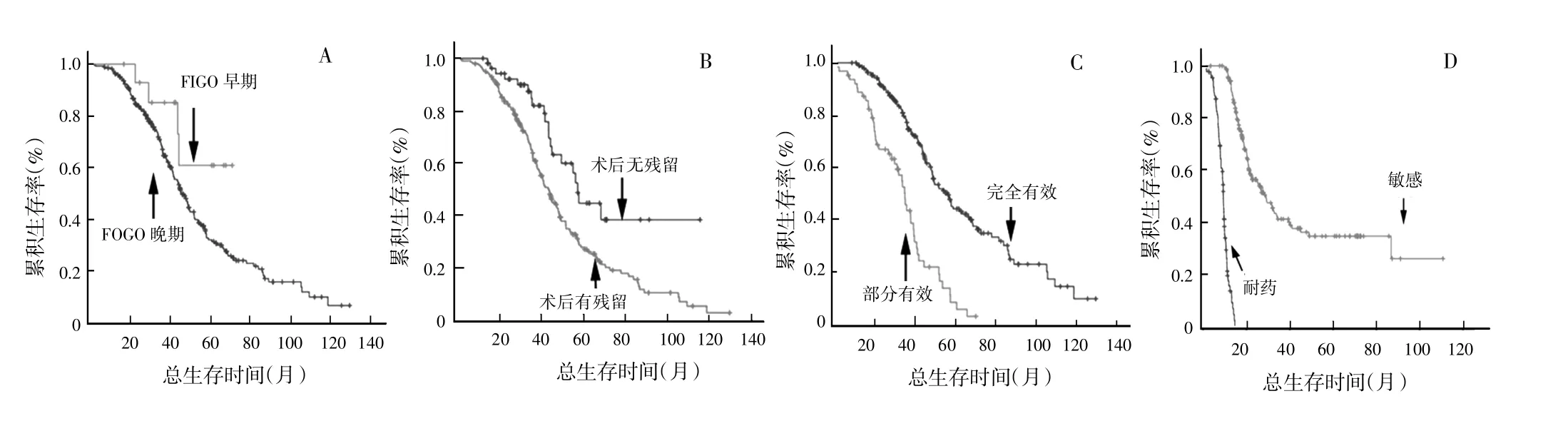
图3 Kaplan-Meier法分析卵巢癌患者FIGO分期、术后残余病灶、铂类初始治疗反应和铂类耐药产生对总生存时间的影响

图4 Kaplan-Meier法分析卵巢癌患者FIGO分期、术后残余病灶、铂类初始治疗反应和铂类耐药产生对无疾病进展生存时间的影响
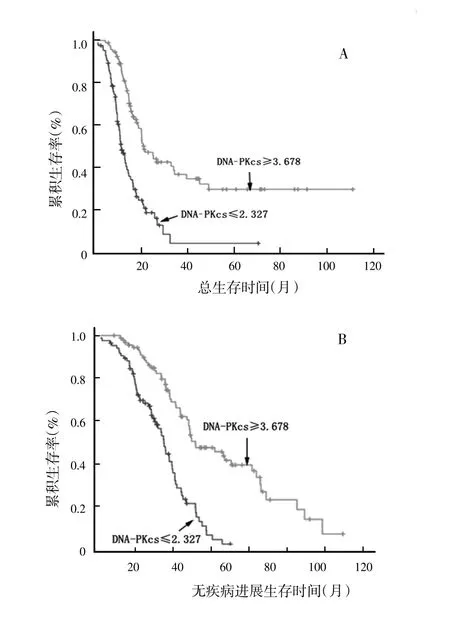
图5 DNA-PKcs的表达对卵巢癌患者总生存时间和无疾病进展生存时间的影响
3 讨论
目前,以顺铂及其类似物卡铂和奥沙利铂为基础结合紫杉醇类的联合化疗是上皮性卵巢癌重要的治疗手段[2]。尽管顺铂初期治疗卵巢癌表现出极度敏感[3]。但仍有15%~20%患者出现原发耐药,80%的患者虽然对铂类敏感,但可能在反复的化疗过程中产生获得性耐药[4]。临床上普遍存在的肿瘤化疗多药耐药(multi drug resistance,MDR)现象是导致化疗失败、制约提高生存率的中心环节。因此,寻找可用于判断卵巢癌MDR产生及其预后的分子,以采取更有效的化疗方案,是提高患者预后及生存质量的关键。
本研究利用前期建立的卵巢癌铂类诱导耐药动物模型,筛选与耐药产生相关的差异基因[5],发现铂类敏感的卵巢癌细胞高表达DNA-PKcs mRNA,当接受顺铂刺激后,DNA-PKcs mRNA的表达水平明显下降,在获得性耐药形成过程中随顺铂给药次数的增加而下降,当耐药细胞产生以后,DNA-PKcs的基因表达始终在较低的水平。说明DNA-PKcs的表达下降可能与铂类耐药形成相关。
对256例卵巢癌患者DNA-PKcs基因表达分析表明,DNA-PKcs的表达水平与患者对铂类治疗初次反应和铂类耐药产生呈负相关,而Cox回归模型分析显示对铂类治疗初次反应和铂类耐药产生是影响患者生存时间的危险因素。Kaplan-Meier单因素生存分析表明,DNA-PKcs高表达组患者的生存时间明显长于低表达组患者的生存时间。上述结果提示DNA-PKcs可能作为判断卵巢癌铂类耐药产生的标志分子。
既往研究表明DNA-PKcs是DNA-PK复合物由一个催化亚基DNA-PKcs和两个调节亚基Ku80和Ku70组成,是DNA损伤修复的关键酶。DNA-PKcs在肿瘤组织、肿瘤旁组织及正常组织中均有表达,表明DNA-PKcs对DNA的损伤修复能力是一种基本的细胞功能,肿瘤的发生都与DNA-PKcs的损伤有关,DNA-PKcs受损后其活性下降,使人体极易发生各种恶性肿瘤[6]。铂类药物治疗肿瘤的关键是诱导肿瘤细胞凋亡和抑制肿瘤细胞的增殖、生长。有研究发现,DNA-PKcs高表达的患者相对于低表达的患者对铂类治疗高度敏感[7]。Stronach等[8]研究表明Akt信号通路参与卵巢癌细胞凋亡,DNA-PKcs可以维持Akt信号通路。DNA-PKcs除了参与DNA修复,还参与DNA复制调控、免疫球蛋白和T细胞表面抗原受体V(D)J重组,作为转录因子调节某些基因的表达,细胞程序性死亡的信号转导、维持端粒结构等多种生化反应[9]。因此,我们推测DNA-PKcs的低表达可能使卵巢癌细胞不能得到有效的DNA修复以及不能启动细胞凋亡程序,从而促进卵巢癌细胞增殖和复发。
通过基因芯片、分子杂交等分析发现DNA-PKcs在细胞恶性转化的早期阶段受到抑制,恶性转化后其表达又上升,表明肿瘤细胞同样可利用DNA-PKcs的修复功能进行生长、增殖[10]。前列腺癌细胞核染色DNA-PKcs阳性与放疗抵抗密切相关[11]。DNA-PKcs和PARP-1可能通过激活细胞自噬诱导乳腺癌化疗耐药[12]。DNA-PKcs的表达对肿瘤耐药可能具有双向作用,具体取决于DNA-PKcs修复与细胞凋亡相关途径还是耐药相关途径如细胞自噬等。DNA-PKcs可否用于判断卵巢癌铂类耐药的产生,还需要进一步分析DNA-PKcs调控的下游机制,有关方面有待深入研究。
[1] 石丽君,于红静,李 力,等.顺铂作用于耐顺铂卵巢上皮癌细胞后其细胞生物学特性的改变[J].广西医科大学学报,2013,30(1):33-37.
[2] Metzger-Filho O,Moulin C,D′Hondt V.First-line systemic treatment of ovarian cancer:a critical review of available evidence and expectations for future directions[J].Curr Opin Oncol,2010,22(5):513-520.
[3] Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[4] Gotlieb WH,Bruchim I,Ben-Baruch G,et al.Doxorubicin levels in the serum and ascites of patients with ovarian cancer[J].Eur J Surg Oncol,2007,33(2):213-215.
[5] 石丽君,于红静,李 力,等.铂类耐药相关基因在卵巢癌顺铂耐药形成过程中表达量的动态变化[J].中国癌症防治杂志,2013,5(3):210-215.
[6] Cook AJ,Oganesian L,Harumal P,et al.Reduced switching in SCID B cells is associated with altered somatic mutation of recombined S regions[J].J Immunol,2003,171(12):6556-6564.
[7]Noguchi T,Shibata T,Fumoto S,et al.DNA-PKcs expressionin esophageal cancer as a predictor for chemoradiation therapeutic sensitivity[J].Ann Surg Oncol,2002,9(10):1017-1022.
[8] Stronach EA,Maginn EN,Gabra H,et al.DNA-PK mediates AKT mctivation and apoptosis inhibition in clinically acquired platinum resistance[J].Neoplasia,2011,13(11):1069-1080.
[9] Stracker TH,Williams BR,Deriano L,et al.Artemis and nonhomologousend end joining-independent influence of DNA-dependent prorein kinase catalytic subunit on chromosome stability[J].Mol Cell Biol,2009,29(2):503-514.
[10]Sakata K,Someya M,Matsumoto Y,et al.Ability to repair DNA doublestrand breaks related to cancer susceptibility and radiosensitivity[J]. Radiat Med,2007,25(9):433-438.
[11]Bouchaert P,Guerif S,Fromont G,et al.DNA-PKcs expression predicts response to radiotherapy in prostate cancer[J].Int J Radiat Oncol Biol Phys,2012,84(5):1179-1185.
[12] Ciszewski WM,Tavecchio M,Dastych J,et al.DNA-PKcs inhibition by NU7441 sensitizes breast cancer cells to ionizing radiation and doxorubicin[J].Breast Cancer Res Treat,2014,143(1):47-55.
[2014-04-09收稿][2014-05-22修回][编辑 阮萃才]
Dynamics of DNA-dependent protein kinase expression in the development of platinum resistance and correlation with clinical factors
SHI Li-jun△,LI Meng-di△,LI Li,WANG Qi(Department of Research,Guangxi Cancer Institute;Key Laboratory of High Incidence of Tumors of the Guangxi Region,Ministry of Education;△Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
WANG Qi.E-mail:qi_catcat@163.com
Objective To analyze the dynamics of DNA-dependent protein kinase(DNA-PKcs)expression in a nude mouse model of platinum resistance,as well as correlate the dynamics with clinicopathological characteristics of ovarian cancer patients,in order to develop an experimental system for individualized chemotherapy.Methods DNA-PKcs expression was measured by real-time fluorescence quantitative reverse transcription-polymerase chain reaction(qRT-PCR).Pearson correlation was used to examine associations between expression levels and clinical factors in patients with ovarian cancer.Kaplan-Meier analysis was used to examine association of DNA-PKcs expression with progression-free survival(PFS)and overall survival(OS).Factors affecting patient survival were identified by Cox regression.Result DNA-PKcs expression was significantly lower in transplanted platinum-resistant tumors than in platinum-sensitive controls(P=0.003).Development of drug resistance was associated with a gradual decrease in DNA-PKcs expression,which remained low during the production of platinum-resistant tumor cells.Pearson analysis showed that DNA-PKcs expression correlated negatively with both patient response to platinum treatment and the level of platinum resistance(P=0.000).Kaplan-Meier analysis showed significantly higher survival rates for patients at an early FIGO stage,patients without residual disease,patients who responded to primary platinum treatment,patients sensitive to platinum,and patients with high DNA-PKcs expression(P<0.05).Cox regression identified two factors affecting survival time in patients with ovarian cancer:response to primary platinum treatment(P=0.047)and platinum resistance(P=0.047).DNA-PKcs expression was significantly higher in patients who responded completely to platinum treatment than in patients with stable or progressive tumors(P=0.000).Similarly,DNA-PKcs expression was significantly higher in platinumsensitive patients than in platinum-resistant ones(P=0.000).Conclusion The development of platinum resistance may be associated with a reduction in DNA-PKcs expression,suggesting that DNA-PKcs may be a useful biomarker of platinum resistance in ovarian cancer.
Ovarian neoplasm;Drug resistance,Platinum;DNA-dependent protein kinase
R735.7
A
1674-5671(2014)02-07
10.3969/j.issn.1674-5671.2014.02.04
国家自然科学基金资助项目(81360341);广西科学研究与技术开发计划资助项目(桂科攻1140003A-34);广西自然科学基金资助项目(2011GXNSFA018190);广西医学科学实验中心开放基金资助项目(KFJJ2010-3)【通信作者】王 琪。E-mail:qi_catcat@163.com

