虎源传染性鼻气管炎病毒gD 基因重组真核表达载体的构建
张晓明,胡 俊,彭仕明,陈 武*
(1.华南农业大学兽医学院,广东 广州 510642;2.广州动物园,广东 广州 510070)
疱疹病毒Ⅰ型属于疱疹病毒科中的α疱疹病毒,可引起猫科动物的急性、高度接触性的上呼吸道感染,发病率可高达100%[1]。虽然成年猫科动物感染后大多痊愈,病死率很低,但幼仔感染后症状严重,病死率可达50%,甚至终生带毒排毒,并可垂直传播,危害很大[2]。该病毒于1958年由Crande R A和Maurer首次从美国患呼吸道疾病的仔猫体中分离鉴定[3],随后在欧亚等一些国家也相继报道检测到病毒。2012年4月和6月江苏省苏州动物园和广东某养殖场以流鼻涕、咳嗽和支气管充血和出血为主要症状的东北虎和华南虎出现流鼻涕、咳嗽和支气管充血和出血等临床症状,肖建雄等[4]研究证明了患虎感染的病毒是传染性鼻气管炎病毒,该病毒与猫疱疹病毒Ⅰ型基本一致。
预防虎源传染性鼻气管炎主要以注射疫苗免疫为主,但注射猫传染性鼻气管炎疫苗的保护作用甚微,国外动物园也报导类似情况[5]。因此,应研制针对虎源传染性鼻气管炎的疫苗来预防虎源传染性鼻气管炎,其中研制DNA基因工程疫苗是现时比较快速与良好的方法。猫疱疹病毒Ⅰ型基因组编码多种蛋白质,其中gD糖蛋白具有高度的保守性和抗原性,gD蛋白能与细胞表面分子发生特异性结合,诱导机体产生细胞免疫和体液免疫,是病毒感染特异性宿主的主要作用蛋白[6]。本研究对疱疹病毒Ⅰ型的gD基因进行了扩增、克隆及构建真核表达载体,为进一步研究虎疱疹病毒Ⅰ型的基因工程DNA疫苗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 细胞、菌株和载体 293T细胞、pcDNA 3.1(+)表达载体和DH5α大肠埃希菌均由华南农业大学兽医学院保存。
1.1.2 试剂 限制性内切酶Hin dⅢ和XhoⅠ、DreamTaqTMPCR Master Mix、转染试剂TurboFect Transfection Reagent,Fermentas公司产品;病毒DNA提取试剂盒(viral DNA extraction kit)DNA胶回收试剂盒(Gel Extraction Kit)和质粒小提试剂盒(Endo-Free Plasmid Mini KitⅡ),Omega公司产品;RNA抽提试剂(Trizol),Invitrogen公司产品;pMD18-T Simple克隆载体、T4DNA 连接酶、cDNA反转录试剂盒(PrimeScriptⅡI 1st Strand cDNA Synthesis Kit),TaKaRa公司产品;抗his标签一抗 ,Bioworld公司产品。
1.2 方法
1.2.1 引物合成 根据GenBank已公布的猫传染性鼻气管炎病毒基因组序列(序列号FJ478159)设计了扩增gD基因的一对引物,为方便检测,在上游引物引入his标签,同时在上、下游引物分别引入了HindⅢ和XhoⅠ酶切位点(下划线部分)。引物序列如下:上游:5′-CCCAAGCTTCACCATCATCACCATCATATGAGAC-3′;下游:5′-CCGCTCG AGTTATAGATGGTGAG -3′;引 物 由Invitrogen公司合成。
1.2.2 病毒DNA的提取及目的基因克隆 病毒液从-80℃超低温冰箱取出解冻后,使用Viral DNA extraction kit试剂盒进行DNA抽提,然后采用PCR扩增gD基因。PCR扩增体系为:在50μL PCR反应体系中加入PCR mix 25μL,上游引物2μL,下游引物2μL,DNA 2μL,ddH2O 19μL。扩增程序为:94℃5min;94℃30s,53℃30s,72℃2min,35个循环;最后72℃10min。PCR产物经10g/L琼脂糖凝胶电泳分析。
1.2.3 目的片段的胶回收及其克隆载体构建PCR扩增产物经琼脂糖凝胶电泳分离,使用DNA胶回收试剂盒进行目的基因片段胶回收纯化,与PMD18T-simple克隆载体连接后转化DH5α大肠埃希菌,将转化好的DH5α大肠埃希菌涂在含有氨苄青霉素的LB平板培养过夜,然后挑取阳性菌落经PCR鉴定后,提取重组质粒,命名为18T-gD。
1.2.4 重组真核表达载体的构建及其鉴定 抽提重组克隆载体18T-gD,用HindⅢ和XhoⅠ限制性内切酶对18T-gD和表达载体pcDNA 3.1(+)进行双酶切,电泳后进行胶回收纯化,用T4DNA连接酶将其定连接目的基因和表达载体,然后进行转化,挑菌和提取质粒,得到重组真核表达质粒pcDNA-gD。利用Hin dⅢ和XhoⅠ对pcDNA-gD重组质粒进行双酶切和经10g/L浓度琼脂糖凝胶电泳分析鉴定筛选出阳性重组质粒pcDNA-gD并送英潍捷基生物技术公司测序鉴定。
1.2.5 重组真核表达载体转染293T细胞 培养293T细胞,当细胞覆盖率达到70%~90%时,参考转染试剂TurboFect Transfection Reagent说明用TurboFect Transfection Reagent转 染 pcDNA-gD重组质粒,并设立空载体转染的对照组。将转染细胞置于体积分数为5%的CO2培养箱中37℃培养48h。
1.2.6 重组真核表达质粒在293T细胞中的转录和表达检测 使用Trizol法抽提转染48h的293T细胞mRNA,以此为模板进行RT-PCR反应,检测目的基因是否转录。同时收集转染48h的293T细胞,加入100μL的1×SDS上样缓冲液,充分混合后,100℃水浴5min,然后进行Western blot检测。先将进行SDS-PAGE,将PAGE胶上蛋白电转移到硝酸纤维素膜上,用含有50g/L脱脂奶粉的TBST溶液4℃条件封闭过夜,TBST冲洗3次后,与鼠抗HIS标签单克隆抗体在室温环境下作用1h,TBST洗涤3次,然后加入HRP标记羊抗鼠IgG二抗,室温轻摇孵育2h,TBST洗涤3次,最终经过DAB显色。
2 结果
2.1 虎源传染性鼻气管炎病毒gD基因PCR扩增结果
以提取的虎源传染性鼻气管炎病毒DNA为模板,经过PCR扩增后,得到的是约1143bp目的基因片段,与预期大小一致(图1)。
2.2 18T-gD的构建和鉴定结果
重组克隆载体18T-gD经过HindⅢ和XhoⅠ限制性内切酶双酶切电泳鉴定后,得到18T-2692bp的PMD-18Tsimple载体片段和1143bp的目的片段两条DNA片段(图2)。
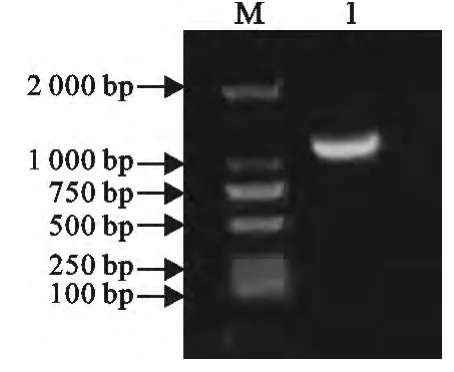
图1 FHV-1gD基因PCR扩增结果Fig.1 PCR amplifications of gD gene of FHV-1
2.3 18T-gD的构建和鉴定结果
重组克隆载体18T-gD经过HindⅢ和XhoⅠ限制性内切酶双酶切电泳鉴定后,得到18T-2692bp的PMD-18Tsimple载体片段和1143bp的目的片段两条DNA片段(图2)。
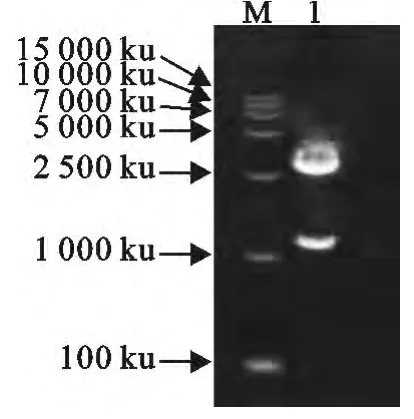
图2 重组克隆载体双酶切鉴定Fig.2 Identification of recombinant plasmid 18T-gD by enzymatic digestion
2.4 重组真核表达载体pcDNA-gD的构建和鉴定结果
重组克隆载体pcDNA-gD经过HindⅢ和XhoⅠ双酶切后,得到5428bp的载体片段和1143bp的目的片段(图3)。
2.5 重组真核表达载体在293T细胞中的转录和表达检测
使用Trizol法分别抽取转染pcDNA-gD和空载体48h的293T细胞的RNA后进行RT-PCR,转染pcDNA-gD的得到1143bp的片段,而转染空载体对照的没有出现任何DNA片段。表明重组质粒在293T细胞中得以成功转染和转录(图4)。对转染pcDNA-gD和空载体的293T细胞裂解物进行SDSPAGE后将蛋白转印至硝酸纤维素膜。使用抗His标签单克隆抗体作为一抗进行Western blot检测,结果显示表达的蛋白可被抗His标签单克隆抗体识别,条带大小约42.29ku,与预期大小一致(图5)。
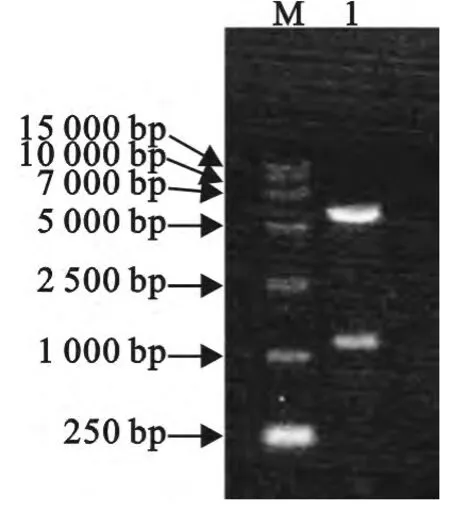
图3 pcDNA-gD载体的双酶切鉴定Fig.3 Identification of recombinant plasmid pcDNA-gD by enzymatic digestion
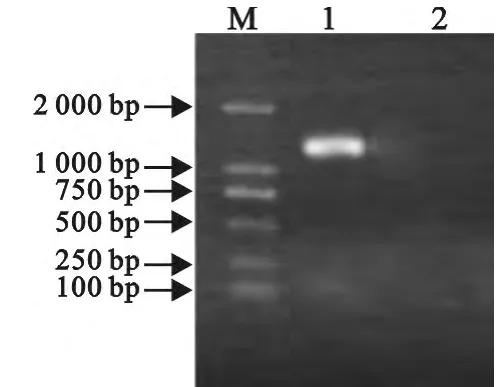
图4 转染293T细胞gD基因RT-PCR结果Fig.4 RT-PCR amplification of gD gene from 293Tcells after transfection
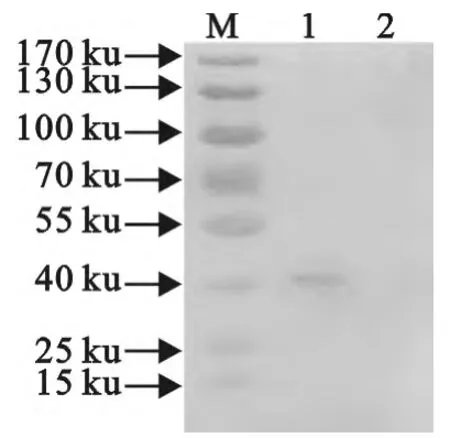
图5 293T细胞表达的gD蛋白的Western blot检测结果Fig.5 Western blot detection of gD protein expression in 293Tcells
3 讨论
传染性鼻气管炎是猫科动物常见的传染性病毒性疾病,该病目前并没有特异性治疗方法,主要以注射疫苗预防为主,针对猫已经有商品化的疫苗,但这些针对猫的商品化疫苗据虎饲养相关人员反馈,对虎效果不明显。因此,快速研制出适合虎使用的传染性鼻气管炎疫苗是非常有必要的。本研究以虎源传染性鼻气管炎病毒为模板,通过PCR扩增其gD基因片段,将其构建到pcDNA3.1(+)表达载体上,经RT-PCR和Western blot检测证实gD基因实现正常转录和表达。
基因疫苗的研制成功与否,与选取的外源基因的免疫源性强弱有着密切关系。虎源疱疹病毒Ⅰ型是具有囊膜的双股DNA病毒,与猫疱疹病毒Ⅰ型在基因上高度相似,病毒囊膜糖蛋白对于病毒侵入宿主细胞并产生病理变化具有极其重要的作用,其作用分别有侵入、吸附和细胞间扩散等[7]。在研制基因疫苗时,通过选取拥有良好免疫原性的糖蛋白能够让疫苗激发机体免疫反应,保护机体预防传染病。猫疱疹病毒1型基因组编码多种蛋白质,已报道了17种病毒特异性蛋白和3种具有免疫原性的糖蛋白[8]。猫疱疹病毒Ⅰ型中的gB、gC、gD、gE、gG、gH和gL这7种糖蛋白已得到鉴定,病毒在识别、侵入、感染、在细胞间传播和感染释放过程中这些糖蛋白都发挥着重要作用。gD蛋白具有血凝特性,能产生血凝与血凝抑制作用。Ken M等[9]发现表达猫疱疹病毒Ⅰ型gD蛋白的昆虫细胞可吸附猫的细胞,但不吸附牛、猪和犬的细胞,而且这种吸附可以被相对应的单克隆抗体抑制,此外,猫疱疹病毒Ⅰ型gD蛋白和犬疱疹病毒gD蛋白只能凝集各自宿主的红细胞,由此推测,这表明gD蛋白在病毒感染的宿主细胞选择上具有特异性,或者这也正说明为何虎在使用猫的商品化疫苗不能预防传染性鼻气管炎。gD糖蛋白也被认为是病毒粒子表面和病毒感染细胞所必需的主要蛋白,抗此糖蛋白的单克隆抗体在病毒吸附后中和病毒,并显示出较高的中和效价,表明gD蛋白可能参与病毒进入细胞,并为病毒复制的必需蛋白。Limcumpao J P等[10]用鼠和牛的免疫试验显示,gD能够引起比gB、gC更强而持久的细胞免疫并用亲和层析的方法从猫疱疹病毒Ⅰ型中纯化出gD蛋白,用该蛋白免疫小鼠,可使小鼠体内产生病毒中和抗体;Spatz Stephen J等[11]利用重组的FHV-1gD蛋白基因的疫苗病毒免疫家兔,也能产生高滴度的病毒中和抗体。综上gD蛋白在免疫上的优势,在研制针对虎源传染性鼻气管炎的疫苗上,应选择gD蛋白作为主要特异性抗原。
除抗原外,同时在选择DNA疫苗的表达载体研制上,必需考虑到其高效性与安全性:① 要制备大量的外源基因,也就是质粒载体必须是能在大肠埃希菌中高拷贝的扩增;② 外源基因导入细胞不被降解;③ 外源基因在动物细胞内能够高效表达,但不复制,其表达抗原蛋白的能力越强,诱导宿主产生的免疫应答也越强。同时表达载体必须不含有向宿主细胞基因组内整合的序列以保证其使用安全性[12-16]。基于以上的要求考虑,本研究选取了真核表达载体pcDNA3.1(+)作为表达载体,它的启动子是真核细胞中具有较大活性的人巨细胞病毒(CMV)直接早期区,CMV强启动子对大多数DNA疫苗具有很强的调节功能,当表达的抗原基因位于CMV强启动子后就能够持续大量得到表达[17],试验中pcDNA3.1(+)不仅在DH5α大肠埃希菌中高效拷贝扩增,并且在转染293T细胞后能够高效大量的表达出目的蛋白,这些都足以证明pcDNA3.1(+)作为DNA疫苗的优势。此外,pcDNA3.1(+)载体还含有Amp基因,Amp基因内部的CpG基元(非甲基化脱氧核苷酸片段),能够增强机体的免疫应答[18]。
试验中通过构建真核表达载体pcDNA-gD成功在真核细胞中表达出虎源疱疹病毒Ⅰ型gD蛋白,为下一步进行小鼠DNA疫苗免疫试验研究奠定了基础。
[1]Hussein Islam T M,Field Hugh J.Development of a quantitative real-time TaqMan PCR assay for testing the susceptibility of feline herpesvirus-1to antiviral compounds [J].J Virol Meth,2008,152:85-90.
[2]Ruch-Gallie Rebecca A,Veir Julia K,Hawley Jennifer R,et al.Results of molecular diagnostic assays targeting feline herpesvirus-1and feline calicivirus in adult cats administered modified live vaccines[J].J Feline Med Surg,2011,13(8):541-545.
[3]Brice R.Feline herpesvirus infection[J].Bulletin De L Academie Veterinaire De France,2011,164(4):327-330.
[4]肖建雄,单 芬,黄嘉欣,等.东北虎和华南虎源传染性鼻气管炎病毒的PCR检测和序列分析[J].野生动物,2013,34(3):146-151.
[5]Witte Carmel L,Nadine L,Rideout Bruce A,et al.Development of a case definition for clinical feline herpesvirus infection in cheetahs(Acinonyx jubatus)housed in zoos[J].J Zoo Wildl Med,2013,44(3):634-644.
[6]Wilkes Rebecca P,Kania Stephen A.Use of interfering RNAs targeted against feline herpesvirus 1glycoprotein D for inhibition of feline herpesvirus 1infection of feline kidney cells[J].Am J Vet Res,2009,70(8):1018-1025.
[7]张 硕,李纯玲,汪葆玥,等,猫疱疹病毒Ⅰ型的分离与鉴定[J].实验动物科学,2010,27(2):21-24.
[8]Gaskell R,Dawson S,Radford A,et al.Feline herpesvirus[J].Vet Res,2007,38(2):337-354.
[9]Maeda K,Horimoto T,Mikami T.Properties and functions of feline herpesvirus type 1glycoproteins[J].J Vet Med Sci,1998,60(8):881-888.
[10]Limcumpao J A,Horimoto T,Xuan X N,et al.Homologous and heterologous antibody responses of mice immunized with purified feline herpesvirus type 1and canine herpesvirus glycoproteins.[J].J Vet Med Sci,1991,53(3):503-505.
[11]Spatz Stephen J,Rota Paul A,Maes Roger K,et al.Identification of the feline herpesvirus type 1(FHV-1)genes encoding glycoproteins G D,I and E:Expression of FHV-1glycoprotein D in vaccinia and raccoon poxviruses[J].J Gene Virol,1994,75(6):1235-1244.
[12]连艳鲜,郑宝亮.融合表达猪源C3d与猪流感病毒HA DNA疫苗的构建[J].动物医学进展,2011,32(6):91-95.
[13]李 斌,苏乾莲,赵 武,等.三个猪戊型肝炎病毒ORF2基因连续片段核酸疫苗的构建[J].中国兽医科学,2013,40(10):1059-1066.
[14]邱春红,陈开廷,王永堂,等.核酸疫苗的安全性及其优化策略研究[J].生命科学,2013,25(9):858-864.
[15]陈轶霞,刘俊林,王明明,等.羊痘病毒多表位核酸疫苗的构建及表达[J].中国兽医学报,2013,33(8):1196-1200.
[16]Cui Z.DNA vaccine[J].Adv Gene,2005,54:257-289.
[17]Wolff J A,Budker V.The mechanism of naked DNA uptake and expression[J].Adv Gene,2005,54:3-20
[18]和晶亮.DNA疫苗的相关研究进展[J].动物医学进展,2007,28(S):44-47.

