骨形成蛋白-4 对小鼠诱导性多能干细胞牙向分化能力的影响*
刘 丽 王红雷 陈增力 金 岩
组织工程化牙齿的研究打破了以往口腔科治疗牙齿疾病的框架,以生物技术取代传统的修复技术,将经典发育学实验方法与基因研究技术相结合,在体内外构建有功能的生物活性牙齿。因此获取具有成牙潜能且来源丰富的种子细胞;探讨不同细胞分化的微环境成为当前牙齿组织工程研究的几个主要问题。诱导性多能干细胞(induced pluripotent stem, iPS)的出现为人类带来了新的希望,在干细胞领域和再生医学领域中具有重要的意义[1]。iPS 的研究一方面解决了利用胚胎进行干细胞研究的道德争议,另一方面也使得干细胞研究的来源更不受限[2]。
骨形成蛋白(BMP, bone morphogenetic protein)属于分泌型信号分子TGF-β 超家族成员,在中胚层诱导以及器官形成中起重要作用[3]。已经证实,骨形成蛋白-4(BMP4)在牙齿发育的起始起着决定性的关键作用[4]。本实验通过体外模拟BMP4 生长因子微环境,研究BMP4 对iPS 细胞向牙源性细胞迁移的方向及潜能的影响,为iPS 牙向分化微环境的构建提供新的思路,也为进一步模拟体内成牙微环境定向诱导iPS 牙向分化提供实验依据。
1. 材料与方法
1.1 材料 小鼠iPS-C5 细胞株购买于中国科学院广州生物医药与健康研究院;高糖DMEM(Gibco 公司,美国);灭活胎牛血清(Gibco 公司,美国);非必须氨基酸(Gibco 公司,美国);丙醇酸钠(Gibco 公司,美国);2-巯基乙醇(Gibco 公司,美国);白血病抑制因子(LIF,Gibco 公司,美国);抗小鼠结合转录因子-4(OCT4,Santa Cruz Biotechnology 公司,美国);干细胞表面标志性抗原-4(SSEA4,Santa Cruz Biotechnology 公司,美国)一抗;抗小鼠成釉蛋白(AMBN,Santa Cruz Biotechnology 公司,美国);釉原蛋白(AMGN,Santa Cruz Biotechnology 公司,美国);细胞角蛋白-14(CK14,Bioworld Technology 公司,美国);牙本质基质蛋白-1(DMP-1,Santa Cruz Biotechnology 公司,美国);牙本质涎磷蛋白(DSP,Santa Cruz Biotechnology 公司,美国)一抗;Hoechst 33342(Sigma 公司,美国);RNA抽提试剂盒及逆转录试剂盒(Fermentas 公司,美国);Taq DNA 聚合酶、dNTPs 和引物(上海生物工程公司,中国);PDVF 膜;电泳缓冲液;转移缓冲液;Tween 20;封闭液;解离液;化学发光Western Blot 试剂盒(Pierce 公司,美国);BMP4(R&D System, 美国);noggin(Peprotech,美国)。
1.2 iPS 细胞培养 iPS 细胞接种、传代前准备小鼠胚胎成纤维细胞(MEF)作为滋养层,丝裂霉素C 进行灭活处理。iPS 细胞培养在预先铺有滋养层细胞和0.1% 明胶的细胞培养皿中。37℃、5%CO2、饱和湿度培养箱中培养,每天换液1 次,每2-3d 传代1 次[5]。
1.3 EB 培养及诱导分化 将消化下来的iPS细胞吹打至单个细胞,用无LIF 的iPS 培养液作为EB 培养液悬浮培养2d,收集培养2d 的EB,进行实验分组。A 组:对照组,EB 培养液培养细胞。B 组:成釉细胞无血清条件培养液(ASF-CM)培养EB 14d。C 组:ASF-CM 中加入50ng/ ml BMP4(ASF-BMP4)。D 组:ASF-CM 中加入250 ng/ ml Noggin(ASF-Noggin)培养EB 14d。四组细胞在铺有0.1%明胶的培养皿中贴壁生长。显微镜下观察细胞形态变化。
1.4 免疫荧光 去除细胞培养液,PBS 清洗,4%多聚甲醛固定15min,0.25%Triton X-100 孵育15min,4%山羊血清封闭30min 后,分别加入AMBN 抗体(1∶100)、AMGN 抗体(1∶100)、CK14 抗 体(1 ∶100)、DMP-1(1 ∶100)、DSP(1∶100),4℃过夜。PBS 清洗3 次,加入Rhodamine 标记的荧光二抗(1∶200)。 PBS 清洗3 次,DAPI 复染3min,置于荧光显微镜下观察、拍照。
1.5 Western Blot 检测 在细胞培养7d 和14d 时利用细胞裂解液试剂盒提取各诱导组和对照组总蛋白,检测蛋白浓度。制备SDS 电泳液,以恒压80V(浓缩胶)/ 130V(分离胶)进行蛋白上样。转膜、洗膜、封闭缓冲液封闭PVDF 膜。稀释一抗(AMBN、AMGN、DMP-1、DSP 一抗稀释比例1∶500,β-actin 稀释比例:1∶1000),4℃过夜。次日,TBST 缓冲液洗膜3 次,按1∶1000 比例稀释二抗,孵育2h。加入电化学发光底物发光显色试剂盒显色,蛋白凝胶成像系统照相观察。
1.6 RT-PCR 检测 Trizol 裂解并提取iPS细胞总RNA。测定RNA 浓度,分别反转录为cDNA。逆转录所得cDNA 利用Syber Green 荧光定量PCR 检测试剂盒进行荧光定量PCR 检测,目的基因及管家基因在不同的反应管中进行扩增,反应体系均为201ul,引物序列见表1。反应条件:95℃变性20min,95℃30s,60℃1min,40 个循环。T7500 型实时荧光定量PCR 仪监测记录数据,结果根据标准曲线由软件自动计算后得出。验证该方法的重复性和扩增效率。本实验进行三次重复。

表1 RT-PCR引物序列
1.7 统计学分析 SPSS13.0 统计软件进行相关数据分析。两组间比较采用独立样本t检验;P<0.05 认为差异有显著性。
2. 结果
2.1 诱导后细胞形态学变化 EB 与ASFBMP4 共培养2d 后,EB 开始不规则,EB 的外周开始有细胞爬出,呈现以EB 为中心,向四周放射状生长。随着诱导时间的延长,细胞增殖较快,14d 后类似上皮样细胞和成纤维样细胞铺满瓶底。EB 与ASF-Noggin 共培养14d 后,分化的细胞呈不规则的长梭样,没有观察到鹅卵石样上皮细胞和成纤维样细胞形成(图1)。
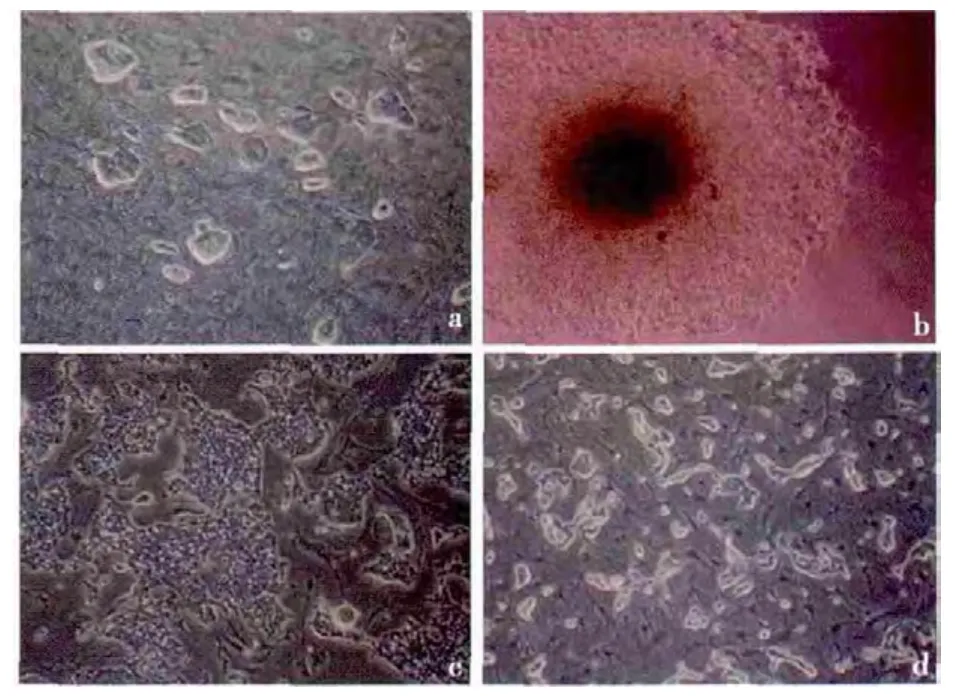
图1 iPS 细胞的形态学变化
2.2 诱导后细胞蛋白水平表达 EB 与ASFBMP4 共培养14d 后,分化的细胞形态学上观察类似于上皮样细胞以及成纤维样细胞。为了进一步证明分化的细胞的形态学变化,我们使用了细胞免疫染色和Western Blot 方法从蛋白水平检测细胞的表型。细胞免疫染色结果显示:EB 与ASF-BMP4共培养14d 后,分化的细胞不仅阳性表达成釉细胞特异性标记物AMBN、AMGN 以及上皮标记物CK14,而且成牙本质细胞的标记物DMP-1、DSP表达也阳性;ASF-CM 组主要表达AMBN、AMGN、CK14(图2)。Western Blot 结果显示:在培养7 天时,ASF-CM 组AMBN、AMGN、DMP-1、DSP 表达均不明显,与对照组接近。在培养14 天时,ASF-BMP4 组阳性表达AMBN、AMGN、DMP-1、DSP,并且表达明显高于ASF-CM 组,ASF-Noggin 组各基因表达均低于ASF-CM 组(图3)。
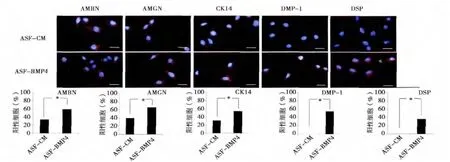
图2 诱导14d 后,分化的iPS 细胞的免疫荧光染色结果

图3 不同条件培养液ASF-CM/ ASF-BMP4/ASF-Noggin 诱导iPS 细胞,在培养7d 和14d Western blot 检测AMBN、AMGN、DSP、DMP-1 的表达。
2.3 诱导后细胞基因水平表达 EB 与ASFCM/ ASF-BMP4/ ASF-Noggin 共培养,PR-PCR检测牙齿相关的一些重要基因的表达,未经过诱导的iPS 细胞作为对照组。RT-PCR 结果显示:随着诱导时间的延长,ASF-BMP4 诱导的iPS 细胞AMBN、DMP-1、DSPP 基因的表达显著增高;在7 天和14 天相应的时间点这些基因的表达ASF-BMP4 显著 高 于 ASF-CM 组, ASF-Noggin 组 与ASF-CM 组相比,这些基因的表达明显降低,均有统计学意义;诱导14 天后,ASF-CM 组、ASFBMP4 组分化的细胞AMBN、DMP-1、DSPP 基因表达与对照组相比均有显著差异,ASF-Noggin组AMBN、DMP-1、DSPP 基因表达与对照组相比均无显著差异(图4)。

图4 不同诱导环境ASF-CM/ ASF-BMP4/ ASF-Noggin 诱导iPS 后,在培养7d 和14d RT-PCR检测AMBN、DMP-1、DSPP 的表达(*P<0.05,**P<0.01)。
3. 讨论
器官发育从始至终分化主要依赖于上皮与其周围间充质一系列信号分子之间的相互作用、相互诱导。牙齿的发育亦是如此。这些信号分子包括生长因子和转录因子。生长因子是由细胞分泌的一类可以调节细胞功能的生物活性多肽,通常以自分泌或旁分泌的方式作用于组织细胞,其作用机制是:生长因子与细胞表面的特异性受体结合,激活胞浆内蛋白激酶、使其发生磷酸化,作用与细胞核内的目的基因,引起细胞的应答反应。生长因子不仅能够促进细胞的增殖、迁移、分化,有些因子还起到抑制的作用。目前已经发现许多生长因子参与牙齿发育过程中上皮-间充质之间的信号调控,主要包括成纤维细胞生长因子(FGF)、骨形成蛋白(BMP)、转化生长因-β(TGF-β)以及Wnts 家族等[6]。
BMPs 是口腔上皮中最早表达的信号分子之一,在上皮-间充质的相互诱导中起关键的调节作用[7]。在胚胎的11.5d,牙上皮中的生长因子(BMP4、FGF8、Shh 等)旁分泌到下方的间充质中,激活间充质中转录因子的表达(Msx1、Msx2、Pax9、Dlx1、Dlx2 等)[8]。在胚胎的14.5d,BMP4信号主要在牙间充质中表达,调控着牙间充质细胞的聚集和分化,而作为反馈信号,BMP4 又作用于牙上皮细胞,促进牙上皮细胞形成成釉器[9]。近期国外研究表明BMP2 能促进牙髓干细胞分化为成牙本质细胞[10-11],在此分化过程中BMP2 促进了Smad1/ 5 的磷酸化和核转运[12]。还有研究表明BMP4 能影响胎鼠成骨作用和成牙本质细胞分化[13]。本实验研究表明BMP4 能促进iPS 细胞向成釉细胞谱系和成牙本质细胞谱系分化, BMP4 在iPS 牙向分化过程中发挥重要的调控作用。但是BMP4 的分子调控机制尚不清楚,将是我们今后研究的重点。
Noggin 是BMPs 的特异性拮抗剂,能以较高的粘合力与BMPs 结合,从而阻止它们与其受体结合。Noggin 和BMPs 高效结合后会形成一个较大的戒指样结构,这种结构可使Noggin 有效的将BMPs 上的受体结合位点遮蔽,从而抑制BMPs 与其受体结合,进而阻止Smad 依赖性和非Smad依赖性信号通路的传导,拮抗BMPs 的功能,从而阻断BMP 受体信号通路[14]。本研究结果表明Noggin 对iPS 细胞的牙向分化起抑制作用。Western Blot 和RT-PCR 结果显示iPS 细胞经ASF-BMP4 培养后AMBN、DPM-1、DSPP 表达显著增高,经过ASF-Noggin 培养后AMBN、DMP-1、DSPP 表达明显降低,有统计学意义。外源性的BMP4 放大了ASF-CM 中内源性BMP4的作用,激活了BMP4 信号传导通路,进而促进iPS 细胞向牙源性细胞谱系分化,而Noggin 通过阻断BMP 信号通路,抑制iPS 细胞的分化。
综上所述,我们前期研究探讨了小鼠iPS 细胞作为组织工程牙齿再生研究的种子细胞的可行性。本实验在前期研究的基础上深入探讨BMP4 对iPS细胞牙向分化的影响和作用,优化了iPS 牙向分化的诱导条件,为组织工程牙齿再生研究提供理论和实验依据,而且对机体其它器官的发育与再生提供有益参考。
[1] Takahashi K,Tanabe M,Ohnuki M,et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell,2007,131(5): 861-872
[2] Liu SP,Fu RH,Huang YC. Induced pluripotent stem (iPS)cell research overview[J]. Cell Transplant,2011,20(1):15-9
[3] Miyazono K,Kamiya Y,Morikawa M. Bone morphogenetic protein receptors and signal transduction [J]. J Biochem,2010,147(1):35-51
[4] Lin D,Huang Y,He F,et a1. Expression survey of genes critical for tooth development in the human embryonic tooth germ[J]. Dev Dyn,2007,236(51):1307-1312
[5] 刘 丽,李亚静,赵文峰.小鼠诱导性多能干细胞向牙源性细胞分化的实验研究[J]. 中华老年口腔医学杂志,2014,12(1):48-52
[6] Bei M. Molecular genetics of tooth development[J]. Curr Opin Genet Dev,2009,19(5): 504-510
[7] Vainio S,Karavanova I,Jowet A,et al. Identification of BMP-4 as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development [J]. Cell,1993,75(1): 45-58
[8] Mackenzie A,Leeming GL,Jowett AK,et al. The homeobox gene Hox 7.1 has specific regional and temporal expression patterns during early murine craniofacial embryogenesis,especially tooth development in vivo and in vitro[J].Development,1991,111(2):269-285
[9] Yen AH,Yelick PC. Dental tissue regeneration a mini-review [J]. Gerontology,2011,57(1): 85-94
[10] Iohara K,Nakashima M,Ito M,et al. Dentin regeneration by dental pulp stem cell therapy with recombinant human bone morphogenetic protein 2[J]. J Dent Res,2004,83(8):590-595
[11] Saito T,Ogawa M,Hata Y,et al. Acceleration effect of human recombinant bone morphogenetic protein-2 on differentiation of human pulp cells into odontoblasts[J]. J Endod,2004,30(4):205-208
[12] Qin W,Yang F,Deng R,et al. Smad 1/ 5 is involved in bone morphogenetic protein-2-induced odontoblastic differentiation in human dental pulp cells[J]. J Endod,2012,38(1):66-71
[13] Koussoulakou DS,Margaritis LH,Koussoulakou SL. Antagonists of retinoic acid and BMP4 affect fetal mouse osteogenesis and odontoblast differentiation [J]. Pathophysiology,2011,18(2):103-109
[14] Groppe J,Greenwald J,Wiater E,et al. Structural basis of BMP signalling inhibition by the cystine knot protein Noggin[J].Nature,2002,420(6916):636-642

