不同晶体结构钽酸钠的制备及光催化性能的研究
孔新刚, 郭章林, 黄剑锋, 李嘉胤, 介燕妮, 孙有权
(1.陕西科技大学 材料科学与工程学院, 陕西 西安 710021; 2 安徽德力日用玻璃股份有限公司, 安徽 凤阳 233121)
0 引言
Kudo等[2-4]报道了一系列的钽酸盐、碱金属钽酸盐和碱土金属钽酸盐光催化剂,这些催化剂未经复合改性,其光催化分解水的活性也远比TiO2的高.随后,有关钽酸盐光催化剂的制备和改性方面的研究日益受到重视.目前报道的主要有钙钛矿结构钽酸盐[2]、烧绿石晶型钽酸盐[3]、层状钽酸盐[5]以及柱状结构钽酸盐[6]等.而最常见的钽酸盐的合成方法是传统的高温固相反应[7]和水热法[8].相比于高温固相反应,水热法温度低,工艺简单,且合成的样品纯度较高,尺寸可控,缺陷较少.因此,水热法是合成钽酸盐的一种较为理想的方法[8].
本文描述了以Na8Ta6O19为前驱体,前驱体在不同碱浓度下进行水热反应,得到了烧绿石型Na2Ta2O6,钙钛矿型的NaTaO3及Na2Ta2O6/NaTaO3复合相.研究了不同水热条件碱浓度、溶剂类型、pH对钽酸钠晶体结构和形貌的影响,并对其光催化降解性能进行了表征.
1 实验部分
1.1 前驱体的制备
本实验以Ta2O5和NaOH为原料制备前驱体Na8Ta6O19.将5 g(5.7 mmol)Ta2O5与8.6 g(0.11 mol)NaOH在坩埚中混合均匀,放入高温箱式炉中在400 ℃下保温5 h,室温下自然冷却,得到的产物为白色粉末固体.将产物加入到160 mL水中,加热至90 ℃,保温2 h并不断搅拌直至晶体全部溶解,溶液为无色透明状.然后趁热抽滤,去掉不溶滤渣,然后将滤液放入冰箱中析晶,24 h后取出,溶液中析出亮晶晶的固体.然后经抽滤、洗涤、烘干,收集得到前驱体Na8Ta6O19.
1.2 钽酸钠的制备
1.2.1 碱性条件下水热合成
称取8份前驱体Na8Ta6O19粉末,每份0.4 g,分别溶于NaOH浓度为0、0.05、0.10、0.20、0.50、1.00、2.00、4.00 mol/L的35 mL水中.将所得到的混合溶液转移到容积为100 mL的聚四氟乙烯内衬的不锈钢密封高压釜中,在均相反应器中150 ℃下搅拌水热反应12 h.反应完成后,在室温下自然冷却,高压釜内上层为无色液体,内壁和底部为白色粉末.将产物过滤,离子水反复洗涤,在干燥箱中干燥,收集得到样品.
1.2.2 碱性条件下溶剂热合成
如(1.2.1)中所述,称取8份前驱体Na8Ta6O19粉末,每份0.4 g,分别溶于NaOH浓度为0、0.05、0.10、0.20、0.50、1.00、2.00、4.00 mol/L的35 mL液体中,此时的液体为水和乙醇体积比为1∶1的混合液.将所得到的混合溶液转移到容积为100 mL的聚四氟乙烯内衬的不锈钢密封高压釜中,在均相反应器中150 ℃下搅拌水热反应12 h.反应完成后,在室温下自然冷却,高压釜内上层为无色液体,内壁和底部为白色粉末.将产物过滤,离子水反复洗涤、干燥、收集得到样品.
CMV感染是艾滋病患者最常见的疱疹病毒感染,可分为CMV血症和器官受累的CMV病。CMV可侵犯患者多个器官系统,包括眼睛、肺、消化系统、中枢神经系统等,其中CMV视网膜脉络膜炎是艾滋病患者最常见的CMV感染。
1.2.3 酸性条件下溶剂热合成
称取两份0.35 g Na8Ta6O19粉末,分别溶解于V水∶V乙醇=2∶1和1∶1、总体积为35 mL的混合液中,再分别加入0.174 g NaCl,即NaCl浓度为0.1 mol/L,再用盐酸调pH值均至5.6.将混合溶液转移到容积为100 mL的聚四氟乙烯内衬的不锈钢密封高压釜中,在均相反应器中230 ℃下搅拌水热反应12 h.反应完成后,在室温下自然冷却,高压釜内上层为无色液体,内壁和底部为白色粉末.将产物过滤,离子水反复洗涤、干燥、收集得到样品.
1.3 样品的表征
利用日本理学D/max-2200型X射线粉末衍射仪分析样品的物相组成,Cu Kα1为辐射源(λ=0.154 nm).运用日立S4800场发射扫描电子显微镜观察样品形貌.样品的紫外可见漫反射光谱 (UV-Vis DRS) 在American PerkinElmer Corporation Lambda-950型光谱仪上测试.样品的光催化性能测试在西安比朗系列光催化设备上进行,以500 W汞灯为紫外光光源,亚甲基蓝为目标污染物.将50 mg的催化剂加入到50 mL、10 mgL-1的亚甲基蓝溶液中,先经暗反应40 min,使催化剂在体系中达到吸附平衡,再用汞灯进行照射.光照条件下每10 min取样一次,每次取6 mL液体,离心,取上层清液,在Unico UV-2600分光光度计上测量其吸光度.
2 结果与讨论
2.1 碱性条件下水热合成
图1是前驱体Na8Ta6O19的XRD图谱,其衍射峰位置和强度与相关文献[9-11]报道一致,说明合成的前驱体为 Na8Ta6O19.本实验中,Ta2O5与NaOH反应而形成TaO67-八面体结构单元,它们以共点的形式形成网络结构,同时Na+进入空隙而形成Na8Ta6O19.
Ta2O5+OH-→Ta6O198-+H2O
(1)
Ta6O198-+OH-→TaO67-+H2O
(2)
TaO67-+H2O+Na+→Na2Ta2O6(NaTaO3)
(3)
已有文献[12]报道,与Na8Ta6O19结构非常类似的K8Nb6O19可以在水热体系中通过改变水热体系条件来得到不同物相和不同形貌的各种铌酸钾.因此,我们尝试以Na8Ta6O19为前驱体,通过改变水热反应的条件,期望得到不同晶体结构和形貌的钽酸钠.
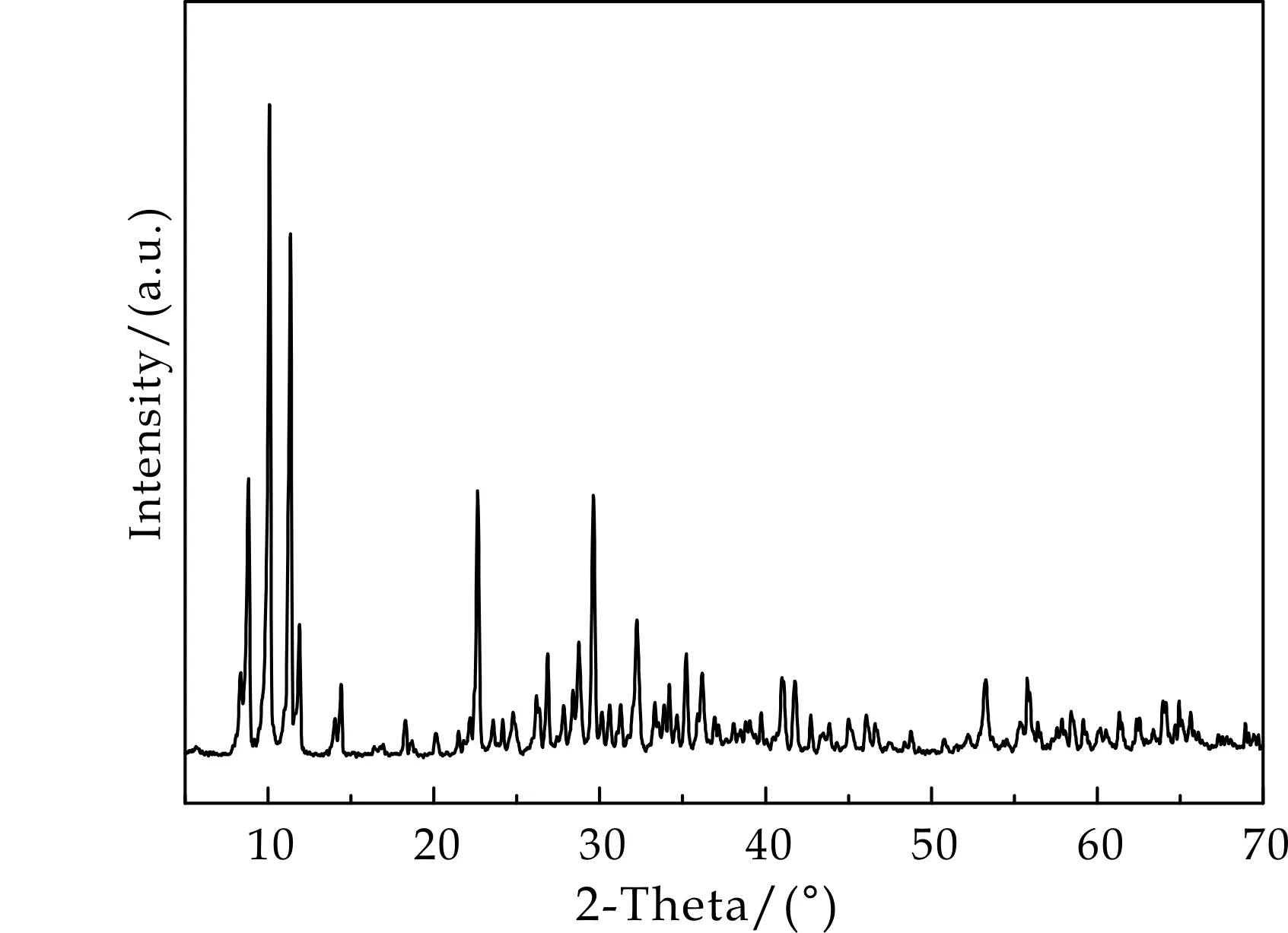
图1 前驱体Na8Ta6O19的XRD图
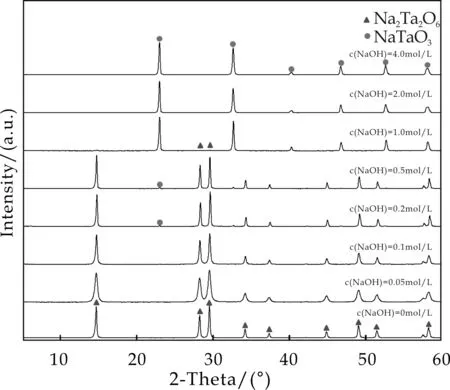
图2 以Na8Ta6O19为前驱体,不同的碱浓 度下,150 ℃,水热反应12 h所得样品的 XRD图
图2是以Na8Ta6O19为前驱体,在不同的碱浓度(0~4.00 mol/L)条件下,150 ℃下水热反应12 h所得样品的XRD图谱.从图中可以看出,以水作为反应介质时,在不同的碱浓度条件下均得到了结晶性非常高的样品.当碱浓度为0、0.05、0.1 mol/L时,水热反应完成之后得到的样品为纯相烧绿石晶型的Na2Ta2O6(JCPDS No.70-1155;a=b=c=1.044 nm,α=γ=β=90 °).而当碱浓度增大至0.2 mol/L时,样品的衍射图谱中开始出现单斜晶系钙钛矿结构的NaTaO3(JCPDS No.74-2477;a=0.388 9 nm,b=0.388 85 nm,c=0.389 9 nm,α=γ=90 °,β=90.367 °),即此时的产物为烧绿石晶型的Na2Ta2O6和钙钛矿结构的NaTaO3的复合相.当碱浓度为0.2和0.5 mol/L时,得到的产物均为复合相,但钙钛矿结构的NaTaO3的衍射强度非常弱,说明复合相中烧绿石晶型Na2Ta2O6是主要的物相.当碱浓度增大至2.0 mol/L 时,产物的衍射峰全部与钙钛矿结构NaTaO3的标准卡片相吻合,Na2Ta2O6的衍射峰消失,说明此时的产物为纯相的钙钛矿结构NaTaO3,随后即使增大碱浓度,产物的物相也没有发生改变.研究表明[13],高碱度条件下有利于NaTaO3的生成,低碱浓度条件下有利于Na2Ta2O6的生成,NaTaO3为热力学稳定相,Na2Ta2O6为热力学介稳相.这与本文中碱浓度2.0 mol/L以上生成NaTaO3,0.1 mol/L以下生成Na2Ta2O6,中间浓度生成二者的复合相的规律一致.

(a)NaOH浓度=0 mol/L (b)NaOH浓度=0.05 mol/L (c)NaOH浓度=0.10 mol/L (d)NaOH浓度=0.20 mol/L (e)NaOH浓度=0.50 mol/L (f)NaOH浓度=1.00 mol/L (g)NaOH浓度=2.00 mol/L (h)NaOH浓度=4.00 mol/L图3 以Na8Ta6O19为前驱体,不同的碱 浓度条件下150 ℃,水热反应12 h所 得样品的SEM照片
图3是以Na8Ta6O19为前驱体,在不同的碱浓度(0~4.00 mol/L)条件下,150 ℃下水热反应12 h所得样品的扫描电镜照片.图3(a)是纯相烧绿石型的Na2Ta2O6样品的扫描电镜照片,从图中可以看出,样品为尺寸约100 nm的八面体,与烧绿石的最常见的八面体形貌一致.随着碱浓度的提高,这种规则的八面体结构被破坏,逐渐变为不规则的球状、冰渣状.当碱浓度增大至2 mol/L时,结合图2的XRD图谱得知在此条件下的物相为钙钛矿结构NaTaO3,而此时的产物形貌开始转变为立方块状,这是单斜相NaTaO3的最常见形貌.由于高碱度条件下有利于NaTaO3的生成,低碱浓度条件下有利于Na2Ta2O6的生成,而且水热反应中的结晶过程和产物的结晶习性密切相关,所以低碱度条件下生成八面体晶粒,随着碱浓度的升高有向立方块状晶粒转变的趋势.
2.2 碱性条件下溶剂热合成
图4是以Na8Ta6O19为前驱体,在不同的碱浓度(0~4.00 mol/L),150 ℃下溶剂热反应12 h所得样品的XRD图谱,其中溶剂是水和乙醇体积比1∶1混合液.从图中可以看出,与水热反应相似,以水和乙醇为反应介质时,在不同的碱浓度条件下也得到了结晶性非常高的样品.但与水热体系不同的是,当碱浓度达到0.05 mol/L时,XRD图谱中就出现了NaTaO3特征衍射峰.碱浓度在0.05~1.0 mol/L之间时生成的为烧绿石型Na2Ta2O6和钙钛矿型NaTaO3的复合相.当碱浓度增加到2 mol/L和4 mol/L,产物为纯相的钙钛矿型NaTaO3.与水热合成相比,生成钙钛矿型NaTaO3溶剂热法所需的碱浓度低,这与乙醇的加入有关.在单纯的水溶液中,水分子自身的氢键作用对OH-有很强的溶剂化作用,OH-会被水分子屏蔽使得实际活度降低.而在水-乙醇混合溶剂体系中,乙醇分子体积大,对OH-的溶剂化效应要比水溶液中弱许多,所以在相同的碱度下,OH-活度比水溶液高.也就是说,加入乙醇和提高溶液的碱浓度效果是一致的[14].
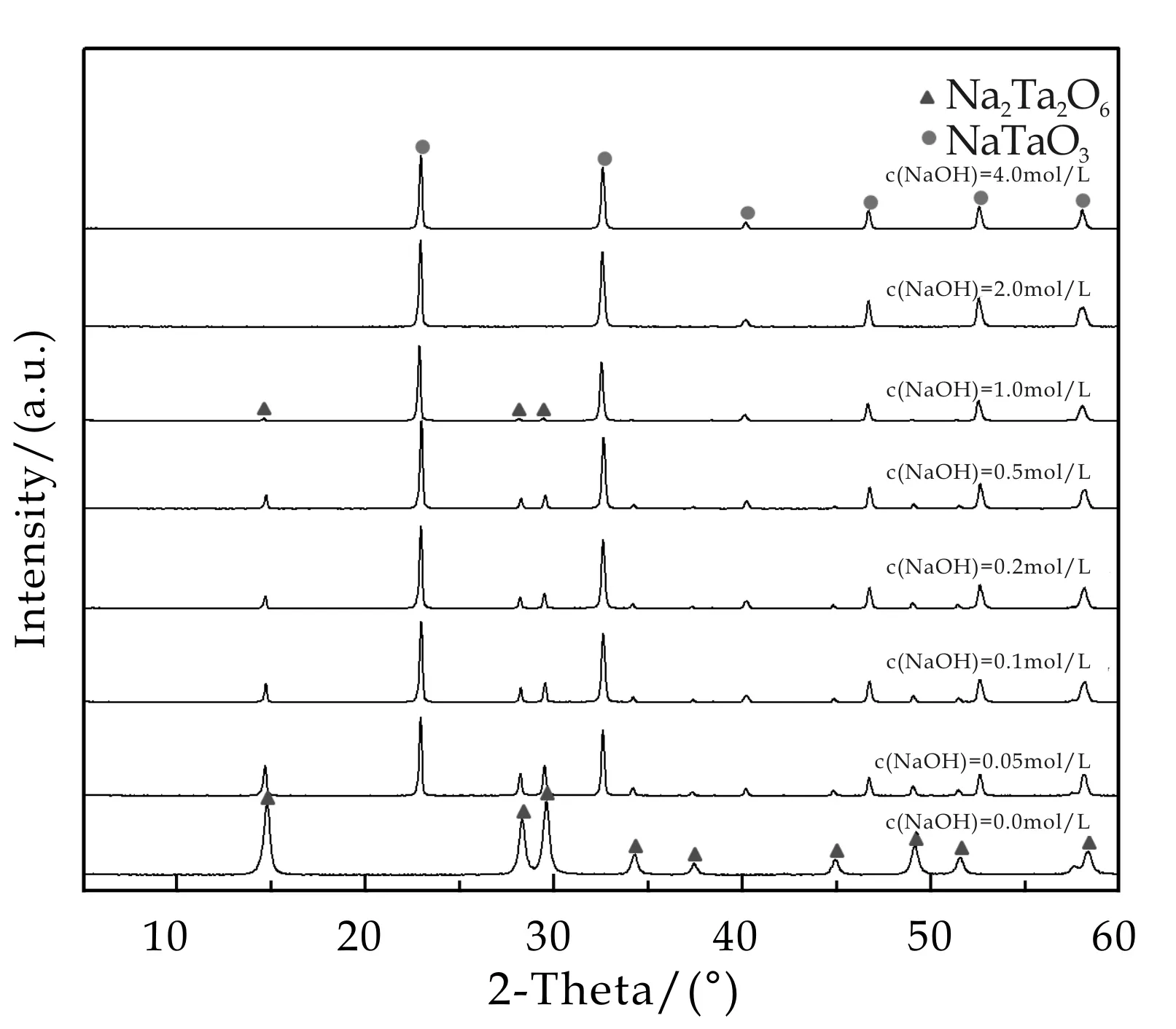
图4 以Na8Ta6O19为前驱体,在不同的碱 浓度,150 ℃,溶剂热反应12 h后所得样品的 XRD图
图5为以Na8Ta6O19为前驱体采用溶剂热的方法,V水∶V乙醇为1∶1时,在不同碱(NaOH)浓度(0~4 mol/L)下,150 ℃下反应12 h后得到产物的SEM图.从图中可以看出,在八种不同条件下制备的样品均表现出一定程度上的立方块状趋势,这可能是反应介质中的乙醇对样品的形貌有影响,从而表现出与水相介质不同的反应规律.

(a)NaOH浓度=0 mol/L (b)NaOH浓度=0.05 mol/L (c)NaOH浓度=0.10 mol/L (d)NaOH浓度=0.20 mol/L (e)NaOH浓度=0.50 mol/L (f)NaOH浓度=1.00 mol/L (g)NaOH浓度=2.00 mol/L (h)NaOH浓度=4.00 mol/L图5 以Na8Ta6O19为前驱体, V水∶V乙醇 为1∶1时,不同碱浓度150 ℃反应12 h 后得到产物的SEM图
2.3 酸性条件下溶剂热合成
图6是以Na8Ta6O19为前驱体,加入0.174 g(0.1 mol/L)NaCl,分别在V水∶V乙醇为2∶1和1∶1的溶液中、230 ℃下反应12 h合成样品的XRD图谱.结果显示,当水和乙醇的配比为V水∶V乙醇=1∶1时,得到的样品为非晶相.而当V水∶V乙醇=2∶1时,样品为纯相烧绿石型H2Ta2O6(JCPDS No.75-2353;a=b=c=1.603 2 nm,α=γ=β=90 °) . 这可能是由于酸性条件下,首先生成了烧绿石型的Na2Ta2O6, Na+占据了TaO67-八面体体心位置,但由于在酸性条件下,H+具有较大的浓度优势,从而取代了Na+的八面体体心位置,形成了H2Ta2O6.此外,我们还尝试了酸性条件下,以水为溶剂的水热反应,得到产物均为非晶相.因此,本文中,在酸性条件下水热和溶剂热均未制备出钽酸钠晶体.
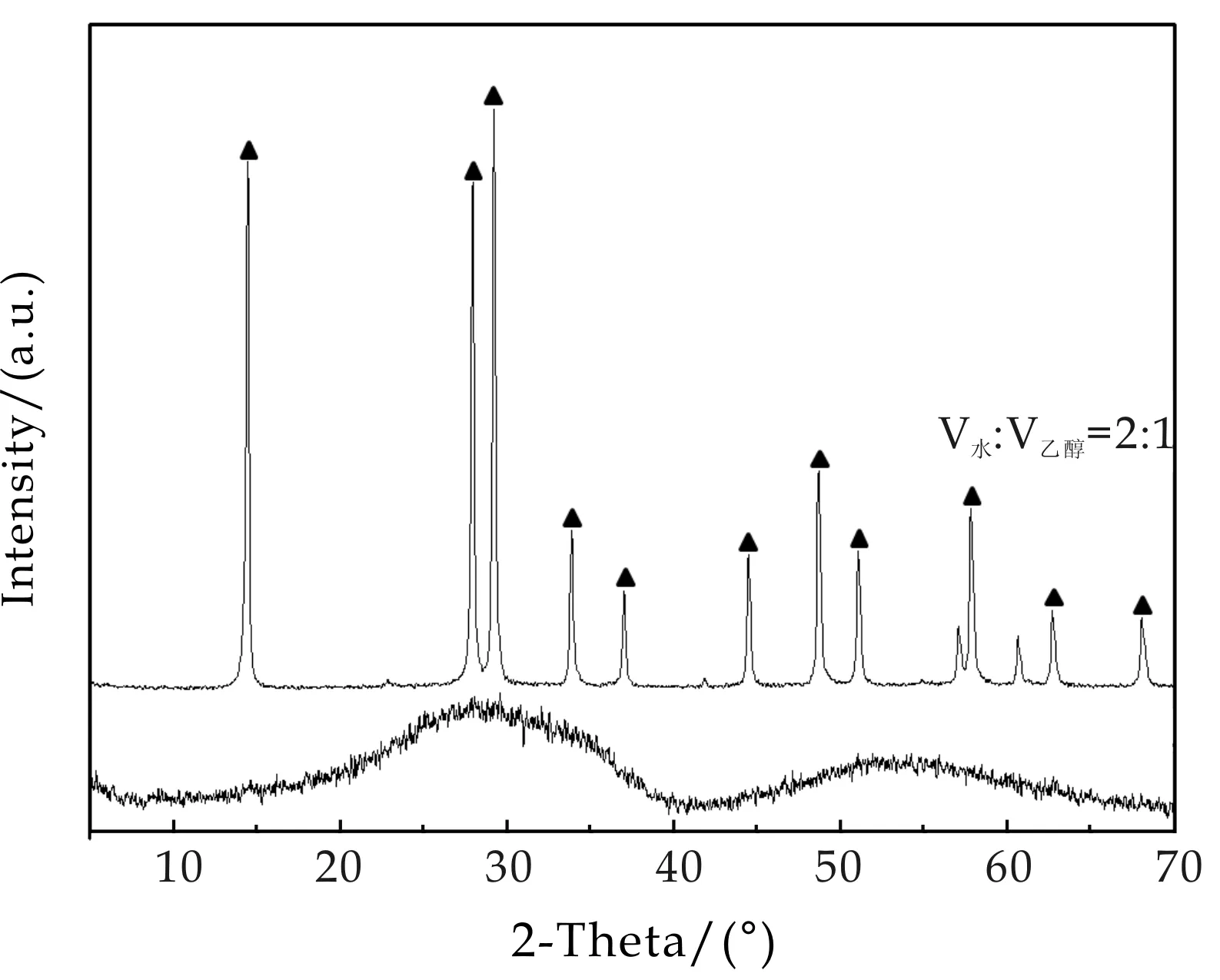
图6 前驱体Na8Ta6O19与0.1 mol/L NaCl在不同溶剂中230 ℃下反应12 h所得样品 的XRD图

(a) V水∶V乙醇=1∶1 (b) V水∶V乙醇=2∶1图7 前驱体Na8Ta6O19与0.1 mol/L NaCl在不同溶剂中230 ℃下反应12 h 所得样品的SEM照片
图7是以Na8Ta6O19为前驱体,加入0.174 g(0.1 mol/L)NaCl,分别在V水∶V乙醇为1∶1和2∶1的溶液中、230 ℃下反应12 h合成样品的SEM照片.图6(a)是V水∶V乙醇为1∶1条件下合成样品的SEM照片,这些非晶相表现出了不规则的形貌.而图6(b)中的H2Ta2O6则表现出了与烧绿石型Na2Ta2O6一致的八面体形貌.
2.4 光催化性能测试
在光催化性能测试中,为了研究形貌和物相对催化剂催化降解性能的影响,从上述制备的样品中,选取水热条件下所制得的具有代表性形貌的纯相Na2Ta2O6,纯相NaTaO3以及Na2Ta2O6含量较多(richNa2Ta2O6/NaTaO3)和NaTaO3含量较多(richNaTaO3/Na2Ta2O6)的复合相样品进行了光催化性能的测试,上述四个样品分别对应于图3中的(a),(h),(d),(f),即分别具有八面体状、立方体状、冰渣状和球状形貌.以500 W汞灯为紫外光光源,亚甲基蓝为目标污染物.将50 mg的催化剂加入到50 mL, 10 mgL-1的亚甲基蓝溶液中,先经暗反应40 min,使催化剂表面对有机污染物的吸附在体系中达到平衡,再用紫外光源进行照射.光照条件下每10 min取样一次,每次取6 mL液体,离心,取上层清液,在Unico UV-2600分光光度计上测量其吸光度,所得降解效果如图8所示.从图中可以看出,经过暗反应的吸附-脱附平衡之后,四种催化剂对亚甲基蓝的吸附程度均不大,存在较小差异,这主要是四种催化剂的尺寸和形貌影响的.四种催化剂中,烧绿石型的Na2Ta2O6(图3(a))表现出规则的独立八面体形貌,并且其尺寸最小,比表面最大,因此其对有机物的吸附程度最大.richNa2Ta2O6/NaTaO3(图3(d))表现出不规则的冰渣状,并且小颗粒团聚在一起,虽然粒径较小,但其比表面积小于烧绿石型Na2Ta2O6,而richNaTaO3/Na2Ta2O6(图3(f))的粒径在微米级,纯相NaTaO3(图3(h))则为生长在一起的立方体,单个立方体的尺寸在微米级,比表面积更小,所以三者吸附能力呈降低趋势.因此,在暗反应过程中,样品的形貌和尺寸对样品的吸附能力起关键性作用.
暗反应之后,将有机污染物在紫外光下降解,光源为500 W汞灯.从图中可以发现,在紫外光下,四种催化剂对亚甲基蓝均有明显的降解,并且richNa2Ta2O6/NaTaO3对亚甲基蓝的降解程度最大,紫外照射条件下,30 min时降解率达到了68%.
图9为各个钽酸钠样品的UV-vis谱.从图中可以看出,复合相的钽酸钠相比于纯相的吸收峰存在红移现象,复合相对光的响应范围更宽,光的利用率更高,即在波长较长的光作用下也能够被激发.根据公式Eg(eV)=1 240/λ(nm)可算出各样品的禁带宽度,经计算,NaTaO3、Na2Ta2O6、richNa2Ta2O6/NaTaO3、richNaTaO3/Na2Ta2O6的禁带宽度分别约为4.3 eV, 4.6 eV, 4.1 eV和4.1 eV. 钽酸钠价带及导带分别由O2p和Ta5d构成,各样品的带宽不同是因为Ta-O键的键长及TaO6八面体的连接方式不同,而钙钛矿钽酸钠和烧绿石型钽酸钠复合时,界面处的TaO6严重扭曲,从而使其能带结构发生了较大的变化[8].
图10是两种不同晶体结构的钽酸钠的能带结构[15],从图中可以看出二者的能带结构能够匹配,结合样品的SEM照片,可以说明,两相生长的过程中形成了界面化学键和异质结构.
对比纯相钽酸钠的光催化性能可以看出,虽然NaTaO3的带宽小于Na2Ta2O6的带宽,但NaTaO3的光催化能力却稍弱于Na2Ta2O6,这是因为Na2Ta2O6的尺寸更小,与有机污染物的接触面积更大,因此样品的形貌对光催化能力有较大影响.richNa2Ta2O6/NaTaO3的光催化能力强于richNaTaO3/Na2Ta2O6,也是样品形貌尺寸作用的结果.而对比复合相与纯相钽酸钠的光催化效果可以看出,复合相中所形成的异质结对光催化能力的提高起了关键性的作用.当被紫外光激发时,复合相中产生的光生载流子能够高效的分离,抑制了电子空穴对的复合,提高了量子效率[16],从而具有更好的光催化性能.
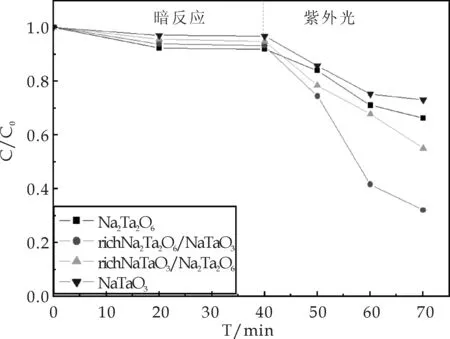
图8 四种样品对亚甲基蓝的光催化降解图
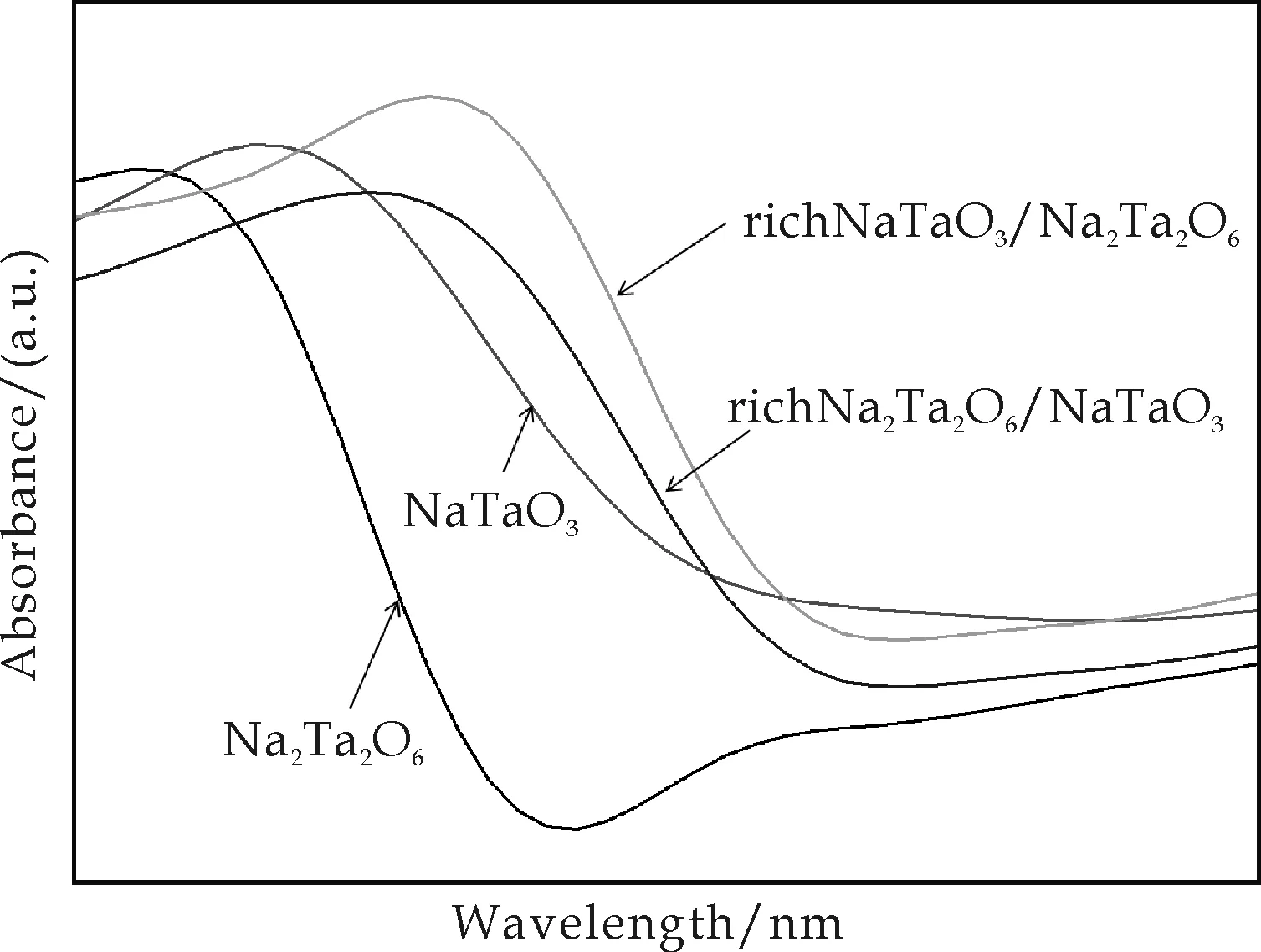
图9 四种样品的紫外可见吸收光谱
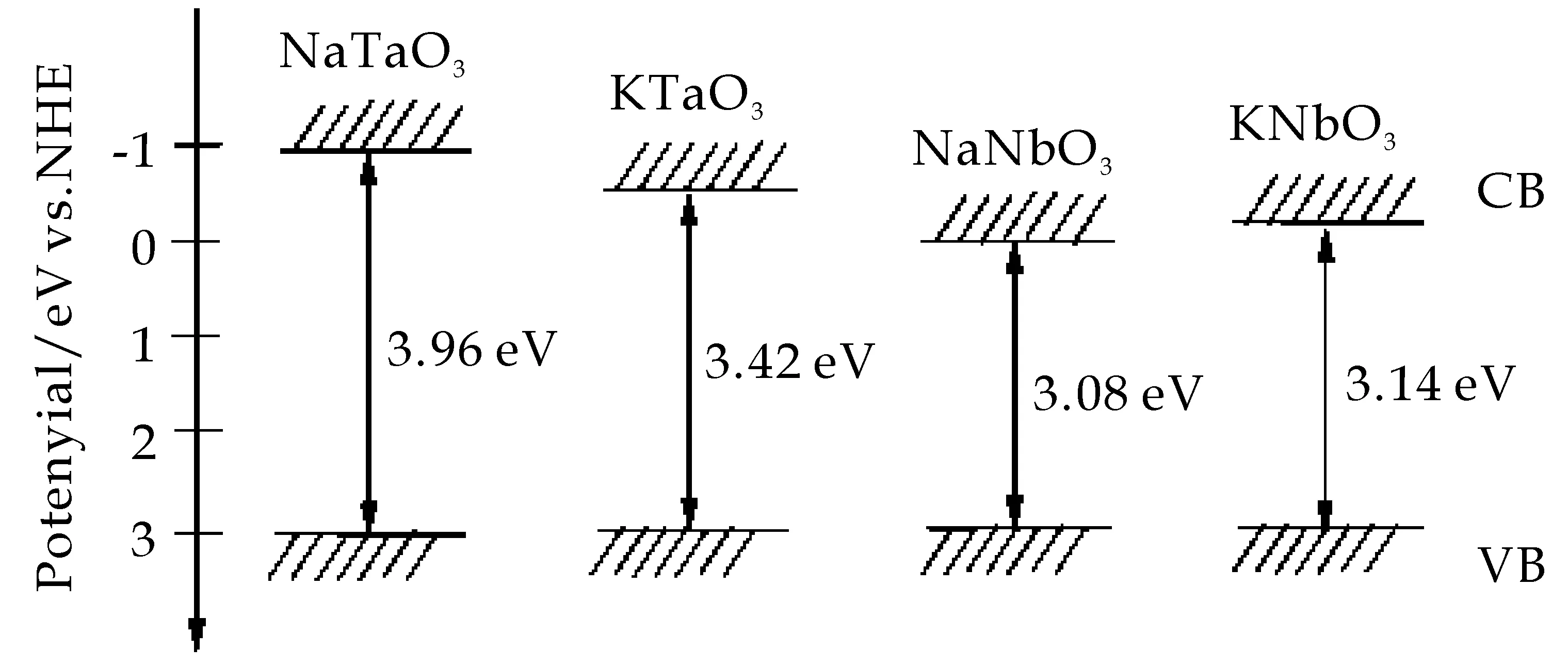
图10 钽酸钠的能带结构图
3 结论
研究了水热体系中碱浓度、溶剂类型和pH值对所制钽酸钠样品晶体结构和形貌的影响,制备了纯相Na2Ta2O6、纯相NaTaO3及Na2Ta2O6/NaTaO3复合光催化剂,其中,碱浓度对产物的物相和形貌影响较大,水相体系和水-乙醇体系对产物影响有一定的差异,酸性条件下未能制备钽酸钠.复合相中Na2Ta2O6与NaTaO3形成了异质结,抑制了电子空穴对的复合,从而表现出优于单相钽酸钠的光催化降解亚甲基蓝的性能.此外,催化剂的形貌对其催化能力也有重要的影响.这种通过控制碱浓度和溶剂类型来合成不同晶体结构和形貌的钽酸钠对于钽酸盐系列光催化剂的研究具有重要意义.
[1] 郭新斌,乔庆东.太阳能光解水制氢催化剂研究进展[J].化工进展,2006,25(7):729-732,764.
[2] Kato H,Kudo A.Water splitting into H2and O2on alkali tantalate photocatalysts ATaO3(A= Li,Na,and K)[J].The Journal of Physical Chemistry B,2001,105(19):4 285-4 292.
[3] Kato H,Kudo A.New tantalate photocatalysts for water decomposition into H2and O2[J].Chemical Physics Letters,1998,295(5):487-492.
[4] Kato H,Kudo A.Photocatalytic water splitting into H2and O2over various tantalate photocatalysts[J].Catalysis Today,2003,78(1):561-569.
[5] Machida M,Ma X,Yabunaka J,et al.Pillaring and photocatalytic property of partially substituted layered tianates, Na2Ti3-xMxO7and K2Ti4-xMxO9(M=Mn, Fe, Co, Ni, Cu)[J].J.Mol.Catal.A:Chem,2000,155:131-142.
[6] 张 辉,杨俊峰,杨卫明,等.有机胺柱类钙钛矿型钽酸盐的制备与表征[J].分析测试学报,2004,22(6):51-53.
[7] He Y,Zhu Y,Wu N.Synthesis of nanosized NaTaO3in low temperature and its photocatalytic performance[J].Journal of Solid State Chemistry,2004,177(11):3 868-3 872.
[8] 黄浪欢,产启中,张 斌,等.不同结构钽酸钠的制备及其光解水析氢性能[J].催化学报,2001,32(12):1 822-1 830.
[9] Abramov P A,Abramova A M,Peresypkina E V,et al.New polyoxotantalate salt Na8[Ta6O19]·24.5H2O and its properties[J].Journal of Structural Chemistry,2011,52(5):1 012-1 017.
[10] Guo G L,Xu Y Q,Chen B K,et al.Two novel polyoxotantalates formed by lindqvist-type hexatantalate and copper-amine complexes[J].Inorganic Chemistry Communications,2011,14(9):1 448-1 451.
[11] Mann M,Jackson S,Kolis J.Hydrothermal crystal growth of the potassium niobate and potassium tantalate family of crystals[J].Journal of Solid State Chemistry,2010,183(11):2 675-2 680.
[12] Kong X,Hu D,Wen P,et al.Transformation of potassium lindquist hexaniobate to various potassium niobates: solvothermal synthesis and structural evolution mechanism[J].Dalton Transactions,2013,42(21):7 699-7 709.
[13] Lee Y,Watanabe T,Takata T,et al.Preparation and characterization of sodium tantalate thin films by hydrothermal-electrochemical synthesis[J].Chemistry of Materials,2005,17(9):2 422-2 426.
[14] Murphy C J,Jana N R.Controlling the aspect ratio of inorganic nanorods and nanowires[J].Advanced Materials,2002,14(1):80.
[15] Liu J W,Chen G,Li Z H,et al.Hydrothermal synthesis and photocatalytic properties of ATaO3and ANbO3(A=Na and K)[J].International Journal of Hydrogen Energy,2007,32(13):2 269-2 272.
[16] Liu J,Xue Y,Gao Y,et al.Hole and electron extraction layers based on graphene oxide derivatives for high-performance bulk heterojunction solar cells[J].Advanced Materials,2012,24(17):2 228-2 233.

