桉木预处理后固形物及提取液的特性
迟聪聪, 柳 咪, 龚亚辉, 张素风, 张 斌, 张 曾
(1.陕西科技大学 轻工与能源学院 陕西省造纸技术及特种纸品开发重点实验室, 陕西 西安 710021; 2.中兴通讯股份有限公司, 陕西 西安 710065; 3.华南理工大学 轻工与食品学院 制浆造纸工程国家重点实验室, 广东 广州 510640)
0 引言
随着世界经济发展、科技进步,以及人们生活水平的提高,气候变暖、资源短缺、能源危机、环境污染等一系列社会问题随之产生且日益严峻,亟待我们去解决.当前,世界对能源的需求量不断增长.从绿色可持续发展的角度来看,木质纤维资源在生产矿物燃料替代品如生物乙醇等方面,具有较大潜力[1,2].
木质纤维素,尤其是木材纤维,是生产纸浆和纸类产品的主要原料.木质纤维素中的碳水化合物含量占相当比例,可以采用合理工艺将其部分或全部转化为可发酵糖,进而转化为乙醇.第一种思路是预处理-碱法制浆,可同时得到可发酵糖和纸类产品;第二种思路是采用高效预处理尽可能将所有碳水化合物转化为可发酵糖.鉴于木质纤维素的致密结构使其具有抗降解性[3],因此找寻有效的预处理工艺方法以提高酶的可及性相当关键.
近些年来,一些学者在生物炼制与碱法制浆相结合、木质纤维素预处理、半纤维素分离转化、燃料乙醇转化等方面进行了相关研究,但对综合酶水解糖化效率、发酵效率、生产设备要求和经济效益等方面的研究结果却并不理想.Jameel等[4]研究了木片绿液预处理可有效提高酶解糖得率,但碱回收是个问题;Kim等[5]研究了氨预处理大麦壳,但半纤维素在氨浓度高时会有损失;Garlock等[6]采用氨爆破法处理非木材原料,但氨的有效回收是需要妥善解决的问题;Leif等[7]认为稀硫酸预处理尽管可以使大部分半纤维素水解,但易形成副产物如糠醛和羟甲基糠醛等,后者会对发酵产生抑制作用.
本研究探讨了碱预处理和高温水预水解对桉木片固体残渣及提取液的影响,以期为后续研究或工业化应用提供理论参考或指导.
1 实验部分
1.1 原料
实验用刚果12号桉木片(EucalyptusABL 12)取自于广东省某林业局,树龄5年.木片经人工筛选获得化学法制浆用合格木片,风干保存备用.
1.2 木片预处理
1.2.1 高温水预水解
低温(≤100 ℃)水预水解在水浴锅中进行;高温(>100 ℃)水预水解在美国M/K型实验室蒸煮器中进行.预处理后,木片用蒸馏水充分洗涤,风干后保存备用.
1.2.2 碱预处理
碱预处理在水浴锅中进行,预处理后木片用蒸馏水充分洗涤,风干后保存备用.预处理后木片和提取液试样编号,及其对应的预处理条件见表1所示.
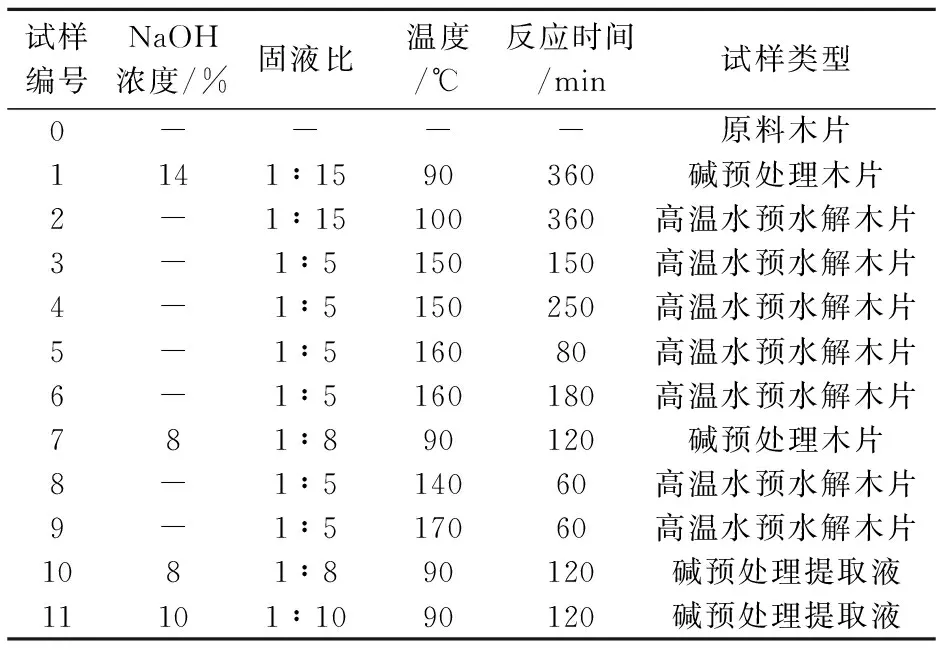
表1 不同固形物及提取液试样的预处理条件
注:上述反应时间均为保温时间,不包含升温时间.
1.3 木材化学组分分析
木材中苯醇抽出物(2∶1 v/v)、Klason木素、酸溶木素(ASL)、聚戊糖,以及灰分含量等的测定参考国家标准[8].
1.4 糖类组分分析
木片及提取液中糖类组分的分析采用离子色谱法进行.所用仪器为离子色谱仪(ICS-3000型, Dionex),色谱柱为CarboPacTMPA1.木片中的糖类分析前采用两段酸水解法:72% H2SO4,2 h,室温;3% H2SO4,1.5 h,121 ℃.
对提取液中的单糖和低聚糖均进行分析.总糖含量由一段酸水解法(3% H2SO4,1.5 h,121 ℃)获得,单糖含量可直接测得.总糖与单糖含量之差,即低聚糖含量.
1.5 半纤维素分离与纯化
对木片及碱预处理提取液中的半纤维素进行分离纯化[9].
(1)木片:木片磨粉取40~60目木粉.根据国家标准制备综纤维素,然后对半纤维素进行分离纯化[10].
(2)碱提取液:碱提取液中半纤维素的分离纯化方法参照文献[11]进行.
1.6 EMAL木素制备
木片中EMAL木素的分离,采用酶处理-温和酸水解(EMAL)方法进行.具体可参考Argyropoulos D.S.所著文献[12]和[13].
1.7 半纤维素/木素的分子量分析
半纤维素与木素的分子量及分布的分析,采用凝胶渗透色谱法(GPC)进行.
将章节1.5中所制备的半纤维素样品溶于60 ℃去离子水,配制成浓度为1 g/L的溶液,然后在10 000 rpm转速下离心10分钟,取上清液经0.45μm的水性微孔滤膜过滤后在凝胶渗透色谱仪上进行分子量测定.
色谱条件为:Waters HPLC(BREEZE GPC System),TSKG5000和TSKG3000凝胶色谱柱双柱串联,柱温40 ℃,流动相KH2PO4,流速0.5 mL/min,进样量20μL,Waters 1525 Binary HPLC Pump,Waters 717 plus Autosamplar自动进样器,Waters 2414 Refractive Index Detector示差折光检测器.分子量标准样品为葡聚糖系列,分子量范围为5 000~600 000.
将章节1.6中制备的木素样品先乙酰化,再溶于四氢呋喃,配制成浓度4 mg/mL的溶液[13,14].木素分子量的分析在Aglient GPC上进行,柱温30 ℃,示差折光检测器(35 ℃),流动相四氢呋喃,流速1 mL/min,进样量20μL,分子量标准样品为聚苯乙烯系列,分子量范围为1 030~47 000.
1.8 31P-NMR分析
EMAL木素样品先用2-氯-4,4,5,5-四甲基-1,3,2-二氧膦杂戊环(2-chloro-4,4,5,5-tetramethy-1,3,2-dioxaphospholane,简称TMDP)衍生化,然后在NMR仪器上进行分析,具体操作可参考文献[13].
31P-NMR定量分析在Bruker 400MHZ Advance型波谱仪上进行,其条件为:常温,脉冲角90°,脉冲间隔时间25 s,信号采集次数250,扫描宽度δ=61.9.
2 结果与讨论
2.1 预处理对桉木化学组成的影响
桉木经高温水预水解或碱预处理后,木片得率与其聚戊糖含量之间的关系见图2所示.对实验获取的大量数据进行拟合,发现两者之间线性关系较好,这表明木聚糖或半纤维素的降解溶出是预处理后木片失重的主要原因.
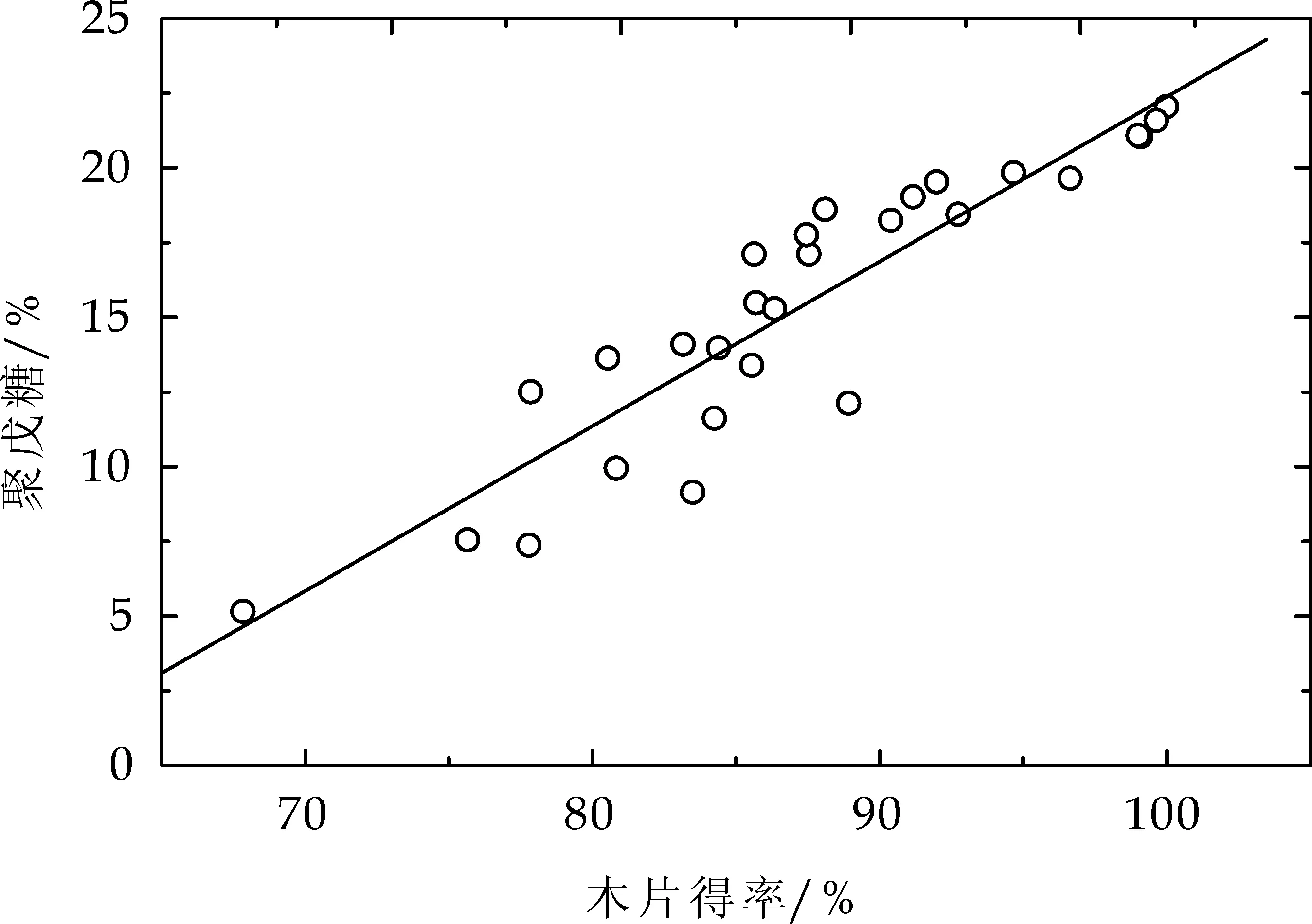
图1 预处理后木片得率与聚戊糖含量的关系
从表2中桉木片的化学组分分析结果可以得知,碱预处理与高温水预水解相比,木片中的纤维素含量相对较低,说明前者使纤维素降解的程度大;木片经高温水预水解后,苯醇抽出物含量增加,而聚戊糖含量则明显降低,且两者均随温度的升高或时间的延长而增加或降低,木素及灰分含量降低,纤维素含量变化不大,这将有利于后续碱法制浆得率或酶水解过程可发酵糖得率的提高.

表2 预处理前后桉木的化学组成
注:所有数据都是基于原料木片的质量百分比(表3同).
2.2 高温水预水解对提取液的影响
桉木片在不同条件下进行高温水预水解,提取液的化学组分分析结果见表3所示.由表3可以得出,在一定范围内,随着温度的升高或时间的延长,提取液pH值降低,这与前人的研究结果一致[15].
提取液中含有一定量的糠醛和5-羟甲基糠醛,主要是聚戊糖和聚己糖在高温酸性条件下的降解产物[16].由于其含量较低,不会对后续酶水解及发酵工艺产生太大影响.结合表2中的糖含量数据,木片经高温水预水解后约有1/3~1/2的半纤维素降解溶出到提取液中,并且单糖/低聚糖比值随着水预水解剧烈程度的增加而增加(试样4和3,试样6和5).另外,提取液中酸溶木素含量与原料及预处理后木片中的酸溶木素含量结果相符合.

表3 桉木预处理提取液分析结果
2.3 预处理对半纤维素分子量及分布的影响
对四个高温水预水解及两个碱预处理提取液试样中半纤维素的分子量及分布进行GPC分析,结果如图2所示.从图2中可以看出,不论提取液还是预处理后木片中分离出半纤维素的分子量(数均Mn,重均Mw和Z均Mz)均有不同程度的降低.与碱预处理相比,高温水预水解后半纤维素的分子量大幅度降低,且温度越高,分子量越低.高温水预水解温度分别为140 ℃和170 ℃时,木片中半纤维素的数均分子量(Mn)由原料木片(试样O)的56 800依次降至27 600(试样8)和8 600(试样9).对碱预处理,木片及提取液中半纤维素的多分散系数均增加,而高温水预水解后半纤维素的多分散系数几乎不变.

图2 半纤维素样品的平均 分子量及其分布
上述结果应归因于不同预处理的机理差异.对于高温水预水解,在高温酸性条件下,随着侧链乙酰基和葡萄糖醛酸基等酸性基团的脱落[17],提取液pH值降低,引起半纤维素酸性降解,从而使分子量明显降低.酸性降解与剥皮反应(碱预处理)不同,前者使主链从中间断裂,分子量分布相对均匀,因此,碱预处理后木片及提取液中分离半纤维素的分子量多分散系数相对较高.
2.4 预处理对木素分子量及分布的影响
在高温水预水解过程中,木片中的木素在降解溶出的同时可能发生缩合反应,这必然会影响木素的分子量大小及其分布.可以通过测定木素分子量的变化来反映木素的缩合情况.
从图3可以看出,经过高温水预水解后,木片中酶解木素的分子量向高分子量方向移动,分布相对集中,多分散性稍有降低,而且不同水预水解条件下各木片中酶解木素的分子量及分布非常相似.
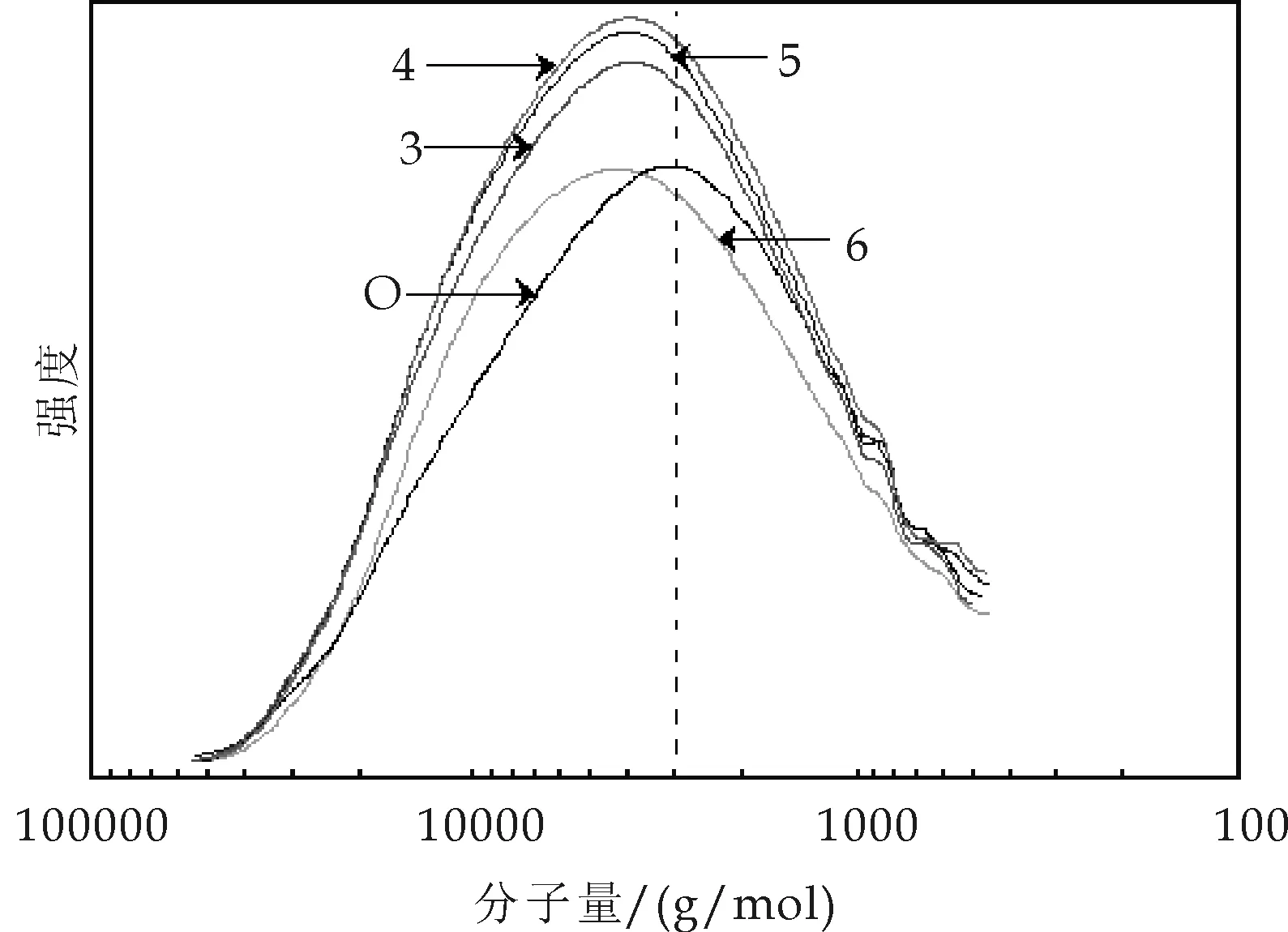
图3 EMAL木素的分子量及其分布曲线
表4列出了不同酶解木素试样的平均分子量.经高温水预水解后,木片中酶解木素的平均分子量均有所增加,其中重均分子量增加5%~9%,但多分散性稍有降低.其可能原因有两点:一是高温水预水解过程中有木素小分子溶出,主要为酸溶木素,从而残留在木片中木素的平均分子量增加;二是木素在高温酸性条件下可能发生缩合反应,使得预处理后木片中木素的分子量变大.由于木素平均分子量增加幅度不大,可推测出小分子木素的溶出是导致此结果的主要原因.
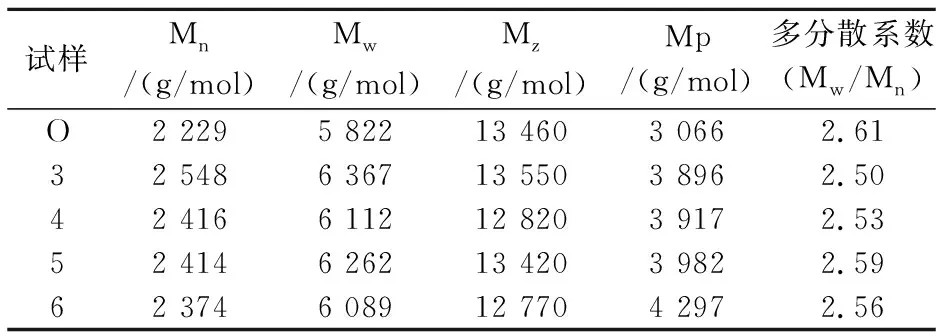
表4 EMAL木素样品的平均分子量及其分布
2.5 预处理对木素结构的影响
酚羟基是木素结构中的重要基团之一,在碱法蒸煮中发挥着重要作用.例如,在NaOH-AQ法和硫酸盐法蒸煮中,木素酚型结构在碱法蒸煮中可以反应转化为中间产物醌型结构.木素的酚型结构具有不同的反应性,目前31P-NMR在测定木素酚羟基含量方面的应用较为广泛.
含有不稳定氢的化合物(如含有-OH,-SH 和-COOH 等基团),可以与磷化试剂反应生成含磷的衍生物.然后,利用31P-NMR核磁共振光谱技术可以对这些基团进行定性或定量分析.
EMAL木素的定量分析结果见表5所示.由31P-NMR分析结果得知,水预水解后木片的各类酚羟基含量均有不同程度的增加,而脂肪族羟基含量降低.原木片木素的S/G型酚羟基比例为0.97∶1,而经高温水预水解后,S/G型酚羟基比例变为(0.96~1.19)∶1,紫丁香型酚羟基含量的比例增加,这说明在高温水预水解过程中紫丁香基结构比愈疮木基更优先游离出酚羟基.
经高温水预水解后,木片EMAL木素中的酚羟基含量明显上升,缩合型和非缩合酚羟基含量分别增加0.8~1.7倍和0.5~1.0倍,总酚羟基含量增加0.7~1.3倍,而脂肪族羟基和羧基含量则有所下降.缩合酚羟基含量随水预水解时间的延长而增加,脂肪羟基则是呈下降趋势.木素中酚羟基含量的增加,有利于其在碱法制浆过程中反应性能的提升,而脂肪族羟基的减少可能是由于木素苯丙烷结构中脂肪侧链的溶出而引起的.

表5 EMAL木素的31P-NMR定量分析结果
注:S, G, H代表三种不同类型木素,即紫丁香基,愈创木基和对羟苯基.
3 结论
(1)合理条件下的高温水预水解能够有效地提取木片中的半纤维素糖,且不会产生大量抑制物,如糠醛和羟甲基糠醛.提取液中不同形式的糖是预处理过程后木片失重的主要原因.
(2)木片预处理后,固形物及提取液中半纤维素的数均分子量均有不同程度地降低.与碱预处理相比,高温水预水解使半纤维素分子量大幅度降低,且温度越高,分子量越低.碱预处理后木片及提取液中半纤维素的多分散系数均增加,而高温水预水解后半纤维素的多分散系数几乎不变.
(3)高温水预水解后,EMAL木素中的总酚羟基含量几乎增加一倍,S/G增加,脂肪族羟基与羧基含量则大大降低.木素的平均分子量增加,多分散系数降低,可能与高温水预水解过程中小分子量木素的溶出及木素的缩合有关.
[1] Cohen S.J..Climate change in the 21st century[M].Montreal:Mc Gill Queen′s University Press,2009.
[2] Mabro R..Oil in the 21st century:issues,challenges and opportunities[M].New York:Oxford University Press,2006:203-206.
[3] Himmel M.E..Biomass recalcitrance:deconstructing the plant cell wall for bioenergy[M].Oxford:Blackwell Pub.,2008:436-453.
[4] Jin Y.C.,Jameel H.,Chang H M,et al.Green liquor pretreatment of mixed hardwood for ethanol production in a repurposed kraft pulp mill[J].Journal of Wood Chemistry and Technology,2010,30(1):86-104.
[5] Kim T.H.,Taylor F.,Hicks K.B.Bioethanol production from barley hull using SAA (soaking in aqueous ammonia) pretreatment[J].Bioresource Technology,2008,99(13):5 694-5 702.
[6] Garlock R.J.,Balan V.,Dale B.E.Optimization of AFEX pretreatment conditions and enzyme mixtures to maximize sugar release from upland and lowland swichgrass[J].Bioresource Technology,2012,104:757-768.
[7] Leif J.J.,Björn A.,Nils Olof N.Bioconversion of lignocellulose:inhibitors and detoxification[J].Biotechnology for Biofuels,2013,6(1):16-25.
[8] 石淑兰,何福望.制浆造纸分析与检测[M].北京:中国轻工业出版社,2008.
[9] GB/T 2677.10-1995,植物纤维素原料中棕纤维素测定[S].
[10] Ren J.,Sun R.,Liu C,et al.Preparation and characterization of novel hemicellulosic derivatives[J].Transactions of China Pulp & Paper,2006,21(4):62-65.
[11] 于建仁.桉木半纤维素预提取及其对碱法制浆的影响[D].广州:华南理工大学,2008.
[12] Wu S.,Argyropoulos D.S..An improved method for isolating lignin in high yield and purity[J].Journal of pulp & Paper Science,2003,29(7):235-240.
[13] Granata A.,Argyropoulos D.S..2-Chloro-4,4,5,5-tetramethyl-1,3,2-dioxaphospholate,a reagent for the accurate determination of the uncondensed and condensed phenolic moieties in lignins[J].Journal of Agriculture and Food Chemistry,1995,43(6):1 538-1 544.
[14] Guerra A.,Lucia L.A.,Argyropoulos D.S..Isolation and characterization of lignins from Eucalyptus grandis hill ex maiden and eucalyptus globulus labill. by enzymatic mild acidolysis (EMAL)[J].Holzforschung,2008,62(4):24-30.
[15] Chi C.,Zhang Z.,Liu X.,et al.Dissolution of eucalyptus wood components in hot water prehydrolysis[C]//International Conference on Pulping,Papermaking and Biotechnology.Nanjing:Science and Culture of China Press,2008:107-110.
[16] Negro M.J.,Manzanares P.,Ballesteros M.,et al.Hydrothermal pretreatment conditions to enhance ethanol production from poplar biomass[J].Applied Biochemistry and Biotechnology,2003,105(1):87-100.
[17] Tunc M.S.,Heiningen A.Van.Hydrothermal dissolution of mixed southern hardwoods. Holzforschung[J].2008,62(5):539-545.

