六硝基六氮杂异伍兹烷合成工艺研究进展
庞思平,申帆帆,吕芃浩,董凯,张义迎,孙成辉,宋建伟,赵信歧
(1.北京理工大学材料学院,北京 100081;2.北京理工大学生命学院,北京 100081; 3.辽宁庆阳特种化工有限公司,辽宁辽阳 111002)
六硝基六氮杂异伍兹烷合成工艺研究进展
庞思平1,申帆帆2,吕芃浩1,董凯1,张义迎1,孙成辉1,宋建伟3,赵信歧1
(1.北京理工大学材料学院,北京 100081;2.北京理工大学生命学院,北京 100081; 3.辽宁庆阳特种化工有限公司,辽宁辽阳 111002)
综述了近年来针对高能量高密度化合物六硝基六氮杂异伍兹烷(HNIW或CL-20)合成工艺的制造和改进的研究进展,对以六苄基六氮杂异伍兹烷(HBIW)为中间体的3条工程化制造路线的优缺点和应用情况进行了讨论,并对合成CL-20的新工艺路线存在新型异伍兹烷前体合成及其硝化产率都很低,副反应多,异伍兹烷笼形立体结构易破裂等难点进行了分析,得出CL-20的低成本制造技术发展方向为寻求新型高效的催化剂和探索新合成工艺路线的结论。
兵器科学与技术;六硝基六氮杂异伍兹烷;六苄基六氮杂异伍兹烷;合成;工程化制造
0 引言
CL-20,化学名称:2,4,6,8,10,12-六硝基-2,4, 6,8,10,12-六氮杂四环[5.5.0.05,9.03,11]十二烷,简称六硝基六氮杂异伍兹烷,美国代号为CL-20,是当前已实现批量合成的能量水平最高的高能量高密度化合物[1-3]。CL-20晶体在常温下存在4种形态,即α、β、γ、ε晶型,其中ε-CL-20密度最大,最具实用价值,其爆速9 580 m/s,爆压42~43 GPa,标准生成焓约980 kJ/kg,比奥克托今(HMX)的爆热高9.2%,密度高7%,爆速高5%.国内外围绕CL-20的合成工艺制造与改进开展了大量工作,取得了显著成果。这些工作可以大致分为两个部分,即对六苄基六氮杂异伍兹烷(HBIW)催化氢解路线的优化及工程化放大,以及新型CL-20合成路线的探索。
1 CL-20传统合成工艺
CL-20是一个具有复杂立体分子结构的笼形化合物,相对于传统的黑索今(RDX)、HMX等含能材料,其合成工艺要复杂得多。1987年,Nielsen首先成功合成CL-20时,每千克CL-20的成本达到3.5万美元[2-3]。此后,优化CL-20制造工艺的工作在世界各国展开。
1.1 HBIW的制造工艺优化
合成CL-20需要由简单的小分子构造出笼型的异伍兹烷结构,首先要解决的问题是笼型母体的合成。目前,能够实现工程化的CL-20制造路线均以HBIW为前体。1990年Nielsen[4]报道了HBIW的合成(见图1),采用乙腈为介质,甲酸为催化剂,在室温条件下加入苄胺和乙二醛,即可得到HBIW. HBIW需经过精制方可用于氢解反应,精制收率在90%以上。1997年,Nielsen等有关CL-20合成工艺专利公开[5-6],专利中HBIW合成方法的反应介质有:乙腈/水及甲醇、乙醇、丙醇的水溶液,其中以乙腈/水为反应介质时的产品得率最高。
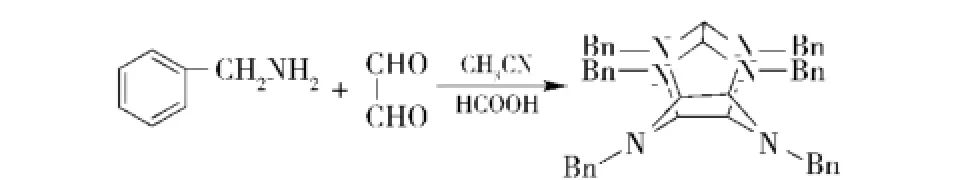
图1 HBIW的合成路线Fig.1 Synthetic route of HBIW
Crampton等[7-8]采用与Nielsen相近的工艺条件,系统地研究了HBIW同系物的合成,得出使用不含取代基的苄胺为原料时,HBIW的得率最高。此后,Thiokol公司基于上述路线进行了详细研究。在催化剂选择方面,Thiokol公司研究了乙酸、丁酸、草酸、己二酸多种有机酸,硫酸,高氯酸,盐酸,硝酸等无机酸,并对此缩合反应的催化效果进行了比较,发现HClO4的催化效果最好[9],与Crampton研究的结果相近。Thiokol公司的研究报告指出[10],他们在研究HBIW的工艺放大过程中考虑到乙腈的毒性,曾试图寻找新的反应介质,但未获成功。由于牵涉由简单小分子到复杂异伍兹烷笼形结构的反应,副反应多,目前HBIW的合成是CL-20合成工艺中收率最低的一步。为了防止催化剂中毒,精制步骤又会造成一定损失[11-13]。如何提高缩合收率,降低HBIW的合成成本,是降低CL-20生产成本的瓶颈技术之一。
为了解决此问题,北京理工大学系统地研究了HBIW的缩合制造工艺,通过综合措施[14-15]将乙醇法缩合收率提高到乙腈法缩合收率水平。从成本考虑,乙腈30 000元/t,乙醇5 000元/t,采用乙醇是合算的,另外乙醇的毒性远远低于乙腈的毒性。因此,这项成果不仅有利于降低原料成本,也利于溶剂回收,同时有助于改进操作环境。
1.2 CL-20的制造工艺路线
由HBIW出发,有多条路线可以合成CL-20,目前,CL-20的硝化前体已经超过15种[16],但实现千克级以上制造的,国内外只有3种,分别为TADB路线、TADF路线、TAIW路线,硝化前体均由HBIW通过氢解反应制得。
1.2.1 TADB路线
1995年,Bellamy发表了由HBIW经氢解乙酰化制备四乙酰基二苄基六氮杂异伍兹烷(TADB)、四乙酰基一乙基一苄基六氮杂异伍兹烷和四乙酰基二乙基六氮杂异伍兹烷的研究报告[17]。文章指出,适当提高反应温度、延长反应时间或增加催化剂Pd(OH)2/C用量均可提高产物得率。Bellamy称直接硝解TADB可以高产率制得CL-20(见图2),但没有给出具体硝解介质和相关工艺条件。

图2 TADB合成CL-20路线Fig.2 The synthesis of CL-20 from TADB
由于TADB仅需一次氢解即可得到,很多国家最初合成CL-20均采用此路线[18-19],近期伊朗、俄罗斯[20-23]等国还在进行相关研究。我国北京理工大学于永忠教授于1993年合成出TADB,经亚硝化、硝化,1994年6月合成出CL-20[24-25](见图3),与后来报道的Nielsen及法国等所用方法不谋而合。
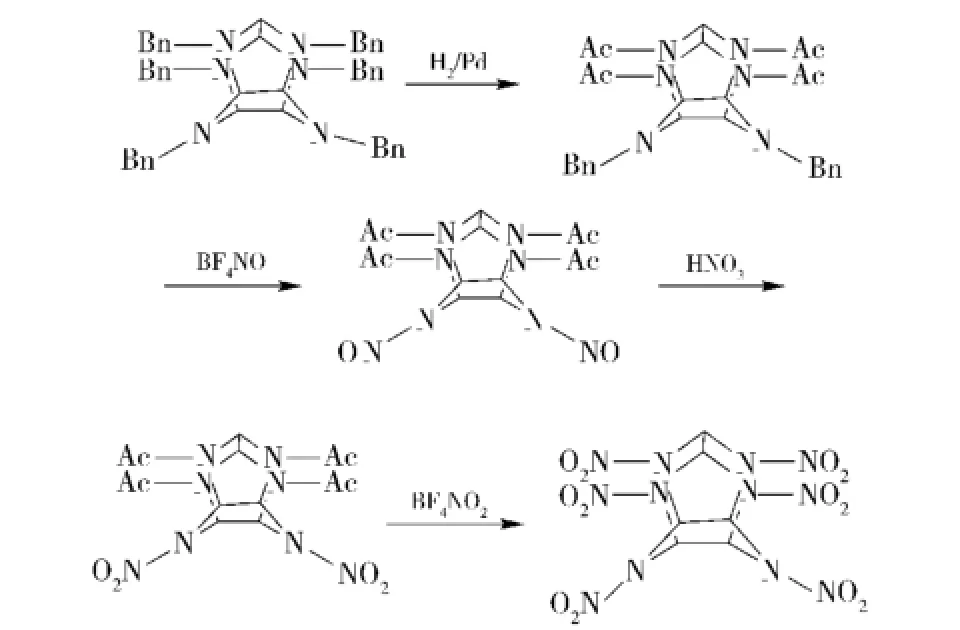
图3 TADB的亚硝化、硝化Fig.3 Nitration and nitrosation of TADB
世界各国对TADB的亚硝化、硝化工艺进行了系统研究,北京理工大学也开展了大量的工作[26-28]。但美、法等国在工程化实验中发现,此路线适合实验室研究而不适于工程化[29-31]。
1.2.2 TADF路线
1997年,Thiokol公司发表了CL-20中间体四乙酰基二甲酰基六氮杂异伍兹(TADF)等化合物合成的详细工艺条件[32-34]。该工艺在TADB合成中以溴苯为溴源并使用助溶剂二甲基甲酰胺(DMF)。DMF为Lewis碱,可中和反应介质中或反应过程中生成的酸,使介质保持较低酸性,减少反应底物的分解,并且大幅度增加HBIW在氢解介质中的溶解度,加速了氢解乙酰化的反应速度,减少HBIW在反应介质中的存在时间,阻滞破环现象发生。Thiokol公司的研究可使TADB的得率达到80%以上。TADB的进一步氢解可以在HCOOH、HCOOH/H2O、HCOOH/CH3OH三种介质中进行,并分别得到相应的氢解产物TADF、四乙酰基一甲酰基六氮杂异伍兹烷(TAFW)和六乙酰基六氮杂异伍兹烷(HAIW)。TADF在硝硫混酸中硝解,可以高产率制得目标产物CL-20.美国采用TADF制备的CL-20可达十数吨之多(见图4).由于甲酰基较乙酰基难以脱除,TADF硝化得到的CL-20产品中含有2%~3%的五硝基一甲酰基六氮杂异伍兹烷等杂质,影响了CL-20的爆轰和安全性能,因此2002年以后,美国已经放弃了此路线,但尚有一些国家,如伊朗[35]还在进行这条路线的研究工作。
1.2.3 TAIW路线
此路线为我国首创。1994北京理工大学赵信歧教授在醋酸介质中氢解TADB制得四乙酰基六氮杂异伍兹烷(TAIW),并经TAIW合成出CL-20[36](见图5).目前,世界上多数国家均采用TAIW路线进行CL-20的合成[37-41]。TAIW路线需使用贵金属钯进行两次氢解反应,因此制备高效钯催化剂并实现钯的循环使用是降低CL-20成本的关键技术。

图4 TADF合成CL-20路线Fig.4 The synthesis CL-20 from TADF

图5 TAIW合成CL-20路线Fig.5 The synthesis of CL-20 from TAIW
1.3 CL-20的转晶
ε-CL-20是最具实用价值的晶型,通常硝化后得到的是α-CL-20,γ-CL-20,或者二者的混合物,需通过转晶才能得到ε-CL-20.转晶单元通常收率很高,溶剂也可循环使用,避免了溶剂成本增加。控制成本的关键是在转晶过程中同时实现粒度小且均匀,增加炸药的填充度及形貌修饰,改善晶体质量。通常情况下,采用乙酸乙酯为溶剂,氯仿为非溶剂。氯仿对环境和人体危害较大,使用无氯的非溶剂体系,可使得CL-20转晶实现操作过程无污染和无毒。Johnston等[42]采用不同的工艺装置以乙酸乙酯为溶剂,选择无氯的非溶剂,如烷烃、芳香经等,进行重结晶,得到粒度小且均匀的微米级和纳米级晶体。Bescond等[43]以酯或酮为溶剂溶解CL-20,加入芳香烃等非溶剂,可获得10~100 μm的ε-CL-20晶体。Pourmortazavi等使用SAS technique制造纳米级的ε-CL-20晶体[44]。实现晶体的形貌主要靠添加不同的晶型控制剂改变晶体的生长特性,陈华雄等[45]通过加入晶体生长控制剂来改变晶体的生长特性,进而改变晶体的形貌。晶体形貌的改变可在一定程度上减少晶体缺陷,提高晶体质量,降低摩擦感度和撞击感度[46],降低了运输过程中的不安全因素,进而降低运输成本。
2 CL-20合成新工艺研究
如上所述,目前各国ε-CL-20工程化制备均采用由HBIW氢解再硝化的路线(见图6)。
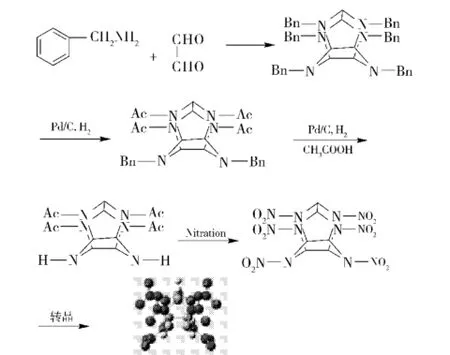
图6 ε-CL-20合成全路线Fig.6 The synthetic route of ε-CL-20
由于该路线苄胺原子经济性低、具有需用贵金属催化剂催化、路线长等特点,使得CL-20制造成本偏高。为了进一步降低CL-20的成本,各国都试图开发新的合成路线,主要包括无氢解法、两步法等。
2.1 无氢解法
采用无氢解法合成CL-20,不需要使用催化剂钯脱除HBIW上的苄基,从而节约了成本。日本旭化成工业株式会社的Kodama[47]在四氢呋喃、乙醚等有机溶剂中用氯甲酸三甲基硅乙基酯作用HBIW,得到相应的取代产物,但此反应需在惰性气体保护下进行生成的氯甲酸酯取代产物,在亚硝酸和硝酸的作用下得到CL-20(见图7).由于氯甲酸酯为剧毒物质且价格昂贵,使用该方法的CL-20合成成本远超氢解法,因此该方法没有得到实际应用。
美国军队研发中心的Surapaneni等[48]试图采用强路易斯酸催化HBIW实现无氢解脱苄,但由于HBIW在此反应条件下容易分解,未获得成功。北京理工大学采用氧化的方法脱除HBIW的苄基获得了成功,实现了CL-20的无氢解制造[49-57](见

图7 氯甲酸酯法合成CL-20路线Fig.7 The synthesis of CL-20 from chloroformate

图8 硝酸铈铵脱苄合成CL-20Fig.8 The synthesis of CL-20:oxidative debenzylationwith cerium(Ⅳ)ammonium nitrate
由于氧化反应副反应多,该方法的收率和纯度无法达到工程化生产要求,故不具备实用价值。
无氢解法的瓶颈在于HBIW在反应介质中稳定性差,且6个取代基的反应活性有较大差异,难以一次转换。
2.2 两步法
两步法试图合成其他异伍兹烷前体,然后直接硝化得到CL-20,从而降低成本,主要针对HBIW合成路线原子经济性低、路线长等问题。俄罗斯Sysolyatin等[59]报道了氨基磺酸盐与乙二醛缩合得到异伍兹烷笼型前体,然后硝化得到CL-20(见图9),但此路线收率太低,仅能在HPLC检测到中间体的痕迹。
2005年法国火炸药公司Cagnon等申请的一项美国专利[60-62],用芳杂环基甲胺或烯丙胺与乙二醛缩和得到六取代的六氮杂异伍兹烷(见图10),然后直接硝化得到CL-20。但该方法得到的CL-20含量极少,甚至未能将其分离出来,因此不具有应用价值。

图9 两步法合成CL-20路线Fig.9 The two step synthetic route of CL-20
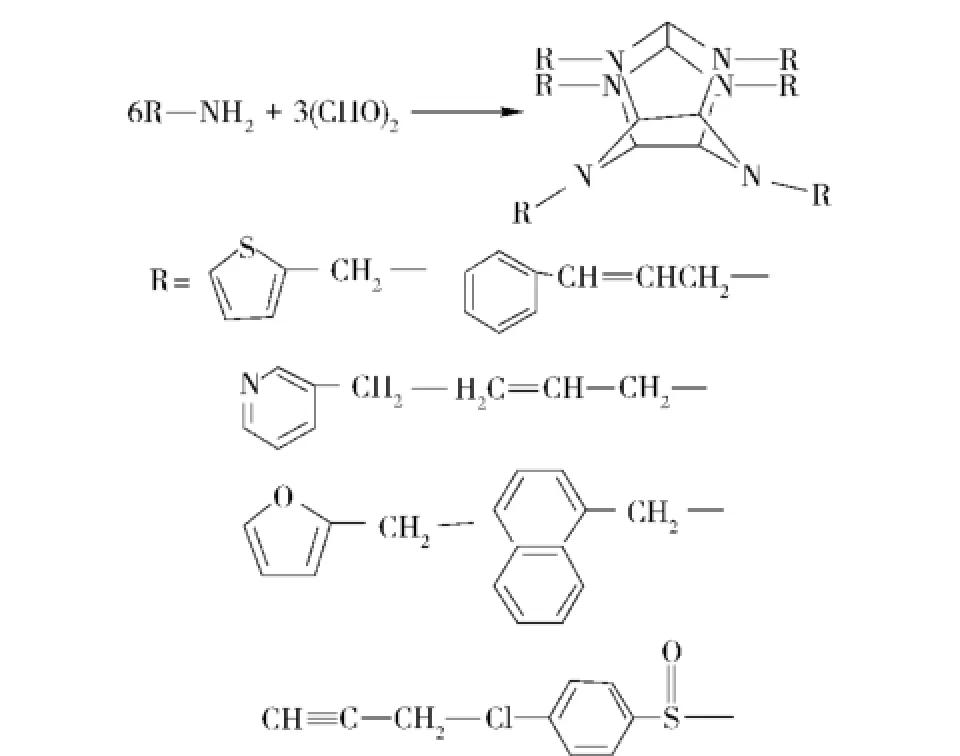
图10 新型异伍兹烷前体合成Fig.10 The synthesis of new isosowurtzitane precursor
此后,美国Chapman等[61]在上述方法的基础上,采用光催化或者氧化的方法,使六烯丙基六氮杂异伍兹烷异构化[63],再进行硝化得到CL-20(见图11),收率有所提高,但仍较实用有很大距离,而且这条路线已经变成4步,失去了两步法的意义。伊朗、波兰等国也开展了相关研究,但基本上属于跟踪仿研,没有实质进展[64]。北京理工大学也开展了两步法的研究[65-66],合成了很多新型异伍兹烷衍生物[67-68]与国际同步,但也没有取得有工程化实用价值的突破。
两步法的瓶颈在于新型异伍兹烷前体及其硝化产率都很低,这是由醛胺缩合反应本身的特点和异伍兹烷分子笼形结构所决定的。
大量研究表明,苄胺等富电子取代胺适于和乙二醛反应生成异伍兹烷母体,但合成得到的新前体的稳定性也与HBIW相似,难以直接硝化,而酰基等缺电子取代胺难以发生此缩合反应。

图11 六烯丙基六氮杂异伍兹烷合成CL-20路线Fig.11 The synthesis of CL-20 from HAllylIW
CL-20的新合成工艺研究都遇到了收率低、副反应多等瓶颈,而异伍兹烷笼形立体结构易破裂的特点使得温和的催化氢解成为必然选择。新工艺瓶颈的突破有赖于化学新原理、新方法的突破,如新的廉价、高效氢解催化剂的出现,或温和硝化反应等的发现,都有利于催生全新的CL-20合成路线,但这些突破非短期可以获得,HBIW路线仍然是目前唯一可行的工程化路线。
3 结论与展望
综上所述,世界各国围绕CL-20的合成与制造开展了大量工作,实现了CL-20的工程化制造,逐步降低了CL-20的制造成本,相关研究也促进了笼型化合物研究,但与传统含能化合物RDX、HMX等相比,CL-20的制造成本仍然偏高。综合目前CL-20传统合成工艺和新合成工艺的研究情况,得到以下结论:
1)传统的CL-20工艺比较成熟,但是合成路线原子经济性低,反应路线比较长,缩合收率低,所以发展重点在于结合相关实验优化工艺,提高各单元收率,并对现有工程化工艺进行局部改造,如在现有的HBIW氢解过程中寻求更廉价高效的新型催化剂,或者尝试使用非钯催化方法脱除HBIW的苄基,以节约成本,进一步降低原材料消耗,降低成本。
2)新CL-20合成工艺中存在新型异伍兹烷前体合成及其硝化产率都很低,副反应多,异伍兹烷笼形立体结构易破裂等问题,所以坚持探索原子经济性高的CL-20合成工艺路线,如合成新的异伍兹烷前体,缩合得到硝基异伍兹烷化合物,然后直接硝化得到CL-20,或者从化学新原理、新反应入手,开发温和、高效、价廉的新试剂,探索革命性的新型CL-20合成路线。
References)
[1] Nielsen A T,et al.NWC-TP-8020[R].US:NWC,1989.
[2] Olah G A,Squire D R.Chemistry of energetic materials[M]. London:Academic Press,1991.
[3] Bourasseau S A.A systematic procedure for estimating the standard heats of formation in the condensed state of nonaromatic polynitro compounds[J].Journal of Energetic Materials,1990,8(5): 411-416.
[4] Nielsen A T,Nissan R A,Vanderah D J.Polyazapolycyclics by condensation of aldehydes with amines.2.formation of 2,4,6,8, 10,12-hexabenzyl-2,4,6,8,10,12-hexaazatetracyclo[5.5.0.05, 9.03,11]dodecanes from glyoxal and benzylamines[J].Jounal of Organic Chemistry,1990,55(5):1459-1466.
[5] Nielsen A T.Caged polynitramine compound:US,US5693794A [P].1997-12-02.
[6] Norris W P,Nielsen A T.Catalitic synthesis of caged polynitramine compounds:US,US8017768[P].2011-09-13.
[7] Crampton M R,Hamid J.Studies of the synthesis,protonation and decomposition of 2,4,6,8,10,12-hexabenzyl-2,4,6,8,10, 12-hexaazatetracyclo-[5.5.0.05,9.03,11]dodecanes(HBIW) [J].Jounal of the Chemical Society,Perkin Transaction,1993 (5):923-929.
[8] Chapman R D.Hollins R A.Processes for preparing certain hexaazaisowurtzitanes and their use in preparing hexanitrohexaazaisowurtzitane:US,US7875714B1[P].2011-07-25.
[9] Wardle R B,Hinshaw J C,Braithwaite P,et al.Synthesis of the caged nitramine HNIW(CL-20)[C]∥Proceedings of 27th International Annual Conference of ICT.Karlsruhe,Germany:Fraunhofer Institut fur Chemische Technologie,1996:27/1-27/10.
[10] Cannizzo L F,Edwards W W,Highsmith T K,et al.Synthesis of 2,4,6,8,10,12-hexabenzyl-2,4,6,8,10,12-hexaazatetracyclo [5.5.0.05,9.03,11]dodecane:US,US5723604A[P].1998-03-03.
[11] Edwards W W,Cannizzo F L,Highsmith T K,Wardle R B.Improved synthesis of 2,4,6,8,10,12-hexabenzyl-2,4,6,8,10,12-hexaazatetracyclo[5.5.0.05,9.03,11]:Canada,CA2224642 A1[P].1997-01-09.
[12] 郑福平.六苄基六氮杂异伍兹烷的制备及氢解脱苄[D].北京:北京理工大学,1999.
ZHENG Fu-ping.Synthesis and hydrogrnolysis debenzylation of hexabenzylhexaazaisowurtzitane[D].Beijing:Beijing Institute of Technology,1999.(in Chinese)
[13] 欧育湘,徐永江,刘利华,等.乙腈法与乙醇法合成六苄基六氮杂异伍兹烷的比较[J].含能材料,1999,7(4):152-155.
OU Yu-xiang,XU Yong-jiang,LIU Li-hua,et al.Comparison of acetonitrile process with ethanol process of Hexabenzylhexaazaisowurtzitane[J].Jouanl of Energetic Masterals,1999,7(4):152 -155.(in Chinese)
[14] 王红平,孙成辉,宋建伟,等.一锅法合成六苄基六氮杂异伍兹烷[J].含能材料,2007,15(5):560. WANG Hong-ping,SUN Cheng-hui,SONG Jian-wei,et al. One-pot synthesis of hexabenzylhexaazaisowurtzitane(HBIW) [J].Jounal of Energetic Materials,2007,15(5):560.(in Chinese)
[15] 赵信岐,杨宗云,李双立.六苄基六氮杂异伍兹烷制备工艺改进[J].北京理工大学学报,1996,16(2):72.
ZHAO Xin-qi,YANG Zong-yun,LI Shuang-li.Process for preparing hexabenzylhexaazaisowurtzitane[J].Transactions of Beijing Institute of Technology,1996,16(2):72.(in Chinese)
[16] 公绪滨,孙成辉,庞思平,等.异伍兹烷衍生物的研究进展[J].有机化学,2012,32(3):486-496. GONG Xu-bin,SUN Cheng-hui,PANG Si-ping,et al.Research progress in study of isowurtzitane derivatives[J].Chinese Journal of Organic Chemistry,2012,32(3):486-496.(in Chinese)
[17] Bellamy A J.Reductive debenzylation of hexabenzylhexaazaisowurtzitane[J].Tetrahedron,1995,51(16):4711-4715.
[18] Duddu R,Dave P R.Process and composition for nitration of NNitric acid at elevated temperatures to form HNIW and recovery of gamma HNIW:US,US6160113[P].2000-12-12.
[19] Simpson R L,Lee R S,Tillotson T M,Hrubesh LW,et al. Process for preparing energetic materials:US,US8075716B1 [P].2011-12-13.
[20] Mandal A K,Pant C S,Kasar S M,et al.Process optimization for synthesis of CL-20[J].Journal of Energetic Materials,2009, 27(4):231-246.
[21] Bayat Y,Hajimirsadeghi S S,Pourmortazavi S M.Statistical optimization of reaction parameters for the synthesis of 2,4,6,8,10, 12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane[J].Organic Process Research&Development,2011,15(4):810-816.
[22] Koskin A P,Simakova I L,Parmon V N.Reductive debenzylation of hexabenzyl-hexaazaisowurtzitane-the key step of the synthesis of polycyclic nitramine hexanitro-hexaazaisowurtzitane[J]. Russian Chemical Bulletin,2007,56(12):2370-2375.
[23] Maksimowski P,Fabijańska A.Tetraacetyl-dibenzyl-hexaazaisowurtzitane nitrosation-studies on scale-up synthesis of HNIW[J].Propellants,Explosives,Pyrotechnics,2010,35(4):353-358.
[24] 管晓培,笼形化合物的合成[D],北京:北京理工大学, 1993.
GUAN Xiao-pei.Synthesis of cage compounds[D].Beijing: Beijing Institute of Technology,1993.(in Chinese)
[25] 于永忠,管晓培.六硝基六氮杂异伍兹烷的合成研究[J].含能材料,1999,7(1):1-4.
YU Yong-zhong,GUAN Xiao-pei.Studies on the synthesis of Hexanitrohexaazaisowurtzitane[J].Chinese Jounal of Energetic Masterials,1999,7(1):1-4.(in Chinese)
[26] 吕连营,欧育湘,王建龙,等.四乙酰基二苄基六氮杂异伍兹烷亚硝解脱苄反应[J].火炸药学报,2003,26(4):41-43.
LYU Lian-ying,OU Yu-xiang,WANG Jian-long,et al.Nitrosolysis-debenzylation to tetraacetyldibenzyl hexaazaisowurtzitane[J].Chinese Jounal of Explosives&Propellants,2003,26 (4):41-43.(in Chinese)
[27] 吕连营,欧育湘,王建龙.四乙酰基二亚硝基六氮杂异伍兹烷水合物(TADNIW·H2O)的合成与晶体结构[J].有机化学, 2005,25(4):399-404.
LYU Lian-ying,OU Yu-xiang,WANG Jian-long.Synthesis and crystal Strucutre of tetraacetyldinitrosohexaazaisowurtzitane(TADNIW·H2O)[J].Chinese Jounal of Organic Chemistry,2005, 25(4):399-404.(in Chinese)
[28] LYU Lian-ying,OU Yu-xiang,WANG Jian-long.Nitrosation and nitration of tetraacetyldibenzy-hexaaaisowurtzitar[J].Journal of China Ordnance,2005,1(1):57-60.
[29] Agrawal J P.High energetic.materials[M].India:Former Director of Materials Defence R&D Organization,2010.
[30] Bayat Y,Hajimirsadeghi S S,Pourmortazavi S M.Statistical optimization of reaction parameters for the synthesis of 2,4,6,8,10, 12-Hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane[J].Organic Process Research&Development,2011,15(4):810-816.
[31] Latypov N V,Wellmar U,Goede P.Synthesis and scale-up of 2, 4,6,8,10,12-Hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane from 2,6,8,12-tetraacetyl-4,10-dibenzyl-2,4,6,8,10,12-hexaazaisowurtzitane(HNIW,CL-20)[J].Organic Process Research&Development,2000,3(4):156-158.
[32] Wardle R B,Edwards W W.Improved hydrogenolysis of 2,4,6, 8,10,12-hexabenzyl-2,4,6,8,10,12-hexaazatetracyclo[5.5.0. 05,9.03,11]dodecane:World Intellectual Property Organization, WO9720785A1[P].1997-06-12.
[33] Bazaki H,Kawabe S,Miya H.Synthesis and sensitivity of hexanitrohexaazaisowurzitane(HNIW)[J].Propellants,Explosive, Pyrotechnics,1998,23(6):333-336.
[34] 欧育湘,徐永江,陈博仁,等.由四乙酰基二甲酰基六氮杂异伍兹烷合成六硝基六氮杂异伍兹烷[J].有机化学,2000, 20(4):556-559.
OU Yu-xiang,XU Yong-jiang,CHEN Bo-ren,et al.Synthesis of hexanitrohexaazaisowurtzitaneformtetraacetyldiformylhexaazaisowurtzitane[J].Chinese Journal of Organic Chemistry,2000, 20(4):556-559.(in Chinese)
[35] Yadollah B,Heshmat E,Farshad F F.Optimization of reductive debenzylation of Hexabenzylhexaazaisowurtzitane(the Key Step for Synthesis of HNIW)using response surface methodology[J]. Organic Process Research&Development,2012,16(11): 1733-1738.
[36] 赵信歧,倪承志.六硝基六氮杂异伍兹烷的晶型结构[J].科学通报,1995,40(23),2158-2160.
ZHAO Xin-qi,NI Cheng-zhi.Crystal structure of γ-hexanitrohexaazaisowurtzitane[J].ChineseScienceBulletin,1995, 40(23):2158-2160.(in Chinese)
[37] Renganathan S,Gore G M,Nair U R,et al.Process for preparation of tetraacetyl hexaazaisowurtzitane(TAIW)and its nitration tohexanitro-hexaazaisowutzitane(CL-20):India,IN2007 DE00577A[P].2008-09-26.
[38] Mandal A K,Pant C S,Kasar S M,et al.Process optimization for synthesis of CL-20[J].Journal of Energetic Materials,2009, 27(4):231-246.
[39] Bayat Y,Mokhtari J.Preparation of 2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane from 2,6,8,12-tetraacetyl-2,4,6,8,12-hexaazaisowurtzitane using various nitrating agents [J].Defence Science Journal,2011,61(2):171-173.
[40] Bayat Y,Mokhtari J,Farhadian N,et al.An efficient catalyst for synthesis of CL-20[J].Journal of Energetic Materials,2012, 30(2):124-134.
[41] Sanderson A J,Warner K,Wardle R B.Process for making for making 2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazatetracyclo[5.5.0.05,903,11]dodecane:US,US6391130B1[P]. 2002-05-21.
[42] Johnston H E,Wardle R B.Process of crystallizing 2,4,6,8, 10,12-hexanitro-2,4,6,8,10,12-hexaazatetracyclo[5.5.0.05, 903,11]dodecane:US,US5874574[P].1999-02-23.
[43] Bescond P,Graindorge H,Mace H.Process for producing the epsilon polymorphic form of hexanitro-hexaazaisowurtzitane:US, US5973149[P].1999-10-26.
[44] Bayat Y,Pourmortazavi S M,Ahadi H.Taguchi robust design to optimize supercritical carbon dioxide anti-solvent process for preparation of 2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane nanoparticles[J].Chemical Engineering Journal, 2013,230(15):432-438.
[45] CHEN Hua-xiong,CHEN Shu-sen,JIN Shao-hua.Effects of additives on ε-HNIW crystal morphology and impact sensitivity[J]. Propellants,Explosives,Pyrotechnics,2012,37(1):77-82.
[46] Elbeih Mohamed A I,Adela H,et al.Process for preparing{epsilon}-2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane with reduced impact sensitivity:Czech Republic, CZ303686B6[P].2013-03-06.
[47] Kodama T.Preparation of hexakis(trimethylsilylethylcarbamyl)-hexaazaisowurtzitane:Japan,JP06321962[P],1994-11-22.
[48] Surapaneni R,Damavarapu R.Process improvements in CL-20 manufacture[C]∥31th International Annual Conference of ICT on Energetic Materials.Karlsruhe,Germany:Fraunhofer Institut fur Chemische Technologie,2000:108/1-108/4.
[49] LI Ya-yu,WANG Lin,PANG Si-ping,et al.Studies of the oxidation of hexabenzyl hexaazaisowurtzitane[J].Journal of Beijing Institute of Technology,2010,19(4):476-479.
[50] 庞思平,于永忠,赵信岐.相转移催化氧化六苄基六氮杂异伍兹烷[J].兵工学报,2002,23(2):276-278.
PANG Si-ping,YU Yong-zhong,ZHAO Xin-qi.Phase transfer catalyze the oxidation of Hexabenzyl-hexaazaisowutaitane[J]. Acta Armamentarii,2002,23(2):276-278.(in Chinese)
[51] 庞思平,于永忠,赵信岐.相转移催化硝化四乙酰基二苄基六氮杂异伍兹烷[J].含能材料,2003,11(4):222-223.
PANG Si-ping,YU Yong-zhong,ZHAO Xin-qi.Nitration of tetraacetyldibenzylhexaazaisowutzitane with phase transfer catalysts [J].Chinese Journal of Energetic Materials,2003,11(4): 222-223.(in Chinese)
[52] QIU Wen-ge,CHEN Shu-sen,YU Yong-zhong.Oxidation of N-benzyl groups[J].Chinese Journal of Chemistry,2000,18(5): 756-758.
[53] QIU Wen-ge,CHEN Shu-sen,YU Yong-zhong.Oxidation of hexabenzylhexaazaisowurtzitane[J].Chinese Journal of Chemistry,1999,17(5):554-556.
[54] QIU Wen-ge,CHEN Shu-sen,YU Yong-zhong.The crystal structure of hexabenzoyl-hexaazaisowurtzitane[J].Journal of Chemical Crystallography,1998,28(8):593-596.
[55] PANG Si-ping,YU Yong-zhong,ZHAO Xin-qi.A novel synthetic route to hexanitro hexaazaiso-wurtzitane[J].Propellants,Explosives,Pyrotechnics,2005,30(6):442-444.
[56] 庞思平,于永忠,赵信岐.氧化法合成六硝基六氮杂异伍兹烷[J].火炸药学报,2004,27(1):9-11.
PANG Si-ping,YU Yong-zhong,ZHAO Xin-qi.The synthesis of hexanitrohexaazaisowutzitane by oxidation[J].Chinese Journal of Explosives&Propellants,2004,27(1):9-11.(in Chinese)
[57] Gore G M,Sivabalan R,Nair U R,et al.Synthesis of CL-20: by oxidative debenzylation with cerium(Ⅳ)ammonium nitrate (CAN)[J].Indian Journal of Chemistry,Section B:Organic Chemistry Including Medicinal Chemistry,2007,46B(3):505-508.
[58] Sysolyatin S V,Lobanova A A,Chernikova Y T,et al.Method of synthesis and properties of hexanitrohexaazaisowurtzitane[J]. Russian Chemical Reviews,2005,74(8):757-764.
[59] Cagnon G,Eck G,Herve G,et al.Process for the 2-stage synthesis of hexanitrohexaazaiso wurtzitane starting from a primary amine:US,US20040260086A1[P].2004-12-23.
[60] Chapman R D,Hollins R A.Benzylamine-free,heavy-metal-free synthesis of CL-20 via hexa(1-propenyl)hexaazaisowurtzitane
[J].Journal of Energetic Materials,2008,26(4):246-273.
[61] Chapman R D.Processes for preparing cartain hexaazaisowurtzitanes and their use in preparing hexanitrohexaazaisowurtzitane: US,US8268993B1[P].2012-09-18.
[62] Herve G,Jacob G,Gallo R.Preparation and structure of novel hexaazaisowurtzitane cages[J].Chemistry-A European Journal, 2006,12(12):3339-3344.
[63] Dziura R,Maciej D,Wincenty S,et al.Process for the manufacture of 2,4,6,8,10,12-hexanitro-2,4,6,8,10,12-hexaazaisowurtzitane by two-step nitration:Poland,PL209496B1[P]. 2011-09-30.
[64] 李新乐,孙成辉,赵信岐,等.六烯丙基六氮杂异伍兹烷的合成[J].含能材料,2007,15(5),490-492.
LI Xin-le,SUN Cheng-hui,ZHAO Xin-qi,et al.Synthesis of hexaallylhexaazaisowurtzitane[J].Jounal of Energetic Materials, 2007,15(5):490-492.(in Chinese)
[66] 祁磊.异伍兹烷保护基团转换研究[D].北京:北京理工大学,2009.
QI Lei.Study of isowurtzitane of protective group transformation [D].Beijing:Beijing Institute of Technology,2009.(in Chinese)
[66] 李翠.HNIW的新合成工艺研究[D].北京:北京理工大学, 2007.
LI Cui.The synthesis of hexaazaisowurtzitane[D]Beijing:Beijing Institute of Technology,2007.(in Chinese)
[67] II'yasov S G,Chikina M V.A novel approach for the synthesis of hexaazaisowurtzitane derivatives[J].Tetrahedron Letters,2013, 54(15):1931-1932.
[68] DONG Kai,SUN Cheng-hui,PANG Si-ping,et al.Formyl azido substituted nitro hexaazaisowurtzitane-synthesis,characterization and energetic properties[J].New Journal of Chemistry,2013, 37(11):3685-3691.
Research Progress in Synthesis of Hexanitrohexaazaisowurtzitane
PANG Si-ping1,SHEN Fan-fan2,LYU PENG-hao1,DONG Kai1,ZHANG Yi-ying1,
SUN Cheng-hui1,SONG Jian-wei3,ZHAO Xin-qi1
(1.School of Material Science and Engineering,Beijing Institute of Technology,Beijing 100081,China;
2.School of Life Science,Beijing Institute of Technology,Beijing 100081,China;
3.Liaoning Qingyang Special Chemical Corporation,Liaoyang 111002,Liaoning,China)
The progress in synthesis and engineering manufacture of high energy and density compound hexanitro-hexaazaisowurtzitane(HNIW or CL-20)is reviewed.The advantages,drawbacks and applications of three main approaches to the engineering manufacture of CL-20 based on hexabenzylhexaazaisowurtzitane(HBIW)intermediate are discussed,the difficulty in developing new synthetic routes for CL-20 is also analyzed.The result shows that the synthesis and nitration efficiencies of the new isosowurtzitane precursor are low,and its cage-dimensional structure is easily broken.The developing tends on lowering CL-20 production cost is to seek new efficient catalysts and explore new synthesis routes.
ordnance science and technology;CL- 20;HBIW;synthesis;engineering manufacture
TJ45
:A
1000-1093(2014)05-0725-08
10.3969/j.issn.1000-1093.2014.05.022
2013-09-26
北京理工大学爆炸科学与技术国家重点实验室自主课题(ZDKT12-03)
庞思平(1973—),男,教授,博士生导师。E-mail:pangsp@bit.edu.cn;申帆帆(1985—),女,博士研究生。E-mail:shenfanfan666@163.com

