头孢氨苄胃漂浮微丸的制备与体外评价
李卫民,熊 炜,潘卫三,叶田田,荆恒攀,杨星钢,*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016;2.浙江工业大学 药学院 浙江 杭州 310014)
头孢氨苄胃漂浮微丸的制备与体外评价
李卫民1,熊 炜1,潘卫三1,叶田田1,荆恒攀2,杨星钢1,*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016;2.浙江工业大学 药学院 浙江 杭州 310014)
目的制备头孢氨苄胃漂浮微丸,使药物在胃中缓慢释放,降低毒性及不良反应,延长药物在胃中的滞留时间,提高其生物利用度。方法 采用挤出滚圆法制备头孢氨苄载药丸心,用Eudragit®NE-30D水分散体为控释层包衣材料,NaHCO3和HPMC E5为产气层,Eudragit®RL-30D水分散体为气体阻滞层,以流化床包衣的方法进行包衣操作制备头孢氨苄胃漂浮微丸,并考察各包衣层处方组成、包衣增重对微丸体外漂浮性质,释药特性的影响,筛选出最优处方。结果 控释层材料的包衣增重对药物的释放有显著的影响,产气层的增质量以及组成和气体阻滞层增重对微丸的起漂时间和持续漂浮时间都有影响。结论 所制备的头孢氨苄胃漂浮微丸,具有良好的胃漂浮特性和零级释药特征。
胃漂浮微丸;产气;挤出滚圆法;流化床包衣法;头孢氨苄
头孢氨苄(cepH值alexin)为第一代头孢菌素类抗生素药,主要用于葡萄球菌、链球菌、肺炎球菌、大肠杆菌等的感染,因其疗效确切、价格低廉,临床应用非常广泛,但其半衰期短,仅为(0.97± 0.53) h[1]。目前国内应用的主要是普通制剂,每天给药4次,血药浓度波动范围大,长期服药不良反应较多,制备服用次数少、生物利用度高的缓释口服制剂,可以很好的解决这些问题且提高患者服药的顺应性[2]。头孢氨苄主要在胃肠道的上端吸收,在酸中稳定,而在小肠碱性环境中不稳定,易分解,延长药物在肠道上段的吸收时间,可达到提高生物利用度的目的[3]。将头孢氨苄制成胃漂浮微丸可以延长药物在胃中的滞留时间,同时微丸是多单元给药系统,与片剂、胶囊剂相比,体内吸收的个体间差异性小,吸收动力学重现性好;生物利用度高,胃肠道的刺激性小;将不同释放速率的微丸组合在一起可得到理想的释药速率,达到预期的血药浓度,取得理想的疗效[4]。根据胃漂浮机制的不同,胃漂浮系统分为泡腾型和非泡腾型两种,泡腾型漂浮系统为处方中的产气物质和胃酸起反应,产生CO2气体,使制剂的密度小于1.0 g•cm-3,从而使其漂浮于胃液之上[5],本文作者使用NaHCO3做为产气物质,再结合控释膜和气体阻滞层,使微丸能能够快速起漂和漂浮时间大于12 h的同时,也能缓慢的释放药物。
1 仪器与材料
E50-S250挤出滚圆机(重庆英格包衣技术有限公司),BT100-02恒流泵(保定齐力恒流泵有限公司),小型流化床包衣机(自制),Rcz-6B药物溶出测定仪(上海黄海药检仪器厂),LC-10AT VP高效液相色谱仪(日本Shimadzu有限公司),UV-9100紫外分光光度仪(北京瑞利分析仪器有限公司)。
头孢氨苄原料药(山东淄博新华肯孚制药有限公司,批号:521103-00040),微晶纤维素 PH-101(美国FMC Biopolymer有限公司),Eudragit®NE-30D水分散体、Eudragit®RL-30D水分散体(赢创有限公司),羟丙甲纤维素、聚乙烯丙咯烷酮(PVP k30,上海卡乐康有限公司),低取代羟丙纤维素(L--HPC,湖州展望药业),十八醇、NaHCO3、邻苯二甲酸二乙酯(天津博迪化工有限公司),PEG6000(天津科密欧化学试剂有限公司),甲醇(色谱纯,天津市康科德科技有限公司),其他试剂(分析纯,市售)。
2 方法与结果
2.1 头孢氨苄胃漂浮微丸的设计
如图1所示,胃漂浮微丸由载药丸心和分别包在载药丸心上连续的几层膜组成,其包衣顺序为:首先在载药丸心上包上一层控释膜,然后包上一层产气层,最后包上一层气体阻滞层。由于NaHCO3自身没有黏性,所以用HPMC作为黏合剂和NaHCO3一起做为产气层包在控释膜上,为了使产气层快速反应,从而使微丸能够快速的起漂,理想的胃漂浮包衣材料应该是水渗透性高的材料,但同时,水化的气体阻滞层包衣材料不能透过CO2气体并且能够长时间的拥有较强的机械强度以防由于CO2气体产生的压力将气体阻滞层胀破,包衣材料只有同时具有以上两个特点,才能长时间使微丸维持漂浮状态。Krogel和 Bodmeier[6]报道纤维素类高分子不适合做为胃漂浮材料,原因是醋酸纤维素较脆,当接触释放介质水化时不能充分的伸展,而乙基纤维素弹性较弱,当产生CO2气体时很容易破裂,气体很快逸出。Eudragit®NE-30D和Eudragit®RS-30D水渗透性较差,不能使释放介质透过它们与产气层快速反应,产生足够的CO2气体使微丸漂浮。Eudragit®RL-30D是一种高渗透性的材料,同时能够在水化状态下充分的膨胀,因此它是一种理想的气体阻滞层材料。由于头孢氨苄在pH值1.2的盐酸溶液中溶解度大,而且Eudragit®RL-30D膜的透过性也大,从而使Eudragit®RL-30D膜不能很好的控制药物在释放介质中的释放,所以有必要在载药丸心外面包一层控释膜来控制头孢氨苄的释放,而Eudragit®NE-30D膜渗透性较低,能够很好的控制药物的释放,所以Eudragit®NE-30D水分散体是一种理想的控释层包衣材料。
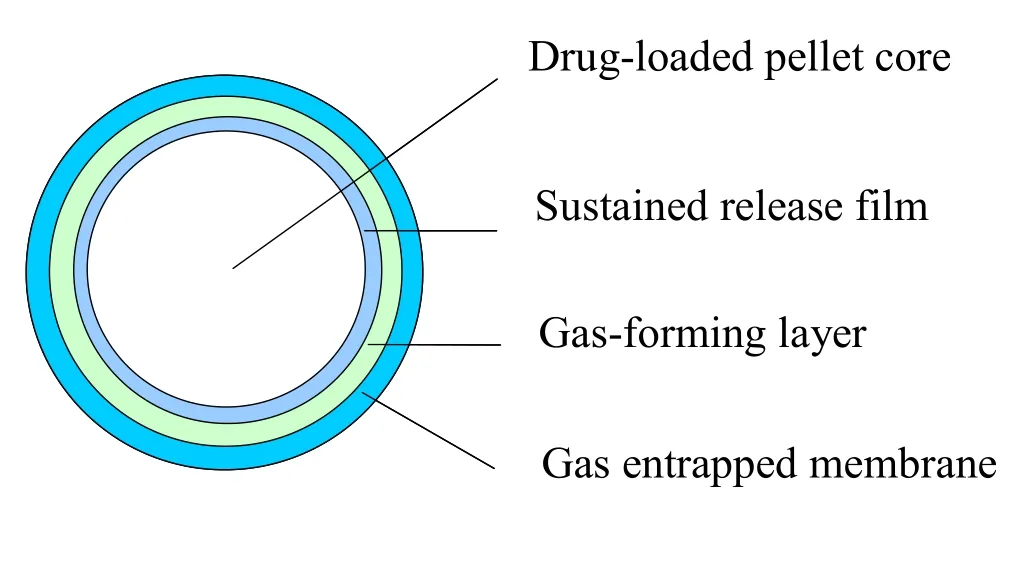
图 1 胃漂浮微丸的结构Fig. 1 Structure of the gastric floating pellets
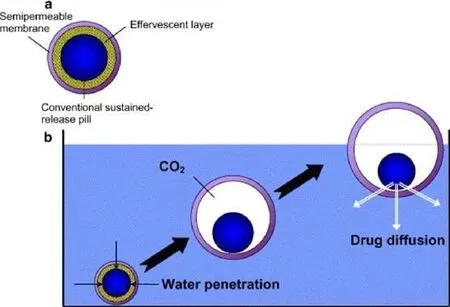
图 2 微丸在释放介质中的漂浮过程和机理Fig. 2 Floating process and mechanism of the pellets
2.2 微丸的漂浮过程和释药机制
头孢氨苄胃漂浮微丸在溶出介质中漂浮和释药机制的大致过程如图2所示:首先盐酸溶液通过半透膜气体阻滞层Eudragit®RL-30D,介质中的盐酸与产气物质NaHCO3发生中和反应,释放CO2气体被气体阻滞层Eudragit®RL-30D包裹在微丸里,当微丸的密度小于释放介质时,微丸开始起漂,并能长时间在释放介质上维持漂浮状态,漂浮过程中,溶解出来的药物缓慢的通过控释膜释放到介质中。
2.3 分析方法的建立
2.3.1 紫外分析方法的建立
2.3.1.1 对照溶液的制备
精密称取头孢氨苄原料药约100 mg,置100 mL容量瓶中,用pH值1.2的稀盐酸溶液超声溶解,冷却后定容并混合均匀,做为对照储备液。
2.3.1.2 标准曲线的绘制
分别从储备液中精密量取4.5、4.0、3.0、2.0、1.0、0.5 和0.2 mL置于10 mL容量瓶中,用pH值1.2的稀盐酸溶液稀释至刻度,配制成质量浓度为450、400、300、200、100、50和20 mg• L-1的系列溶液,混合均匀。在262 nm处用1 mm比色皿测定吸光值A,将A与质量浓度ρ(mg•L-1)做线性回归,得线性回归方程为A= 1.9×10-3ρ+ 1.2×10-3(r=0.999 9),结果表明头孢氨苄溶液在20~450 mg•L-1内线性关系良好。
2.3.1.3 精密度测定
配制高、中、低质量浓度分别为450、200和20 mg• L-1头孢氨苄溶液,照紫外分光光度法分别于日内重复测定3次,并连续测定3 d,代入当天的标准曲线,求算日内、日间相对标准偏差。结果此方法日内、日间精密度的相对标准偏差均小于2. 0%,精密度符合体外分析方法要求。
2.3.1.4 回收率试验
精密称取头孢氨苄对照品共9份,以释放介质配制对照溶液,加入相应浓度的辅料,配成450、200和20 mg• L-1高、中、低3个质量浓度各3份的头孢氨苄溶液,分别在262 nm处用1 mm比色皿测定其吸光度,以测得值除以实际值计算平均回收率,回收率为96.1%,RSD为0.6%。结果表明本方法回收率良好。
2.3.1.5 样品稳定性考察
取头孢氨苄质量浓度为450、400、300、200、100、50和20 mg• L-1的系列溶液,在室温下放置,分别在0、1、2、4、6、8和12 h测定其吸光度,计算RSD为0.7%,结果表明:头孢氨苄在pH值 1.2的稀盐酸溶液中12 h内稳定。
2.3.2 含量测定方法学的建立
2.3.2.1 色谱条件
头孢氨苄胃漂浮微丸的含量通过LC-10AT VP高效液相色谱仪测定, HPLC系统含有LC-AT泵和SPD-10A紫外可见光检测器,色谱条件具体如下。
色谱柱:Diamonsil C18色谱柱(200 mm×4.6 mm,5 μm,迪马公司),流动相:水-甲醇- 3.86%(w)醋酸钠溶液-4%(w)冰醋酸(体积比为742∶240∶15∶3),柱温:25 ℃,检测波长:254 nm,流速:1.0 mL•min-1,进样量:20 µL。
2.3.2.2 对照溶液的制备
精密称取头孢氨苄原料药约100 mg,置100 mL容量瓶中,用流动相超声溶解,冷却后定容并混合均匀,做为对照储备液。
2.3.2.3 标准曲线的绘制
分别从储备液中精密量取4.5、4.0、3.0、2.0、1.0、0.5和0.2 mL置于10 mL容量瓶中,用流动相稀释至刻度,配制成质量浓度为450、400、300、200、100、50和20 mg•L-1的系列溶液,混合均匀,照“2.3.2.1”条方法进行HPLC分析,记录色谱图,将峰面积A与质量浓度ρ(mg•L-1)做线性回归,测得线性回归方程为A=248 39ρ +261 6(r=0.999 9),结果表明头孢氨苄溶液在20~450 mg•L-1内线性关系良好。
2.3.2.4 精密度测定
配制高、中、低质量浓度分别为450、200和20 mg•L-1头孢氨苄溶液,照“2.3.2.1”条方法进行HPLC分析,记录色谱图,按外标校正曲线法计算含量,分别于日内重复测定3次,并连续测定3天求算日内、日间相对标准偏差。结果此方法日内、日间精密度的相对标准偏差均小于1.2%,精密度符合体外分析方法要求。
2.3.2.5 回收率试验
精密称取头孢氨苄对照品共9份,以流动相配制对照溶液,加入相应浓度的辅料,配成450、200和20 mg•L-1高、中、低3个质量浓度各3份的头孢氨苄溶液,照“2.3.2.1”条方法进行HPLC分析,记录色谱图,按外标校正曲线法计算含量,计算平均回收率,回收率为99.6%,RSD为0.5%。结果表明本方法回收率良好。
2.3.2.6 样品稳定性考察
取头孢氨苄质量浓度为450、400、300、200、100、50和20 mg•L-1的系列溶液,在室温下放置,分别在0、1、2、4、6、8和12 h,照“2.3.2.1”条方法进行HPLC分析,记录色谱图,按外标校正曲线法计算含量,计算RSD为1.1%,结果表明:头孢氨苄在pH值1.2的稀盐酸溶液中12 h内稳定。
2.3.2.7 微丸含量测定
取头孢氨苄胃漂浮微丸约1 000 mg,研成细粉。精密称取细粉适量(约含头孢氨苄原料药10 mg),转移到100 mL容量瓶中,加流动相超声溶解摇匀并定容至刻度,取适量溶液通过0.45 μm膜过滤,用定量阀定量进样,记录色谱图。按外标校正曲线法计算即得。
2.3.3 体外释放度的测定
本实验中,作者以pH值1.2的HCl溶液为人工模拟胃液,头孢氨苄在pH值1.2的HCl溶液中稳定,溶解度为33.5 g•L-1左右,500 mg头孢氨苄原料药的投药量在pH值1.2的HCl溶液释放介质中,完全能满足漏槽条件。根据《中华人民共和国药典》2010年版二部附录,取本品(相当于头孢氨苄原料药500 mg),照释放度测定法(附录 XD 第一法),采用溶出度测定法(附录 XC 第一法)的装置,以900 mL pH值1.2的HCl溶液为释放介质,转速为100 r•min-1,温度为(37.0±0.5) ℃,在1、2、3、4、5、6、7、8和12 h分别取溶液5 mL,以0.45 μm滤膜滤过备用,并及时补加相同体积的脱气介质。各小时点所取滤液照”2.3.1.2”条测定,计算累计释放度,药物释放曲线之间的相似度用相似因子f2评价[7]。
2.4 头孢氨苄胃漂浮微丸的制备
2.4.1 载药丸心的制备
将主药和辅料分别过150 μm筛,混合均匀,加入适量水,制成软材,经挤出滚圆机0.8 mm不锈钢筛板制成长度适当的条状物,然后先用800 r•min-1速度,滚圆时间为10 min,再用200 r•min-1速度滚圆2 min,所得微丸置于40 ℃烘箱内干燥筛分后,取600到700 μm的微丸进行工艺评价。
2.4.2 载药丸心的包衣
如图1所示,载药丸心首先包一层控释膜,然后包一层产气层,最后包一层气体阻滞层。各包衣液配制过程和包衣条件如下。
2.4.2.1 控释层包衣液的配制
在烧杯中将PVP k30和抗静电剂十二烷基硫酸钠(sodium dodecyl sulfate ,SDS)置于适量水中分散,使其溶解均匀;另外加入一定量的Eudragit®NE-30D水分散体,使PVP k30和Eudragit®NE-30D水分散体固含量质量比为1∶4,再加水调节使上述包衣液中的固含量质量分数为15%,即得。
2.4.2.2 产气层包衣液的配制
将 HPMC置于适量热水中分散,放冷后溶解;另取适量的水溶解PEG 6000(质量为HPMC的10%)和处方量的 NaHCO3,完全溶解后倒入HPMC溶液中,持续搅拌,制成产气层包衣液。2.4.2.3 气体阻滞层包衣液的配制
将处方量的邻苯二甲酸二乙酯(DEP)加入到Eudragit®NE-30D水分散体中(DEP与Eudragit®NE-30D水分散体固含量质量比为1∶5),用水调节,搅拌均匀,使上述包衣液中的总固含量质量比为15%,备用。
各包衣层的包衣操作条件如表1。

表 1 三层衣膜的包衣操作条件Table 1 The operation conditons for the coating of the three succesive layers
2.5 头孢氨苄胃漂浮微丸性质的考察
按《中华人民共和国药典》2010版附录XC第二法规定的桨法测定,精确数取头孢氨苄胃漂浮微丸100 粒,投入 900 mL pH值1.2 HCl溶液中,设置转速∶100 r•min-1,温度∶(37.0±0.5) ℃。目测各微丸起漂时间(floating lag time,FLT)、持续漂浮时间(floating duration),并记录。在 12 h 后,将漂浮在pH值1.2的HCl溶液液面上的微丸取出,计为N,计算漂浮率,其公式如下:胃漂浮微丸漂浮率=N/100×100%。
2.6 微丸粉体学性质的考察
微丸的粉体学性质有圆整度、收率、脆碎度和轻敲密度等。
2.6.1 圆整度的测定
微丸的平面临界通常用稳定性和休止角 2 个参数来评价微丸的圆整度。本文作者采用平面临界稳定性来考察微丸圆整度。其方法为:将定量(1 g)微丸置于一平板上,将平板一侧抬起,测量在大于 85%的微丸开始滚动时倾斜平面与水平面的夹角(φ),φ越小,表明微丸圆整度越好。
2.6.2 微丸的收率
经挤出滚圆法制备的微丸干燥后过分别过600 μm和700 μm做为目标微丸,收率的计算公式为:w(微丸收率)=m(目标微丸)/ m(投料)×100%。
2.6.3 脆碎度的测定
脆碎度可以用来表征微丸的硬度,只有微丸的硬度达到一定程度后才能用流化床来进行包衣步骤。脆碎度测定的步骤如下,精密称取目标微丸约 6.5 g(m1),置于脆碎度测定仪中,以转速为 25 r.min-1,旋转4 min后,取出微丸,用孔径为150 μm筛筛分,用吹风机吹去目标微丸上的粉末,精密称量留在筛网上微丸的质量(m2),利用下式计算微丸的脆碎度:w(Fr)=(m1-m2)/m1×100%。
2.6.4 轻敲密度的测定
称取经干燥后的目标微丸约5 g,置于10 mL量筒中,手工多次轻敲,直至体积不变为止,记录最终体积V,按轻敲堆密度公式计算:Tapping density= m /V。
2.7 微丸干燥时间的确定
精密称取刚挤出的微丸约10 g,平铺在纸盒里,使微丸在纸盒中分散均匀,放置在烘箱里,设置烘箱温度为40 ℃,分别在2、4、6、8、10、12、14、16和24 h取出,立即精密称重,记录微丸在各时间点的质量,列于表2中,由表2可知,微丸的质量在干燥12 h后不再变化,从而确定微丸的干燥时间为12 h。

表 2 干燥时间和微丸质量的关系Table 2 Correlation between drying time and pellets quality
2.8 头孢氨苄胃漂浮微丸的处方工艺考察
2.8.1 载药丸心处方筛选
通过挤出滚圆法制备载药丸心,在预实验基础上通过对制备出来的微丸收率,粉体学性质进行系统的考察,处方中有原料药头孢氨苄,微丸成形促进剂MCC,崩解剂L-HPC,轻质材料十八醇(octadecanol)以及H2O,固定处方中头孢氨苄质量50 g, L-HPC 3.5 g,以其他处方的质量如MCC(A)、octadecanol(B)、H2O(C)为工艺参数,采用3因素3水平L9(34)正交实验设计,以目标微丸的收率(yield,Y)、脆碎度(friability,F)、圆整度(spH值ericity,S)和轻敲密度加权综合评分W(Y-5F-2S-5P)为考察指标,结果见表3、4。

表 3 正交实验设计因素和水平表Table 3 Factors and levels for the orthogonal experimental design

表 4 正交设计和试验结果Table 4 The orthogonal design and experimental results

Continued table 4
由表4可知,MCC(A)、octadecanol(B)、H2O(C)对3个工艺参数对微丸性质的影响的主次顺序为A>C>B,其中MCC质量对微丸质量影响最大。从正交实验结果看,最优工艺参数为A3B2C2,即MCC质量为30 g、octadecanol质量为7 g,H2O的质量为40 g。
2.8.2 控释层的考察
按2.4.2项下配制控释层包衣液并按照表1的包衣条件对载药丸心进行包衣操作,操作后微丸在烘箱40 ℃条件下老化24 h,然后分别考察包衣增重为3.0%、3.5%、4.0%对头孢氨苄胃漂浮微丸释放的影响,依照释放度测定方法,测定头孢氨苄胃漂浮微丸在12 h内的释放度,结果见图3,包衣增重为3.0%和3.5%之间的相似因子f2为42,包衣增重为3.5%和4.0%之间的相似因子f2为30。从中可以看出控释层包衣增重对药物的释放有显著的影响,可以通过调节控释层的包衣增重来调节药物的释放,从图3中可知,包衣增重为3.0%的处方药物释放过快,在8小时内药物就释放完全,而包衣增重为4.0%的处方药物释放有迟滞,且在12 h内药物释放不完全,包衣增重为3.5%的处方释药平稳,在12 h 内药物释放完全,所以本文选择包衣增重为3.5%的处方用来下一步包衣操作;在漂浮性质方面,不同包衣增重的绝大多数微丸很快在释放介质中沉底,只有极少数微丸能漂浮在液面上,这些微丸不久也沉入杯底。
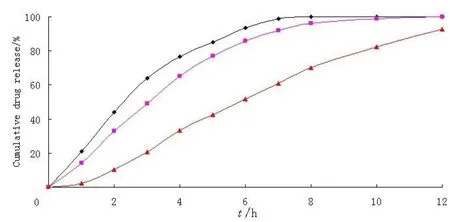
图 3 Eudragit® NE-30D包衣增重对药物释放的影响Fig. 3 Effect of the Eudragit® NE-30D weight gain on the drug release profile
2.8.3 产气层的考察
选择包好控释层的微丸,固定产气层包衣增重12%,分别用NaHCO3与HPMC质量比为1∶4、2∶3、1∶1、3∶2和4∶1对微丸包衣,操作后微丸在烘箱40 ℃条件下老化12 h,不同微丸在pH值1.2的HCl溶液中的药物释放曲线见图4,包上产气层后的微丸药物释放曲线与包衣前的药物释放曲线几乎没有区别,说明药物的释放几乎不受产气层的影响,持续漂浮时间见图5,如图中所示,微丸的漂浮时间都低于20 min,随着NaHCO3比例的增加,微丸的漂浮时间减少,出现这种现象的可能是NaHCO3比例小的处方里,产气层中HPMC含量大,HPMC在HCl溶液中水化分散后,所产生的胶状物包裹CO2气体更强,所以微丸在pH值1.2 HCl溶液中漂浮的时间更长,但是所有处方中的微丸的漂浮时间非常短,都低于20 min,原因是HPMC所产生的胶状物很快就溶解在释放介质中,在溶解过程中,所包裹的气体也同时逸出来,导致微丸再次下沉,在固定包衣增重为15%的气体阻滞层中,只有NaHCO3与HPMC质量比为4∶1的处方能够在1 min内起漂,持续漂浮时间大于12 h,所以选择NaHCO3与HPMC质量比为4∶1的处方进一步考察。
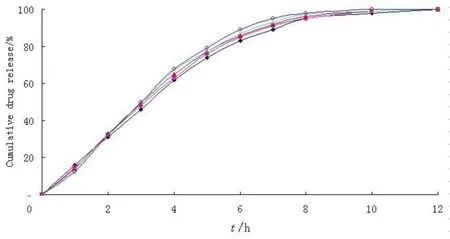
图 4 产气层包衣中NaHCO3百分质量比对药物释放的影响Fig. 4 Effect of % NaHCO3 layered onto the drug-loaded pellets on the drug release profile

图 5 产气层包衣中NaHCO3百分质量比对微丸漂浮时间的影响Fig. 5 Effect of % NaHCO3 layered onto the drug-loaded pellets on floating time of effervescent-layered pellets
2.8.4 气体阻滞层的考察
在控释层包衣增重为3.5%,产气层包衣增重为12%(NaHCO3与HPMC质量比=4∶1)时,分别考察不同气体阻滞层包衣增重为0%、5%、10%、15%和20%对药物释放和微丸漂浮的影响,结果如图5和表6所示。从图中可以看出,增加气体阻滞层包衣增重稍稍降低了药物释放速度和最终累计释放量, 处方中包衣增重为10%和15%、15%和20%的相似因子f2分别为75和69,这说明气体阻滞层包衣增重在10%和15%、15%和20%之间几乎对药物的释放没有显著性的影响,而起漂时间(FLT)则从8 s增加到55 s,漂浮持续时间(floating duration)从2 min延长到12 h以上,综合考虑微丸的释药曲线、起漂时间和漂浮持续时间,本文选择控释层包衣增重为3.5%,产气层包衣增重为12%(NaHCO3与HPMC质量比=4∶1),气体阻滞层包衣增重为15%做为最优处方(Fopt),处方起漂时间为55 s,持续漂浮时间大于12 h,药物释放曲线也能满足缓释制剂的要求。
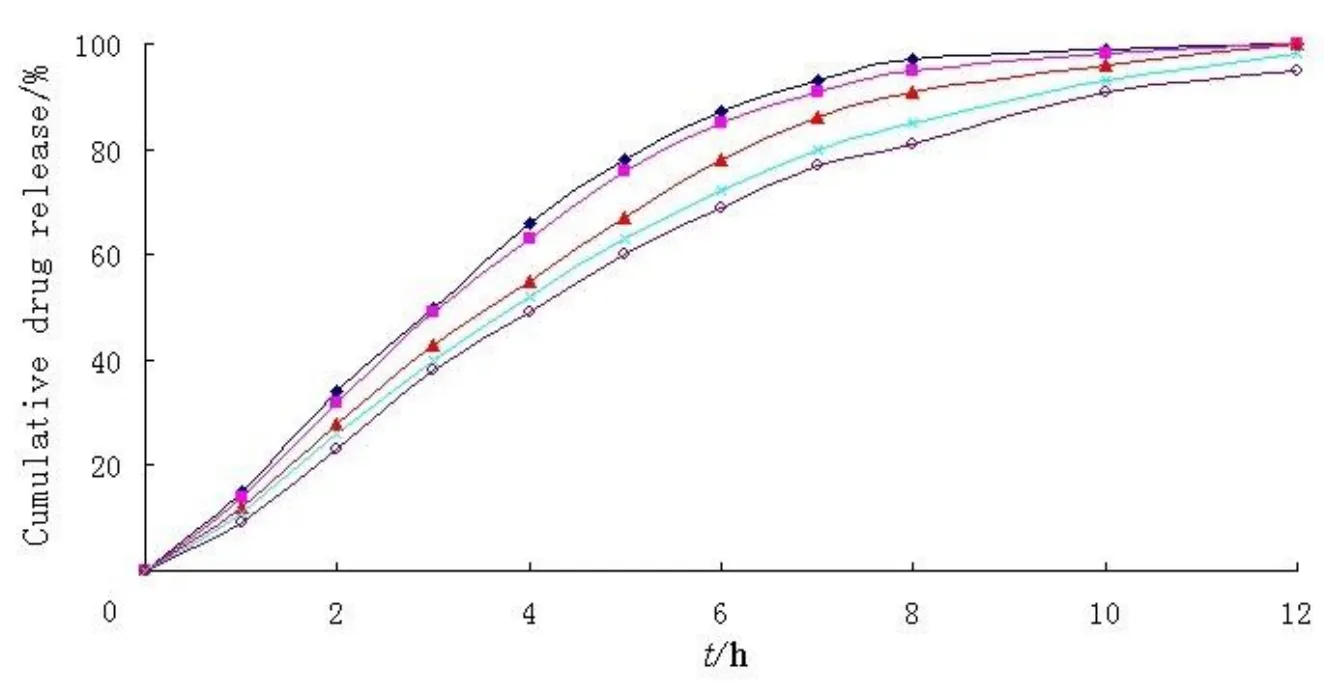
图 5 气体阻滞层Eudragit® RL -30D包衣增重对药物释放的影响Fig. 5 Effect of the Eudragit® RL -30D weight gain as gas entrapped membrane on the drug release profile

表 5 气体阻滞层Eudragit® RL -30D包衣增重对漂浮滞后时间和持续时间的影响Table 5 Effect of the Eudragit® RL -30D weight gain as gas entrapped membrane on the FLT and floating duration
2.9 药物释放模型的拟合
制剂的体外释放数据通常可用适当的数学模型进行拟合,以推测释药机理。释药模型的类型有零级释放、一级释放、Higuchi和Ritgere Peppas等。将优选处方(Fopt)的包衣微丸前7个小时的药物释放数据分别采用上述不同的数学模型进行拟合,拟合结果见表 2。从表中可见,拟合系数最好的是零级释放,拟合系数为0.9912。

表 6 药物释放模型拟合结果Table 6 Models for drugs release fitting correlation coefficients
3 讨论
头孢氨苄为时间依赖型抗生素,有制成缓释制剂的必要,但对于只在胃肠道上端吸收的药物,全胃肠道释放的缓释制剂可能导致生物利用度低,不良反应大,因此,本文作者制备了头孢氨苄胃漂浮型缓释微丸;在本实验中,控释层和气体阻滞层包衣材料用的是水分散体,这样就消除了有机溶剂作为包衣介质的不利影响,另外,水分散体固含量高,包衣效率也高,但Eudragit® NE-30D水分散体控释层包衣增重对药物释放影响很大,所以在包衣过程中要小心的控制包衣增重;在处方筛选中,要对起漂时间,漂浮时间和释药曲线综合考虑,本实验中,控释层包衣增重为3.5%,产气层包衣增重为12%(NaHCO3与HPMC质量比=4∶1),气体阻滞层包衣增重为15%, 做为优选处方,处方起漂时间为55 s,持续漂浮时间大于12 h,释药曲线也满足要求。
4 结论
本文作者成功的制备了基于产气原理的头孢氨苄胃漂浮微丸,该载药丸心采用挤出滚圆法制备,流化床包衣,重现性好,易于实现工业产业化;此外,该微丸具有以下特点:a. 在pH值1.2的HCl溶液中快速起漂,起漂时间为55 s;b. 漂浮持续时间大于12 h;c. 具有零级释药特征;d. 能够在12 h内将药物释放完全。
[1] 汪茂先, 尤孝庆, 陈晓燕.头孢氨苄缓释胶囊的研究[J]. 广东药学, 2000, 10(1)∶ 25-26.
[2] 杨建宏, 孙磊, 罗福国. 头孢氨苄溶解度及表观油水分配系数[J]. 中国抗生素杂志, 2010, 35(9)∶ 7-8.
[3] 臧洪梅. 改良在体单向灌流实验探讨头孢氨苄大鼠小肠吸收机制[J]. 药学与临床研究, 2008, 16(6)∶ 450-453.
[4] 冯金华, 邹梅娟, 程刚. 盐酸青藤碱缓释微丸的制备[J]. 中国药剂学杂志, 2012,10(1)∶ 7-16.
[5] SINGH B M, KIM K H. Floating drug delivery systems∶ an approach to oral controlled drug delivery via gastric retention [J]. J Control Rel, 2000, 63(3)∶ 235–259.
[6] KROGEL I, BODMEIER R. Floating or pulsatile drug delivery systems based on coated effervescent cores[J]. Int J Pharm, 1999, 187(2)∶175-184.
[7]VINOD P S, YI T, PRADEEP S, et al. In vitro dissolution profile comparison-statistics and analysis of the similarity factor, f2[J]. Pharmaceutical Research, 1998, 15(6)∶ 889-896.
Preparation and in vitro evaluation of cephalexin gastric floating pellets
LI Wei-min1, XIONG Wei1, PAN Wei-san1, YE Tian-tian, JING Heng-pan2, YANG Xing-gang1*
(1.School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
ObjectiveTo prepare cephalexin gastric floating pellets with the intention to release the drug slowly, reduce the toxic and side effect, prolong the gastric rensidentce time and thereby increase the bioavailability. Method The drug-loaded pellets was prepared by extrusion and spheronization method and then coated with three successive layers in a fluid bed. In particular, Eudragit®NE-30D aqueous solids was used as controlled release film, sodium bicarbonate with HPMC E5 as gas formation layer and Eudragit®RL-30D aqueous solids as gas entrapped membrane. The effects of the composition of coating layers and coating weight gain on the gastric floating characteristic and drug release profile were investigated to optimize the formulation. Results The coating weight gain of controlled release film had a significant effect on the drug release, and both the gas formation layer and the controlled release membrane had influence on the floating lag time (FLT) and floating duration. Conclusion The cephalexin gastric floating pellets were successfully prepared with a nice gastric floating characteristic and zero-oreder release profile.
gastric floating pellets; extrusion-spheronization method; fluid bed method;gas-formation; cephalexin.
R 94
A
(2014)04–0103–12
(本篇责任编辑:曹霞)
2014–03–13
李卫民(1984-), 男(汉族), 江西吉安人, 硕士研究生, E-mail es132@sina.com; *通讯作者:杨星钢(1974-), 男(汉族), 河北昌黎人, 副教授, 博士,硕士生导师,主要从事药物新剂型与中药制剂的研究, Tel. 024-23986313, E-mail yangxg123@163.com。
关键词:药剂学;胃漂浮片;星点设计-效应面法;黄藤素; HPMC K15M; CMS-Na

