具有抑菌活性的海藻多酚联合提取工艺优化研究
杨会成,郑 斌,郝云彬,相兴伟,周宇芳,廖妙飞,李瑞雪
(1.浙江省海洋开发研究院,浙江舟山 316021;2.中国海洋大学食品科学与工程学院,山东青岛 266003;3.舟山出入境检验检疫局,浙江舟山 316100)
海藻生活在特殊生态环境下,在其进化过程中产生了与陆上生物不同的代谢和机体防御系统,普遍含有特殊功能的生物活性物质如酚类、吲哚类、萜烯类等化合物,是海洋天然产物的重要来源。其中海藻多酚是一大类结构不同、含有多羟基的化合物,由多种简单酚结构单元组成。它作为天然食品添加剂中的抗氧化剂、防腐剂等方面具有重要的意义[1-4]。此外,海藻多酚还具有抗肿瘤、抗病毒、化学防御、除臭等生物活性。目前,人们已发现海藻多酚在红藻、褐藻、蓝藻、绿藻中均有分布,其中以褐藻中含量较大,种类较多,包括马尾藻、鼠尾藻、海带、海黍子、裙带菜、羊栖菜等。海藻多酚的提取方法主要有极性溶剂提取法、超临界提取法等[3,6-7]。但是目前国内外关于海藻多酚提取方法的系统研究报道还不多见。
海带具有分布广、藻体大、生长快等特点,含有多种保鲜成分和功能性物质,是我国优势海洋生物资源,养殖产量居世界首位,但目前对其高值化利用程度低,且加工过程中产生的废弃物对环境也造成很大污染。因此,以海带、鼠尾藻等野生海藻为原料制备海藻多酚保鲜防黑变抑制剂,不但可以克服含硫违法添加剂的使用及残留问题,又能有效抑制甲壳类黑变现象,延长其货架期,提升商品价值,同时提高藻类的附加值。
本文运用超声波、微波等提取手段,通过多种因素分析比较确定海藻多酚的最佳浸提工艺参数,为海藻多酚和海藻的综合利用提供基础技术资料。
1 材料与方法
1.1 材料与试剂
鲜海带和鼠尾藻采自于舟山嵊泗;南美白对虾购自于舟山北门水产市场。
金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、绿脓杆菌、痢疾志贺菌、产气肠杆菌、普通变形杆菌、白色念珠菌、青霉、灰霉、黄曲霉,由中科院微生物所提供。
1.2 主要试剂
酒石酸钾钠、七水合硫酸亚铁、磷酸氢二钠、磷酸二氢钾、没食子酸丙酯、无水乙醇,均为分析纯。无菌生理盐水、营养琼脂培养基、PDA培养基。
1.3 主要仪器设备
分光光度计,超声波清洗器,多功能微波炉,组织捣碎匀浆机,恒温水浴摇床,电热压力蒸汽灭菌器,智能生化培养箱,等。
1.4 海藻多酚类物质的提取[8-12]
新鲜海藻先用清水洗去表面附着物,自然风下晾干,后用组织匀浆机打碎备用。
称取上述匀浆200 g,放入烧杯中加入400 mL 80%乙醇,搅拌均匀,放在超声波处理器或多功能微波炉(设置为低火)中处理一段时间(单一方式使用时间为6 min,联合使用时各处理3 min)。再放入60℃水浴摇床中,100 r/min,闭光浸提1 h。最后抽滤,滤渣重复浸提,合并滤液,再经减压浓缩除去乙醇,浓缩液冷冻干燥即得海藻多酚粗提物。
1.5 总酚含量及提取率的测定[13]
用没食子酸丙酯配制成0.5 mg/mL的对照品标准溶液。

表1 标准曲线测定实验组Tab.1 Standard solution curve
取上述浸提液5.0 mL加入25 mL容量瓶中,自加入酒石酸铁溶液开始按绘制标准曲线的操作步骤操作。以蒸馏水代替试液加入同样试剂作空白,每个样品做三次平行实验,结果取平均值。按公式计算海带多酚的提取率。
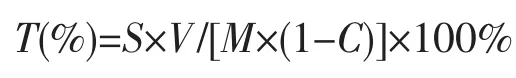
式中,S-海带多酚浓度(mg/mL);
V-提取液体积(mL);
M-鲜海带质量(mg);
C-鲜海带含水率(%)。
1.5 海带多酚抗菌活性测定
制备浓度大约在105~106 cfu/mL菌悬液,用移液枪吸取100 μL菌悬液,放在已标明样品号的无菌平板上(真菌外加1mL浓度为200 μg/mL的多酚粗提液),每种菌制备3个平板,立即倒入融化后冷却至50℃左右的培养基约15 mL,随即在平面上快速而轻巧地晃动平皿,使菌悬液(样液)和培养基混合均匀后平置,待其冷却。采用平板生长抑制法进行多酚抑菌活性测定。即在洁净工作台内,将经过紫外线照射杀菌20 min后的移液枪装上特制枪头,在已冷却的营养琼脂平板上均匀的打上5个直径为3 mm的光滑小孔,其中1个小孔加30 μL无菌蒸馏水作为对照,其余4个小孔分别加30 μL过滤除菌后的待测液。加完样液后平板静置放置10 min,以保证待测液分散均匀。将已经加样的含菌平板倒置放入37℃(真菌28℃)的恒温培养箱中,培养12~24 h后观察抑菌结果。
1.6 抗菌活性数据分析
细菌测量透明圈的直径,取所测4孔抑菌圈直径的平均值;真菌则观察加样平板与未加样对照组菌落或菌丝生长状况的差别。以大于空白的抑菌圈直径所对应的多酚浓度(μg/mL)为最低抑菌浓度(MIC),并对所得结果进行统计学分析,所有数据均采用平均值±标准差。
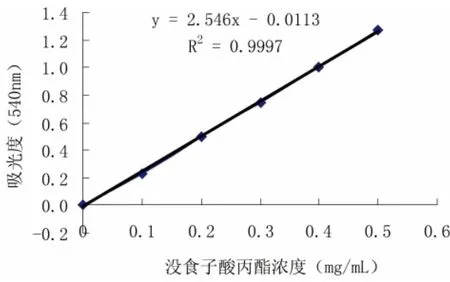
图1 多酚标准曲线Fig.1 Polyphenols standard curve
2 结果与讨论
2.1 提取方法比较
从图2可以看出,复合处理较无处理和单一方式处理,多酚的浸出率要高,且超声波→微波复合处理效果最好。因为先通过超声波的机械粉碎和空化效应等作用,可使物质分子运动的频率和速度增大,溶剂的穿透力增强,组织内部或胶体里的有效成分溶出速度和溶出数量得到提高[14-15],再辅以微波的生理、物理效应使极性分子随微波频率摆动并产生热量,使体系更加分散,有利于物质的溶出。超声波处理过后的样品更适宜于微波发挥其功效,使原料内部温度在微波辐射下得以全面、快速、均匀升高,从而加快溶剂对多酚的提取过程,大大提高提取的效率。此复合提取法克服了传统方法的缺点,具有操作简便,经济、省时的优点,所以在相同的时间内大大提高了多酚的浸出率[12]。因此,最佳前处理方式选择超声波→微波。
2.2 单因素实验
2.2.1 浸提时间对多酚浸出率的影响
采用超声波→微波前处理方式,固定浸提温度60℃,乙醇浓度80%,料液比(匀浆:乙醇,g/mL)1:4,浸提2次的提取条件,观察不同提取时间对海带多酚提取率的影响,结果如图3。
从图3可以看出,浸提时间为4 h时,浸提率最高并且比较稳定,而浸提时间超过4 h后,海带多酚浸提率出现不稳定并呈下降趋势,这可能是浸提时间太长多酚被氧化或降解的缘故,因此,正交实验中浸提时间范围应选3.5~5 h。
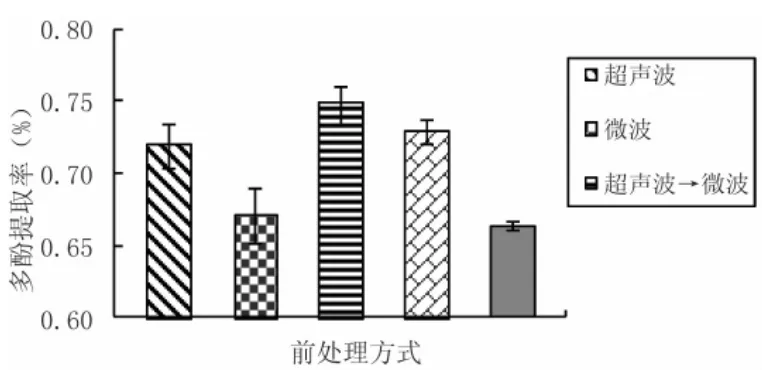
图2 前处理方式对多酚浸出率的影响Fig.2 Polyphenols extraction ration of different methods
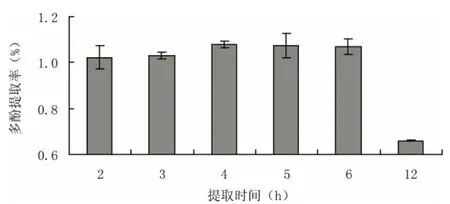
图3 时间对多酚浸出率的影响Fig.3 Time on polyphenols extraction rate
2.2.2 浸提温度对多酚浸出率的影响
采用超声波→微波前处理方式,固定提取时间4 h,乙醇浓度80%,料液比(匀浆:乙醇,g/mL)1:4,浸提2次的提取条件,观察不同浸提温度对海带多酚提取率的影响,结果如图4。
从图4可以看出,随着温度的升高,多酚的浸出率呈上升趋势,在20~40℃之间时浸出率基本上没有变化,40~80℃时浸出率明显升高。这是由于温度升高,分子运动加速,氢键更易断裂,多酚的渗透、溶解、扩散速度也加快,因而酚类物质更易于从原料中溶出。而超过80℃时,浸出率反而降低,可能由于高温下海带多酚类物质易于发生氧化或降解反应。因此,初步确定60~90℃为正交实验的提取温度范围。
2.2.3 乙醇浓度对多酚浸出率的影响
采用超声波→微波前处理方式,固定提取时间4 h,浸提温度60℃,料液比(匀浆:乙醇,g/mL)1:4,浸提2次的提取条件,观察不同乙醇浓度对海带多酚提取率的影响,结果如图5。
从图5可以看出,匀浆中加入乙醇后,随着乙醇浓度的升高,多酚的浸出率有上升的趋势,但当乙醇浓度超过80%后,多酚浸出率呈下降趋势。原因可能是低浓度的乙醇含水量过高,促进了海带中的许多粘性物质和外来水分互溶形成胶团,从而影响浸出率,而高浓度的乙醇挥发性较大,使提取液极性降低,也会影响浸出率。因此,正交实验乙醇浓度应在75%~90%。
2.2.4 料液比对多酚浸出率的影响
采用超声波→微波前处理方式,固定提取时间4 h,浸提温度60℃,乙醇浓度80%,浸提2次的提取条件,观察不同料液比(匀浆:乙醇,g/mL)对海带多酚提取率的影响,结果如图6。
料液比(匀浆:乙醇,g/mL)是影响多酚浸出率的重要因素之一,适当的料液比不仅能使原料中的多酚物质得到充分提取,而且可减少溶剂的浪费和节省提取成本[16]。从图6可以看出,随着料液比的增大,多酚的浸出率呈上升趋势但趋势并不明显。且过大的料液比也使得乙醇的用量增加,成本上升,对乙醇的回收不利。因此,初步确定正交实验的料液比(匀浆:乙醇,g/mL)在1:5~1:8之间。
2.2.5 浸提次数对多酚浸出率的影响
采用超声波→微波前处理方式,固定提取时间4 h,浸提温度60℃,乙醇浓度80%,料液比(匀浆:乙醇,g/mL)1:7的提取条件,观察不同浸提次数对海带多酚提取率的影响,结果如图7。
从图7可以看出,提取3次时多酚含量最高,随着提取次数的增加,浸出率反而下降,原因可能是由于提取次数过多导致多酚溶出量提高的同时,也将大分子物质如糖、蛋白质等提取出来,多酚与这些大分子物质形成复合物,同时部分多酚也会发生氧化损耗,降低多酚浸出率。所以,正交试验选择提取次数为1~4次。
2.3 提取条件优化
在单因素实验的基础上,选用L16(45)设计表格进行正交实验,因素水平见表2。
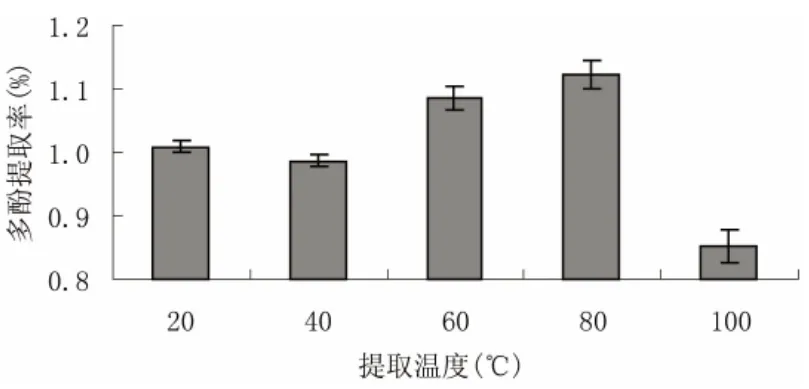
图4 温度对多酚浸出率的影响Fig.4 Temperature on on polyphenols extraction rate
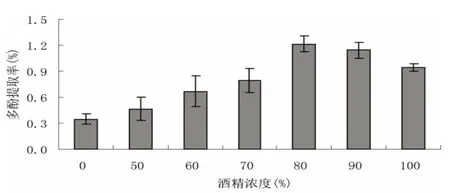
图5 乙醇浓度对多酚浸出率的影响Fig.5 Ethanol concentration on polyphenols extraction rate
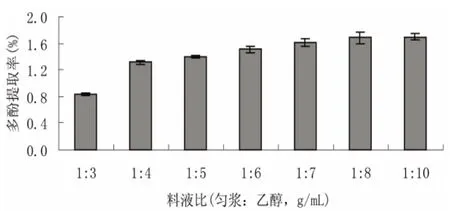
图6 料液比对多酚浸出率的影响Fig.6 Solid-liquid ratio on polyphenols extraction rate

图7 提取次数对多酚浸出率的影响Fig.7 Extraction times on polyphenols extraction rate
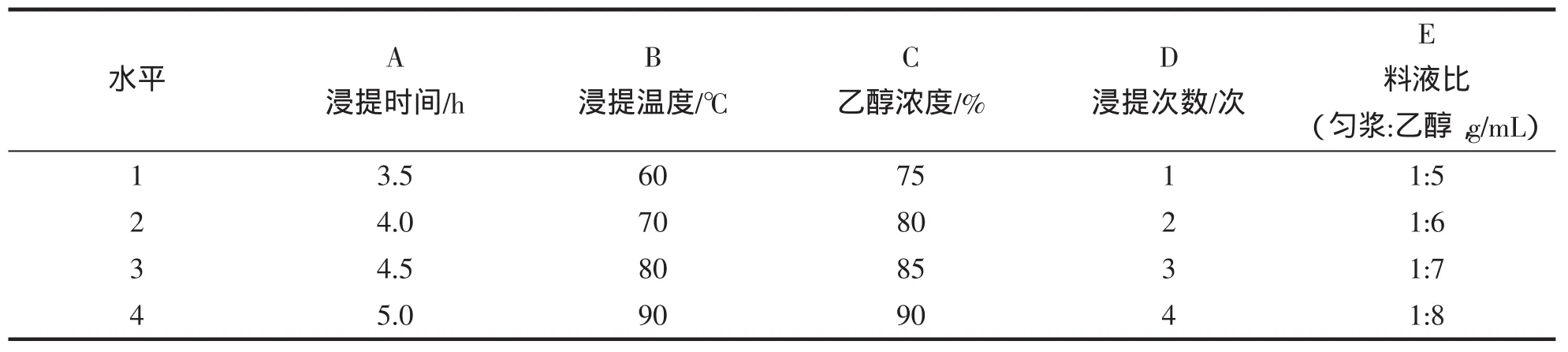
表2 因素水平表Tab.2 Table of factors and levels
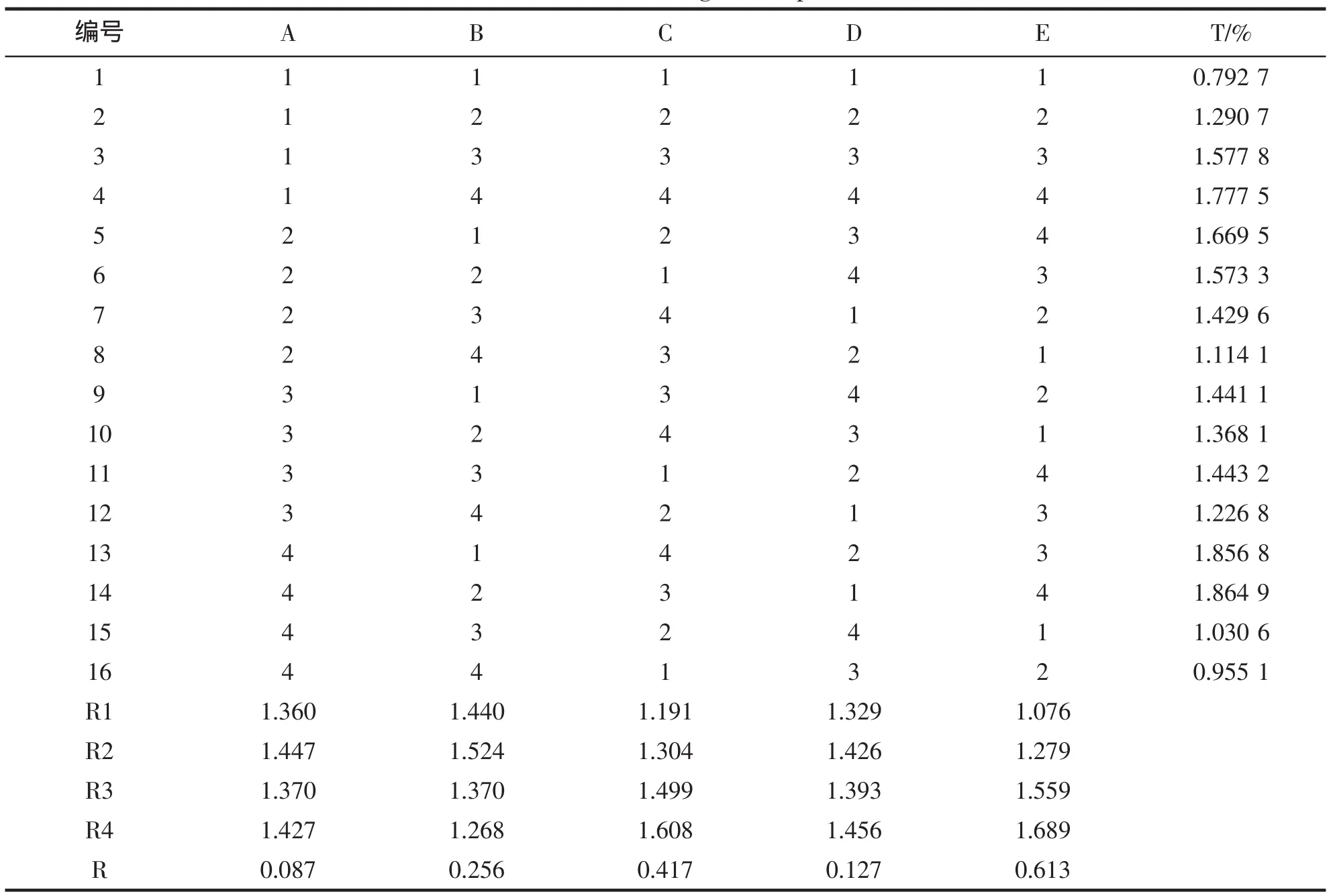
表3 正交实验结果Tab.3 Results of orthogonal experiments
通过极差分析可知,各因素对多酚浸出率影响的顺序是:料液比E>乙醇浓度C>浸提温度B>浸提次数D>浸提时间A,从表中数据看,最佳工艺条件应是E4C4B2D4A2,在此条件下,多酚的浸出率为2.20%。但是,比较相邻两个水平之间的斜率E3、C3、D2较高,另外,从经济角度考虑,采用E3、C3、D2可以减少工序并降低提取成本,且在E3C3B2D2A2条件下多酚的浸出率为2.08%,与上述浸出率2.20%无明显差异。因此,得出多酚提取的最佳条件是:E3C3B2D2A2,即料液比(匀浆:乙醇,g/mL)1:7,乙醇浓度85%,浸提温度70℃,浸提次数2次,浸提时间4 h。
2.4 抗菌试验结果
2.4.1 抗细菌试验结果
抑菌实验结果表明,KP粗提液在一定的浓度下,对供试的2种革兰氏阳性菌和5种革兰氏阴性菌都有一定程度的抑制活性,但是不同的微生物对其敏感性不同,多酚对革兰氏阴性细菌的抑制效果较明显,又以对大肠杆菌、绿脓杆菌的抑制效果更佳。而且所有细菌对多酚的量效关系均呈剂量依赖型,因而可以开发成一种高效广谱抗菌剂。
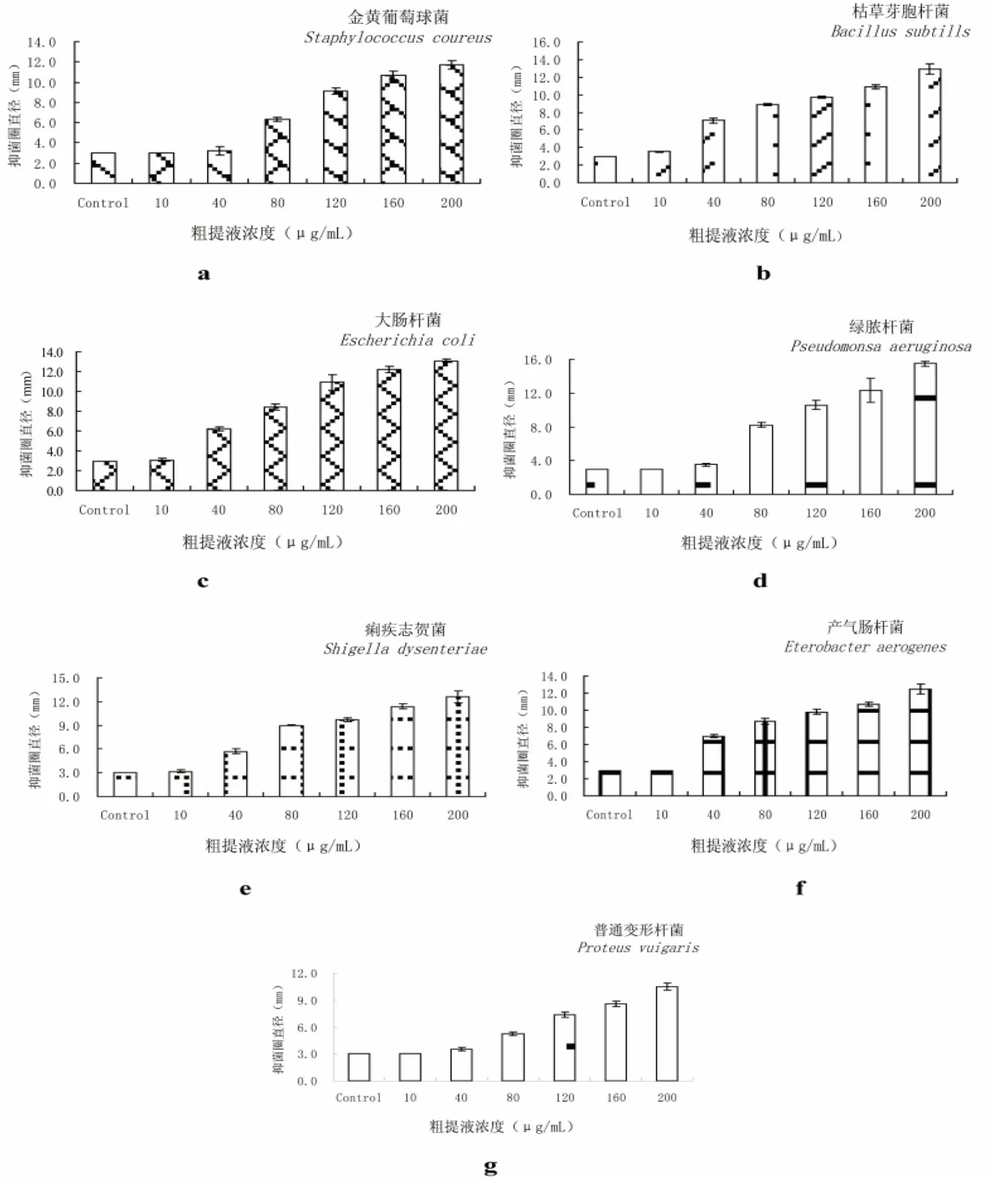
图8 不同浓度的粗提液对细菌的抑制作用Fig.8 Antibacterial effect of different concentration extraction
同时,从图8中也可以看出,随着多酚浓度的降低,抑菌效果也明显降低,当浓度为40 μg/mL时,KP粗提液对金黄色葡萄球菌、绿脓杆菌和普通变形杆菌的抑菌活性已经不明显。当浓度降至10 μg/mL时,已无抑菌圈,KP粗提液对大多数供试菌种基本失去抑菌活性。因而可以认为KP粗提液对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、绿脓杆菌、痢疾志贺菌、产气肠杆菌、普通变形杆菌7种供试菌的MIC 分别为40、10、10、40、10、40 和 40 μg/mL。在此浓度下,它们的抑菌圈直径分别是:3.2、3.5、3.1、3.5、3.2、7.0和 3.5 mm。
2.4.2 抗真菌试验结果
表4中结果显示,供试的KP对青霉菌菌丝生长的抑制活性最高,其次是白色念珠菌,对黄曲霉、灰霉菌丝生长的抑制活性较小。而且供试KP对青霉、白色念珠菌真菌生长的抑制主要是抑制菌丝和菌落的生长速度,表现为菌落直径比对照减小。但对黄曲霉、灰霉菌的抑制主要表现为菌丝明显比对照稀薄,而菌落直径并未明显减小。海带粗提物抑制真菌菌丝生长的机理尚有待明确。

表4 粗提液对真菌的抑制作用Tab.4 Inhibition fungi of algae extraction
3 结论
通过单因素实验和正交实验确定了超声波、微波复合提取海带多酚类物质的最佳提取工艺条件,即料液比(匀浆:乙醇,g/mL)1:7,乙醇浓度85%,浸提温度70℃,浸提次数2次,浸提时间4 h。在该条件下总多酚的浸出率可以达到2.08%。
海带多酚粗提液具有广谱抗微生物性能,对供试的革兰氏阳性菌和革兰氏阴性菌都有一定程度的抑制活性,对真菌如青霉、白色念珠菌亦有抑制作用。所有细菌对多酚的量效关系均呈剂量依赖型。另外,多酚对革兰氏阴性细菌的抑制效果较明显,又以对大肠杆菌、绿脓杆菌的抑制效果更佳。粗提液对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、绿脓杆菌、痢疾志贺菌、产气肠杆菌、普通变形杆菌7种供试菌的MIC分别为40、10、10、40、10、40和40 μg/mL。将超声波、微波技术应用于海带中多酚类活性物质的提取,可获得较好的效果,具有广阔的应用前景。
[1]范 晓,严小军,陈予敏,等.高分子量褐藻多酚抗氧化性质研究[J].水生生物学报,1999,23(5):494-499.
[2]吕志华,于广利,迟连利,等.海黍子多酚对亚油酸甲酯氧化的抑制作用[J].中国海洋药物,2001,(6):2-28.
[3]魏玉西,于曙光.两种褐藻乙醇提取物的抗氧化活性研究[J].海洋科学,2002,26(9):49-51.
[4]YAN X J,LI X C,ZHOU C X,et al.Prevention of fish oil rancidity by phlorotannins from Sargassum kjllmanianum[J].Appl phycol,1996,8:201-203.
[5]魏玉西,牛锡珍,李智恩,等.褐藻中多酚化合物的研究进展[J].海洋科学,2002,26(10):18-20.
[6]JORMALAINEN V,HONKANEN T,VESAKOSKI O,et al.Polar extracts of the brown alga Fucus vesiculosus(L.)reduce assimilation efficiency but do not deter the herbivorous isopod Idotea baltica(Pallas)[J].Exp Mar Biol Ecol,2005,317:143-157.
[7]VAHER M,KOEL M.Separation of polyphenolic compounds extracted from plant matrices using capillary electrophoresis[J].Chromatogr A,2003,990:225-230.
[8]周贞兵,王士长.马尾藻多糖与多酚的提取及其活性研究[D].南宁:广西大学,2002.
[9]PEKIC B,KOVAC V,ALONSO E.Study of the extraction of proanthocyanidins from grape Seeds[J].Food Chem,1998,61(12):201-2066.
[10]李 华.超声波法从葡萄籽中提取多酚的研究[J].酿酒科技,2005(5):89-91.
[11]覃勇军,黄道战,石灵高,等.微波萃取茶叶中茶多酚的工艺改进[J].广西民族学院学报:自然科学版,2002,8(4):36-38.
[12]张熊禄,陈厚辉,史燃云,等.微波法从茶叶中提取茶多酚[J].林产化工通讯,2001,35(5):20-22.
[13]张铁英.红豆中多酚类物质的提取及其含量测定的研究[J].中国食品添加剂,2004(15):99-100.
[14]陈素艳,邓清莲,巫晶晶,等.超声波法从茶叶中提取苯多酚[J].渤海大学学报,2005,26(4):316-319.
[15]刘 清,姚惠源,杨 赟,等.超声法提取大麦多酚类活性物质的研究[J].食品科技,2006(5):26-29.
[16]贾冬英,李 尧,姚 开,等.香蕉皮中多酚的提取工艺条件研究[J].四川大学学报:工程科学版,2005,37(6):52-55.

