咽喉反流与嗓音疾病的相关分析*
严森 徐文李赟郑莉张玉焕
咽喉反流(laryngopharyngeal reflux,LPR)是指胃内容物反流至食管上括约肌以上部位,引起一系列咽喉部症状和体征的总称。研究显示,耳鼻咽喉科就诊的患者中5%~10%存在LPR的症状和体征[1],同时50%~62.8%的发音障碍患者经24小时食管pH值监测证实存在LPR[2,3]。由此推测嗓音疾病与LPR之间可能存在一定相关性,因此,如何正确认识嗓音疾病与LPR的关系,已成为国内外研究热点。有研究提示LPR与嗓音疾病存在相关性[4~8],但由于LPR仍无统一诊断标准,因此目前LPR与嗓音疾病的关系尚未明确。为此,本研究拟通过对几种常见的嗓音疾病患者进行24小时食管pH值监测及反流症状指数量表(reflux symptom index,RSI)、反流体征计分量表(reflux finding score,RFS)评估,探讨嗓音疾病与LPR的相关性。
1 资料与方法
1.1对象及分组 以2010年12月至2013年11月于北京同仁医院耳鼻咽喉头颈外科就诊的103例有LPR相关症状的患者为研究对象,男65例(63.11%),女38例(36.89%),年龄26~71岁,平均50.2±3.9岁;其中伴有声嘶的嗓音疾病患者89例,病程9.6±2.2月,包括:声带接触性肉芽肿组18例,慢性喉炎组19例,声带息肉组15例,声带白斑组21例(其中经病理证实为鳞状上皮非异型增生8例,轻中度异型增生7例,重度异型增生及原位癌6例),声带任克水肿组16例;有LPR相关症状但无嗓音疾病患者14例作为对照组,主要症状为咽痛、咽异物感,病程4.1±2.9月。
1.2方法
1.2.1RSI、RFS量表评估 所有患者均于医务人员指导下行RSI、RFS量表评估。RSI量表共有9项调查内容,患者对每项症状有无及严重程度进行自我评分[9];由两位检查者分别于频闪喉镜或纤维喉镜下为所有对象进行RFS中的8项体征评估并记分,以RSI>13分和/或RFS>7分诊断为咽喉反流[10]。
1.2.224小时双探头食管pH值监测及导管定位 对103例患者行24小时双探头食管pH值监测。采用双通道外置参考pH导管,两传感器之间间隔15 cm。纤维喉镜引导下将导管近端传感器探头放置于杓状软骨下缘以下约2 cm处,并使食管入口黏膜将传感器包裹,远端传感点位于其下15 cm的中段食管,确认位置无误后将pH导管固定。外置参考电极固定于患者胸骨柄处皮肤,监测24小时后将pH导管取出[11]。
1.2.3咽喉反流的判断 LPR阳性诊断标准为24小时咽喉反流次数(LPR事件)超过6.9次以上[12]。
1.3统计学方法 运用SPSS17.0软件进行数据分析。计量资料采用kolmogorov-Smirnov 检验数据的正态性,符合正态分布的数据以均数±标准差表示,不符合正态分布的数据以中位数(25分位数,75分位数)表示,即M(P25,P75)。用卡方检验分析组间LPR阳性率差异,独立t检验比较各嗓音疾病组与对照组RSI、RFS分值,采用秩和检验比较各嗓音疾病组与对照组咽喉部的pH监测数据,以P<0.05为差异有统计学意义。
2 结果
2.1各组对象LPR的阳性率 103例患者中经监测判断为LPR阳性48例,阳性率为46.60%(48/103),89例嗓音疾病患者LPR阳性43例,阳性率为48.30%(43/89),其中声带任克水肿组LPR阳性率(75.00%)、声带白斑组LPR阳性率(71.43%)显著高于对照组(P=0.030,P=0.036),其余各组LPR阳性率与对照组比较差异无统计学意义(P>0.05)(表1)。
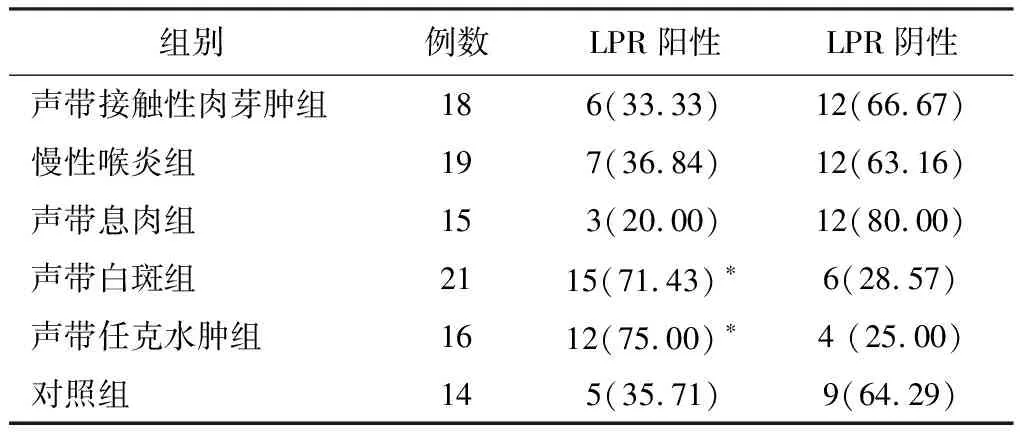
表1 各组24小时食管pH值监测诊断LPR阳性率比较(例,%)
注:*与对照组比较,P<0.05
2.2各组RSI与RFS评分 声带任克水肿组、慢性喉炎组RSI评分(13.9±2.3、13.5±7.2分)显著高于对照组(9.1±2.9分)(P=0.020,P=0.019),其余各嗓音疾病组RSI评分与对照组比较差异无统计学意义(P>0.05)。
声带任克水肿组RFS评分(12.6±2.9分)显著高于对照组(7.6±2.9分)(P=0.009),其余各组RFS评分与对照组比较差异无统计学意义(P>0.05)(表2)。

表2 各组RSI、RFS评分比较(分,
注:*与对照组比较,P<0.05
2.3各组咽喉部pH值监测结果 声带白斑组立位酸反流次数(8.5)、卧位酸反流次数(1.0)、总酸反流次数(10.4)、立位酸反流时间(2.0)、总酸反流时间(2.0)均显著高于对照组(P=0.011,P=0.004,P=0.015,P=0.034,P=0.027);声带任克水肿组立酸反流次数(7.0)、总酸反流次数(7.0)、立位酸暴露百分比(0.0)、总酸暴露百分比(0.0)、立位酸反流时间(2.0)、总酸反流时间(2.1)均显著高于对照组(P=0.025,P=0.039,P=0.041,P=0.030,P=0.012,P=0.011)(表3)。
2.4声带白斑组病理分型与LPR关系 将21例声带白斑患者依据病理级别分为非异型增生组(8例)、轻中度异型增生组(7例)、重度异型增生及原位癌(6例),三组间咽喉部酸反流次数、酸反流时间、酸暴露百分比差异无统计学意义(P>0.05),但有逐渐增高的趋势(表4)。
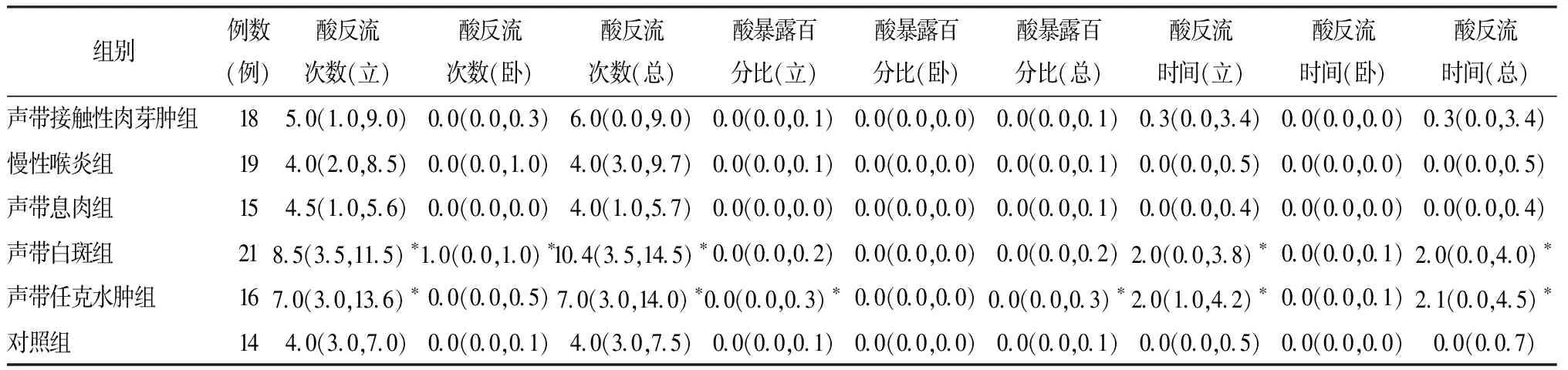
表3 各嗓音疾病组与对照组咽喉部pH值监测结果[M (P25,P75)]
注:*与对照组比较,P<0.05

表4 声带白斑组不同病理分型患者咽喉部pH值监测结果 [M (P25,P75)]
3 讨论
目前,诊断LPR的主要方法有:24小时双探头食管pH值监测、对临床症状和体征进行评估的量表,如RSI、RFS[13,14]及质子泵抑制剂(proton pump inhibitors,PPI)试验性治疗等,其中24小时双探头食管pH值监测是目前诊断LPR的金标准[15]。Koufman等[2]曾对113例发声障碍患者行24小时双探头食管pH值监测,发现50%患者存在LPR;慢性声嘶患者中经pH值监测发现LPR占62.8%[3],远高于健康对照组(30%);Beltsis等[5]发现声带小结、声带息肉、声带任克水肿、声带白斑患者中LPR阳性率为72.2%,均显著高于只有LPR相关症状无声带病变的对照组。Ozturk等[3]、Beltsis等[5]的研究中都将LPR事件>1次判断为LPR阳性,但研究发现健康人群中30%~35% LPR事件≥1次[16]。为避免假阳性,本研究以更为严格的LPR事件>6.9次为LPR阳性的标准,结果显示89例嗓音疾病(声带接触性肉芽肿、慢性喉炎、声带息肉、声带白斑、声带任克水肿)患者中LPR阳性率为48.30%, 提示这几种嗓音疾病患者可能与LPR存在一定相关性,即LPR可能对嗓音疾病的发生及转归产生影响。
反流物中的胃酸、胃蛋白酶或其他消化液成分可能对声带黏膜上皮产生慢性刺激,使其发生角化、不典型增生甚至癌变,且喉部黏膜较食管黏膜更易受到反流消化液的损伤[17]。既往有研究探讨声带白斑与LPR的相关性,认为LPR可能是发生声带白斑的危险因素之一[7]。本组患者中声带白斑组24小时双探头食管pH值监测显示LPR阳性率为71.43%,咽喉部酸反流次数、时间均显著高于无声带病变的对照组,因此推测LPR患者高频率、长时间的酸刺激可能造成声带黏膜病理改变,提示该疾病可能与LPR有一定相关性。
Lewin等[11]曾对40例喉中重度不典型增生和早期喉癌(T1、T2期)患者进行pH值监测,发现85%存在LPR,但组织病理的恶性程度和LPR严重程度并无关联;但该研究主要针对LPR阳性率与病理级别进行分析,且研究对象未包含非异型增生及轻中度异型增生患者。本组21例声带白斑患者中,非异型增生、轻中度异型增生、重度异型增生及原位癌患者之间虽然咽喉部酸反流次数、酸反流时间及酸暴露百分比差异无统计学意义,但随病理级别加重,上述监测的数值有增高的趋势,推测胃酸及胃内容物接触咽喉部越频繁,时间越长,声带黏膜上皮异型增生严重程度可能随之加重。此有待增加病例数进一步观察。
目前,声带任克水肿的病因仍不明确,已有研究显示其与吸烟、LPR、用声过度、过敏反应等[18]因素有关。Chung等[4]研究发现,声带任克水肿患者中LPR阳性率(90%)、咽喉部酸反流次数(9.1±5.9)均显著高于无声带病变的对照组,认为LPR是声带任克水肿的危险因素之一。Beltsis等[5]发现声带任克水肿患者LPR阳性率为66.7%,均显著高于健康对照组。从文中结果看,声带任克水肿患者LPR阳性率为75.00%,与既往研究结果基本相似,且声带任克水肿患者LPR阳性率、RSI评分、RFS评分、咽喉部酸反流次数、酸暴露百分比、酸反流时间均显著高于有LPR症状无声嘶的对照组,说明LPR可能是导致声带任克水肿的原因之一,与酸反流量多少、时间长短等有关。
Koufman[1]认为最常见的与LPR相关的咽喉部疾病为慢性喉炎,以杓间区的水肿、肥厚以及杓区红斑为特征;Joniau等[16]对文献进行系统回顾,发现慢性喉炎与健康对照组之间LPR阳性率无显著性差异。本组对象中慢性喉炎患者组LPR的阳性率(36.84%)与对照组(35.71%)无统计学差异,但其RSI得分显著高于对照组,提示这类患者的症状比体征更能提示是否存在LPR。
早在1968年,Cherry等[19]通过在犬喉部灌注消化液,在无其他损伤因素下犬的声带可发生接触性肉芽肿,认为该病变与LPR存在相关性。但有学者提出反流因素不是唯一产生声带接触性肉芽肿的因素,Ward等[20]发现声带突接触性肉芽肿患者多为吸烟、大量饮酒、夜间暴饮暴食、演讲人士、情绪紧张者,此类患者不仅易存在用声过度这一机械性损伤因素,同时吸烟饮酒本身也促进了LPR。本组声带接触性肉芽肿患者LPR阳性率、各反流指标与对照组比较差异无统计学意义,可能与上述多因素参与疾病的发生发展有关,今后应剔除混杂因素,增加样本数量,进一步探讨LPR与其相关性。
Chung[4]等研究发现声带息肉组LPR的阳性率与对正常照组无显著差异。本研究中,声带息肉组LPR阳性率仅为20.0%,咽喉酸反流次数、时间均较低,提示可能声带息肉与LPR相关性较低,用声过度、吸烟饮酒、激素调节等因素是否参与声带息肉的发生发展尚需进一步综合探讨。
总之,LPR在声带接触性肉芽肿、慢性喉炎、声带息肉、声带白斑、声带任克水肿等嗓音疾病患者中占有一定比例,其中声带白斑、声带任克水肿患者中LPR发生率较高,且咽喉部酸反流时间较长,次数较多,提示LPR与这两种疾病的发生有关,今后应进一步扩大样本量,设置健康对照组,可通对吸烟、饮酒、用声过度、年龄、性别、激素等多因素回归分析研究LPR是否与某类嗓音疾病相关,可能更有临床意义。
4 参考文献
1 Koufman JA. The otolaryngologic manifestations of gastroesophageal reflux disease (GERD): a clinical investigation of 225 patients using ambulatory 24-hour pH monitoring and an experimental investigation of the role of acid and pepsin in the development of laryngeal injury[J]. Laryngoscope, 1991, 101(4 Pt 2 Suppl 53):1.
2 Koufman JA, Amin MR, Panetti M. Prevalence of reflux in 113 consecutive patients with laryngeal and voice disorders[J]. Otolaryngol Head Neck Surg, 2000, 123:385.
3 Ozturk O, Oz F, Karakullukcu B, et al. Hoarseness and laryngopharyngeal reflux: a cause and effect relationship or coincidence[J]? Eur Arch Otorhinolaryngol, 2006, 263:935.
4 Chung JH, Tae K, Lee YS, et al. The significance of laryngopharyngeal reflux in benign vocal mucosal lesions[J]. Otolaryngol Head Neck Surg, 2009,141:369.
5 Beltsis A, Katsinelos P, Kountouras J, et al. Double probe pH-monitoring findings in patients with benign lesions of the true vocal folds: comparison with typical GERD and the effect of smoking[J]. Eur Arch Otorhinolaryngol , 2011, 268:1 169.
6 Havas TE, Priestley J, Lowinger DS. A management strategy for vocal process granulomas[J]. Laryngoscope, 1999, 109:301.
7 倪鑫,王晓哗,张玉焕,等. 声带白斑与胃食管咽喉反流的相关分析[J].中华医学杂志, 2008, 88:1 323.
8 Copper MP, Smit CF, Stanojcic LD, et al. High incidence of laryngopharyngeal reflux in patients with head and neck cancer[J]. Laryngoscope, 2000, 110:1 007.
9 吴修法,徐洁洁,乔明哲,等.反流性咽喉病患者嗓音声学特征分析[J].听力学及言语疾病杂志,2012,20:221.
10 华杜鹃,屈季宁,周涛.反流症状指数量表和反流体征指数量表在喉咽反流性疾病诊断中的应用研究[J].中国耳鼻咽喉头颈外科杂志,2013,20:144.
11 Lewin JS, Gillenwater AM, Garrett JD, et al. Characterization of laryngopharyngeal reflux in patients with premalignant or early carcinoma of the larynx[J]. Cancer, 2003, 97:1 010.
12 Vincent DA Jr,Garrett JD,Radionoff SL,et al.The proximal probe in esophageal pH monitoring:development of a normative database[J]. J Voice,2000,14:247.
13 Belafsky PC, Postma GN, Koufman JA. The validity and reliability of the reflux finding score (RFS)[J]. Laryngoscope, 2001, 111:1 313.
14 Belafsky PC, Postma GN, Koufman JA. Validity and reliability of the Reflux Symptom Index (RSI)[J]. J Voice, 2002, 16:274.
15 Reichel O, Hagedorn H, Berghaus A. Diagnosis and treatment of laryngopharyngeal reflux[J]. Laryngorhinootologie,2006,85:919.
16 Joniau S, Bradshaw A, Esterman A, et al. Reflux and laryngitis: A systematic review[J]. Otolaryngol Head Neck Surg, 2007, 136:686.
17 Galli J, Frenguelli A, Cal L,et al.Role of gastroesophageal reflux in precancerous conditions and in squamous cell carcinoma of the larynx: our experience[J]. Acta Otorhinolaryngol Ital,2001,21:350.
18 Zeitels SM, Hillman RE, Bunting GW, et al. Reinke's edema: phonatory mechanisms and management strategies[J]. Ann Otol Rhinol Laryngol, 1997, 106:533.
19 Cherry J, Margulies SI. Contact ulcer of the larynx[J]. Laryngoscope, 1968, 78: 1941.
20 Ward PH, Zwitman D, Hansen D. Contact ulcers and granulomas of the larynx: new insight into their etiology as a basis for more rational treatment[J]. Otolaryngol Head Neck Surg,1980,88:262.

