磁性固定化青霉素酰化酶催化拆分(R,S)- 2-氯苯甘氨酸甲酯
薛 屏,谷耀华,张立根,马 原,李 鹏
(宁夏大学 省部共建天然气转化国家重点实验室培育基地,宁夏 银川 750021)
精细化工
磁性固定化青霉素酰化酶催化拆分(R,S)- 2-氯苯甘氨酸甲酯
薛 屏,谷耀华,张立根,马 原,李 鹏
(宁夏大学 省部共建天然气转化国家重点实验室培育基地,宁夏 银川 750021)
将青霉素酰化酶(PGA)固定于饱和磁化率为6.5 emu/g、富含环氧基的大孔磁性聚合物微球(GM)上,所得磁性固定化酶PGA/GM用于在水相中催化(R,S)-2-氯苯甘氨酸甲酯(2-CGM)发生不对称水解反应;在20 ℃下反应48 h,所得(S)-2-CGM和(R)-2-氯苯甘氨酸的对映体过量值分别为98.0%和58.8%,底物总转化率为62.5%。PGA经GM固定化后,催化(R,S)-2-CGM水解反应的活性和对映体选择性均有显著提高。PGA/GM具有较强的磁响应性,在外加磁场的作用下能进行快速分离和洗涤,机械损失小;经6次循环使用,其活性和对映体选择性未出现大幅衰减。
磁性固定化青霉素酰化酶;(R,S)-2-氯苯甘氨酸甲酯;不对称水解反应;酶催化拆分;对映选择性
目前全世界开发研究的新药中手性药物占90%以上,非天然氨基酸是手性药物合成的一类重要中间体[1-3]。(S)-2-氯苯甘氨酸是具有生物活性的非天然氨基酸,(S)-2-氯苯甘氨酸甲酯(2-CGM)是治疗血栓性疾病新药氯吡格雷的关键手性结构单元[4-5]。氯吡格雷S-构型的分子具有强的血小板凝聚抑制活性,其耐受性是R-构型的40倍,且R-构型用药后会产生抽搐副作用[6-7],因此氯吡格雷是以S-构型作为药物进行销售的。采用先合成氯吡格雷外消旋体,再利用(S)-樟脑磺酸进行对映体拆分的方法[8-9],虽能得到(S)-氯吡格雷,但浪费了近50%的(R)-氯吡格雷。若以(S)-2-CGM直接合成(S)-氯吡格雷,既省去了手性试剂后拆分过程,又提高了原料的利用率和产品的质量[10-11]。而通过化学法利用(S)-酒石酸进行(R,S)-2-CGM的拆分[12-14],需使用大量的手性试剂,过程繁琐,生产效率低下。
脂肪酶催化拆分手性醇、酸及其衍生物已有许多研究报道[15-17],且取得了很好的实验结果。目前青霉素酰化酶(PGA)已能高效表达和大批量进行生产,对其催化作用的应用研究主要集中于催化水解青霉素G盐制备6-氨基青霉烷酸和催化合成新型β-内酰胺类抗生素[18-19],而用于动力学拆分手性对映体的研究较少。Fadnavis等[20]利用PGA对N-苯乙酰化氯苯甘氨酸进行催化水解,获得了光学纯(S)-氯苯甘氨酸。而利用PGA催化(R,S)-2-CGM发生不对称水解反应,获得(S)-2-CGM单一对映体的研究尚未见文献报道。
本工作将PGA固定于富含环氧基的大孔磁性聚合物微球(GM)上,获得磁性固定化酶PGA/ GM,研究了PGA/GM对(R,S)-2-CGM发生不对称水解反应的催化作用。
1 实验部分
1.1 酶与试剂
PGA:380 U/mL,浙江顺风海德尔公司;假单胞菌脂肪酶(PSL):30 U/mg,Amano公司;柱状假丝酵母脂肪酶(CCL):4.01 U/mg,Fluka公司;南极假丝酵母脂肪酶(CAL-B):10.8 U/mg,Fluka公司;(R,S)-2-氯苯甘氨酸:化学纯,武汉远成共创科技有限公司;甲基丙烯酸缩水甘油酯:化学纯,Fluka公司;N,N′-亚甲基双丙烯酰胺、偶氮二异丁腈:化学纯,天津科密欧化学试剂开发中心;FeCl2·4H2O和FeCl3·6H2O:分析纯,天津福晨化学试剂厂;Span 60、硬脂酸钙、二氯亚砜:化学纯,上海润捷化学试剂有限公司;其他试剂均为国产分析纯。
1.2 Fe3O4磁粉的制备
Fe3O4磁粉的制备采用共沉淀法:将摩尔比1∶2的FeCl2·4H2O和FeCl3·6H2O溶于去离子水中,搅拌下滴入浓氨水至pH为8.5,于60 ℃下熟化30 min后过滤,固体用去离子水洗涤4次后于60 ℃下真空干燥,得到黑色Fe3O4磁粉。
1.3 GM的制备和表征
1.3.1 GM的制备
在装有温度计、恒速搅拌器、回流管及导气管的四颈瓶中加入110 mL正庚烷和40 mL四氯乙烯,搅拌下加入硬脂酸钙和Span 60复合表面活性剂(二者质量比20∶1),混合均匀。在甲酰胺分散0.6 g Fe3O4磁粉的体系中加入2.5 mL甲基丙烯酸缩水甘油酯和4.0 g N,N′-亚甲基双丙烯酰胺,混合均匀后转移至四口烧瓶中。在60 ℃水浴加热、氮气保护及偶氮二异丁腈引发下反应5 h。停止反应后在磁场中沉降分离出小球。小球用丙酮洗涤后,室温真空干燥至恒重,得到GM。
1.3.2 GM的表征
SEM表征采用JEOL公司JSM-6360LV型扫描电子显微镜,测试前试样进行喷金处理;TEM表征采用JEOL 公司JME-2010型透射电子显微镜,测试前试样在聚乙烯醇水溶液中超声波振荡分散处理后,取液滴于喷有炭膜的铜网上并进行干燥;比表面积、平均孔径和孔体积的测定采用Micromeritics公司ASAP-2010型自动物理吸附分析仪,N2吸附质,测定前试样在50 ℃下真空脱气10 h;磁化曲线采用Lake Shore 公司7304型振动试样磁强计(VSM)测定,磁场强度范围(-1.6~1.6)×106A/ m;表面环氧基团的含量采用硫代硫酸钠滴定法[21]测定。
1.4 PGA/GM的制备
称取0.1 g GM,用去离子水润湿、溶胀、吸去表面水后,依次加入2.0 mL pH=7.8的磷酸盐缓冲溶液和0.2 mL PGA溶液,于转速100 r/min的水浴摇床中30 ℃下反应72 h,制备PGA/GM。在磁场中分离出PGA/GM并用去离子水洗至分离液中检不出蛋白质,然后将PGA/GM浸泡于pH=7.8的磷酸盐缓冲溶液中储于冰箱(4 ℃)中备用。
1.5 (R,S)-2-CGM的合成与水解反应
1.5.1 (R,S)-2-CGM的制备
在装有搅拌器、温度计和恒压滴液漏斗的三口烧瓶中加入100 mL甲醇和18.5 g (R,S)-2-氯苯甘氨酸,搅拌下冰水浴冷却至0 ℃,滴加13 mL的二氯亚砜,缓慢加热至50 ℃,搅拌下恒温反应6 h;减压蒸馏出过量的甲醇和二氯亚砜,剩余物用甲醇-乙醚二元溶剂进行重结晶得到(R,S)-2-氯苯甘氨酸甲酯盐酸盐白色晶体,在晶体中加入适量的饱和碳酸氢钠水溶液至pH=8,静置2 h后分液,用二氯甲烷溶剂萃取后减压蒸馏得到浅黄色液体(R,S)-2-CGM。
采用Bruker公司Advance Ⅲ型核磁共振仪(400 MHz)对制备的(R,S)-2-CGM进行NMR分析确认。1H NMR(CDCl3)分析结果:化学位移δ=7.39~7.24(4H,m,ArH),5.01(1H,s,CH),3.72(3H,s,CH3),1.98(2H,s,NH2);13C NMR(CDCl3)分析结果:δ=173.9,138.1,133.3,129.9,129.2,128.5,127.4,56.1,52.3。
1.5.2 (R,S)-2-CGM的水解反应
在50 mL反应器中依次加入0.1 g (R,S)-2-CGM、10 mL磷酸盐缓冲溶液(0.1 mol/L,pH=7.8)和0.1 g PGA/GM,置于一定温度的水浴摇床中在转速120 r/min下进行反应,一定时间后在磁场中分离出PGA/GM结束反应。反应液由装有进口手性柱Daicel CrownpackCR(+)的FL-2200-2型高效液相色谱仪(浙江福立分析仪器有限公司)进行分析,波长220 nm。

(S)-2-CGM和(R)-2-氯苯甘氨酸的对映体过量值分别用ees和eep表示,计算方法见式(1)和式(2):式中,cSS和cRS分别为(S)-2-CGM和(R)-2-CGM的浓度,mol/L;cRP和cSP分别为(R)-2-氯苯甘氨酸和(S)-2-氯苯甘氨酸的浓度,mol/L。
底物总转化率(X)和对映选择性参数(E)值分别按式(3)和式(4)计算[22]:
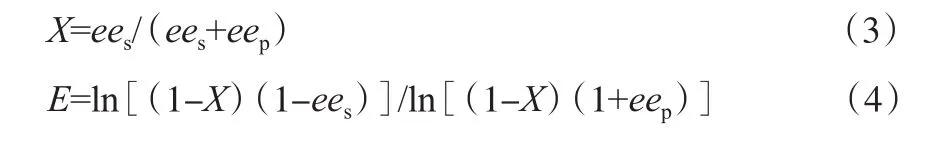
2 结果与讨论
2.1 GM的特性
在GM的形成过程中,单体甲基丙烯酸缩水甘油酯的双键发生聚合反应,绝大多数的环氧基团保留在GM表面和体相[23],利用硫代硫酸钠滴定法测定GM表面环氧基团含量为0.61 mmol/g。经低温N2吸附法测定,GM具有多孔结构,比表面积为136 m2/g,平均孔径和孔体积分别为28.2 nm和0.50 m3/g。
GM的SEM和TEM照片见图1。由图1a可知,制备的GM呈很好的球形,微球之间不粘连且分布较均匀,球径主要在100~200 μm内。由图1b可看出,GM中Fe3O4颗粒大小在10 nm左右,其周围包裹着聚合物层。

图1 GM的SEM(a)和TEM(b)照片Fig.1 SEM(a) and TEM(b) images of GM.
VSM测定结果表明,GM具有超顺磁性,饱和磁化率为6.43 emu/g。由于GM中的Fe3O4颗粒被分散包埋在甲基丙烯酸缩水甘油酯与N,N′-亚甲基双丙烯酰胺交联聚合的网络中,削弱了Fe3O4颗粒之间的磁相互作用力,致使GM用作酶固定化载体以及制备的PGA/GM在使用过程中没有出现磁聚集现象。
2.2 不同酶催化性能的比较
脂肪酶和PGA均属于水解酶,二者对酯类的水解反应均具有活性。在相同的反应条件下,对PGA和几种脂肪酶水解(R,S)-2-CGM的催化性能进行了对比,实验结果见表1。
水解产物的分析结果表明,来自不同菌种的脂肪酶PSL,CCL,CAL-B,在20 ℃时均能催化(R,S)-2-CGM发生水解反应。反应48 h时,90%以上的(R,S)-2-CGM发生了水解反应转化为(R,S)-2-氯苯甘氨酸,其中,底物(S)-2-CGM优先水解,但生成的S-构型与R-构型的2-氯苯甘氨酸的数量相差很小(前者略多于后者),剩余底物(R,S)-2-CGM中S-构型与R-构型的含量十分接近。这意味着PSL,CCL,CAL-B这3种脂肪酶虽均能催化(R,S)-2-CGM发生水解反应,但对(R)-2-CGM和(S)-2-CGM的识别性很低,导致S-构型与R-构型的底物均发生了反应,水解反应的对映选择性低。由表1可看出,(S)-2-CGM的ees和(R)-2-氯苯甘氨酸的eep均呈负值,且绝对值均低于3%。

表1 几种酶对(R,S)-2-CGM水解反应的催化性能Table 1 Catalytic performances of several enzymes for the hydrolysis of (R,S)-2-chlorophenyl glycine methyl ester(2-CGM)
由表1还可看出,与脂肪酶不同,PGA优先催化底物中的(R)-2-CGM发生水解,且对两种构型2-CGM底物的对映体选择性远高于脂肪酶。游离酶PGA在20 ℃下催化水解反应48 h时,(S)-2-CGM的ees为50.4%,(R)-2-氯苯甘氨酸的eep为23.5%,这说明PGA能很好地识别不同构型的2-CGM底物,主要是优先选择性地催化(R)-2-CGM发生水解反应。PGA经GM固定化后,其水解活性和对映体选择性均得到大幅提高,在相同的反应条件下,PGA/GM催化(R,S)-2-CGM发生水解反应,(S)-2-CGM和(R)-2-氯苯甘氨酸的ees和eep分别为98.0%和58.8%,E值为9.4,底物总转化率为62.5%。
2.3 水解反应条件的优化
在不同温度下进行水解反应,测定不同时间内PGA/GM催化(R,S)-2-CGM发生水解反应的转化率以及生成(S)-2-CGM和(R)-2-氯苯甘氨酸的ees和eep,实验结果见表2。由表2可知,升高水解温度或延长反应时间,(R)-2-氯苯甘氨酸的eep均呈下降趋势。说明PGA/GM对两种构型2-CGM底物的识别性随反应温度的升高或反应时间的延长而减弱,其原因可能是在相对较高的温度或较长时间内进行反应,酶的刚性结构变得柔韧,导致其对映体选择性下降[24]。
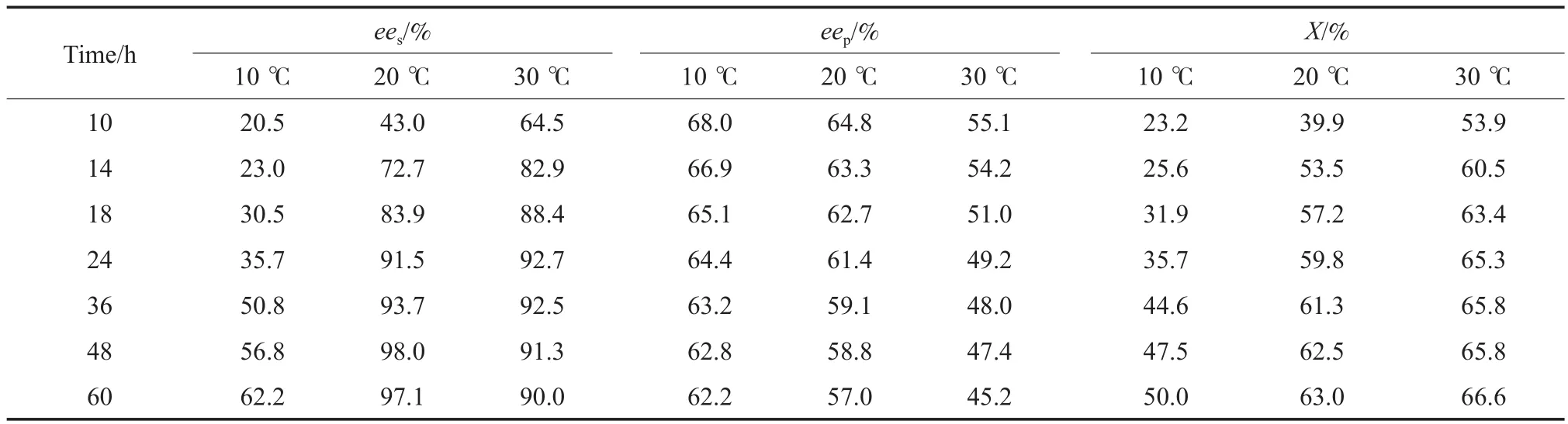
表2 反应温度和时间对PGA/GM催化(R,S)-2-CGM水解反应的影响Table 2 Effects of reaction temperature and time on enantioselectivity of the asymmetric hydrolysis of (R,S)-2-CGM with the PGA/GM catalyst
从目标产物(S)-2-CGM的ees变化可看出,控制反应时间在36 h以内时,反应温度由10 ℃升至30 ℃,(S)-2-CGM的ees逐渐增大。这是由于升高反应温度提高了PGA/GM催化(R)-2-CGM水解反应的速率。但在30 ℃下反应时间过长(36 h以上)时,PGA/GM的对映体选择性下降,导致(S)-2-CGM的ees下降,反而不利于(S)-2-CGM光学纯度的提高。综合考虑反应温度和时间等因素,利用PGA/GM催化(R,S)-2-CGM发生不对称水解反应的适宜条件为20 ℃和48 h时,在此条件下可获得ees为98.0%的(S)-2-CGM。
2.4 PGA/GM的稳定性
在优化的反应时间和温度下,将PGA/GM重复用于(R,S)-2-CGM水解反应,每次反应后在磁场中分离出PGA/GM,用0.1 mol/L、pH=7.8的磷酸盐缓冲溶液洗涤3次后,再次用于(R,S)-2-CGM水解反应,重复使用6次(使用间歇时可在4 ℃下储存),考察PGA/GM的稳定性。实验结果见图2。
由图2可知,PGA/GM重复使用6次后所得(S)-2-CGM的ees仍达93.2%,呈现出良好的稳定性。这是由于Fe3O4磁性粒子分散包埋于GM中,使PGA/GM在使用中不存在磁性物质普遍存在的自聚现象。GM表面存在大量的环氧基团和强亲水性的酰胺基团,它们为PGA/GM催化水解反应的活性和对映体选择性的发挥提供了适宜的微环境。GM借助自身的活性环氧基团共价结合固定PGA,使PGA与载体结合相对牢固,在磁场作用下PGA/GM快速沉降,经多次使用并经分离洗涤几乎没有机械操作损失。由此可见,PGA经GM固定化后,不仅活性和对映体选择性得到了提高,同时具备很好的稳定性,可重复用于(R,S)-2-CGM的水解反应。
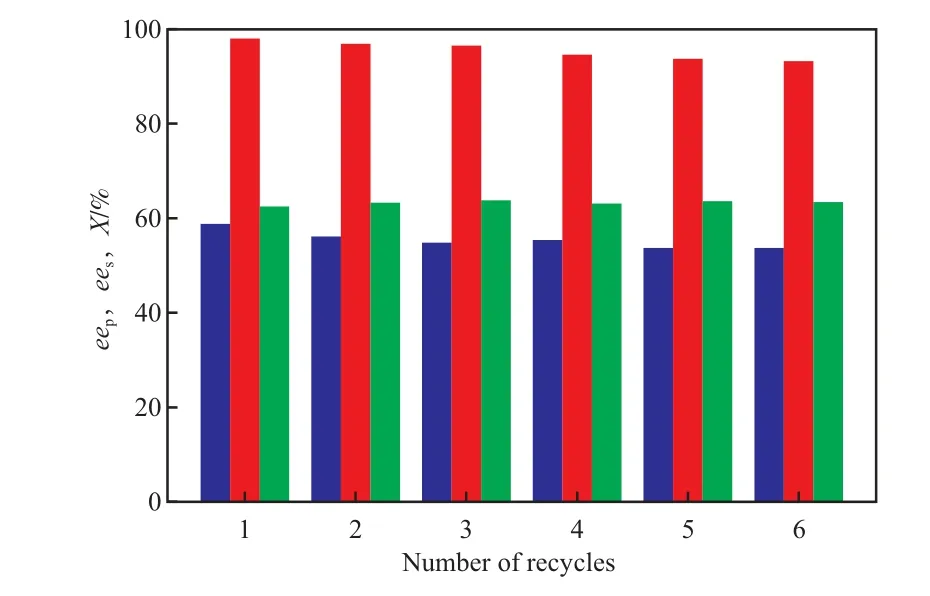
图2 PGA/GM的稳定性Fig.2 Stability of PGA/GM.
3 结论
1) PGA催化(R,S)-2-CGM水解反应时,优先催化底物中的(R)-2-CGM发生水解反应;PGA经GM固定化后,其活性和对映体选择性均得到大幅提高。
2)利用PGA/GM催化(R,S)-2-CGM水解反应,是一种环境友好的制备氯吡格雷关键手性中间体(S)-2-CGM的新方法,在20 ℃下反应48 h,所得(S)-2-CGM和(R)-2-氯苯甘氨酸的ees和eep分别为98.0%和58.8%,底物总转化率达62.5%。
3)PGA/GM重复用于(R,S)-2-CGM水解反应,在磁场作用下分离和洗涤后循环使用6次,所得(S)-2-CGM的ees仍达93.2%,呈现出良好的稳定性,具有工业化应用前景。
[1] Busto E,Gotor-Fernández V,Gotor V. Hydrolases in the Stereoselective Synthesis of N-Heterocyclic Amines and Amino Acid Derivatives[J]. Chem Rev,2011,111(7):3998 - 4035.
[2] Strompen S,Wei B M,Ingram T,et al. Kinetic Investigation of a Solvent-Free,Chemoenzymatic Reaction Sequence Towards Enantioselective Synthesis of a β-Amino Acid Ester[J]. Biotechnol Bioeng,2012,109(6):1479 - 1489.
[3] Lee J S,Kim D,Lozano L,et al. Concise Asymmetric Synthesis of Orthogonally Protected Syn- and Anti-1,3-Aminoalcohols[J]. Organic Lett,2013,15(3):554 - 557.
[4] Angiolillo D J,Fernandez-Ortiz A,Bernardo E,et al. Variability in Individual Responsiveness to Clopidogrel[J]. J Am Coll Cardiol,2007,49(14):1505 - 1516.
[5] Campo G,Fileti L,Cesare N D,et al. Long-Term Clinical Outcome Based on Aspirin and Clopidogrel Responsiveness Status After Elective Percutaneous Coronary Intervention[J]. J Am Coll Cardiol,2010,56(18):1447 - 1455.
[6] Sanof . Process for the Preparation of α-Bromo-Phenylacetic Acids:US,5036156[P]. 1991-07- 03.
[7] Kim S D,Kang W,Lee H W,et al. Bioequivalence and Tolerability of Two Clopidogrel Salt Preparations,Besylate and Bisulfate: A Randomized,Open-Label,Crossover Study in Healthy Korean Male Subjects[J]. Clin Ther,2009,31(4):793 - 803.
[8] Teva Pharmaceutical Industries Ltd. Racemization and Enantiomer Separation of Clopidogrel:US,6800759B2[P]. 2004-10-05.
[9] Sanofi. Clopidogrel and Salts Such as Clopidogrel Hydrogen Sulfate;Anticoagulants:US,4847265[P]. 1989-07-11.
[10] SK Chemicals Co Ltd. Process for the Preparation of S-(+)-Clopidogrel by Optical Resolution:US,696351[P]. 2010-04-13.
[11] Ferraboschi P,Mieri M D,Galimberti F. Chemo-Enzymatic Approach to the Synthesis of the Antithrombotic Clopidogrel[J]. Tetrahedron:Asymetry,2010,21(17):2136 - 2141.
[12] 丁桂厘,赵敏,吴范宏,等. 邻氯苯甘氨酸甲酯的拆分[J].广州化工,2007,35(6):44 - 48.
[13] DR Reddy S Laboratories Limited. Process for Preparing Clopidogrel:US,20070225320[P]. 2007-09-27.
[14] Arinivasa Reddy Battula. A Process for Resolution of Methylamino(2-Chlorophenyl)Acetate:WO,2006003671[P]. 2006-01-12.
[15] 白鹏,李晓峰,朱良伟,等. 手性化合物1,1′-联二萘酚的合成及其在不对称氧化还原反应中的应用[J]. 石油化工,2005,34(9):891 - 897.
[16] Machado A C O,Da Silva A A T,Borges C P,et al. Kinetic Resolution of (R,S)-1,2-Isopropylidene Glycerol(Solketal)Ester Derivatives by Lipases[J]. J Mol Catal B:Enzym,2011,69(1):42 - 26.
[17] 薛屏,王居兰,李鹏. 固定化酶球形高分子载体的设计与应用[J]. 石油化工,2010,39(1):7 - 12.
[18] Xue Ping,Xu Fang,Xu Lidong. Epoxy-Functionalized Mesostructured Cellular Foams as Effective Support for Covalent Immobilization of Penicillin G Acylase[J]. Appl Surf Sci,2008,255(5):1625 - 1630.
[19] Du Lili,Wu Qi,Chen Chunxiu,et al. A Two-Step,One-Pot Enzymatic Synthesis of Ampicillin from Penicillin G Potassium Salt[J]. J Mol Catal B:Enzym,2009,58(1):208 - 211.
[20] Fadnavis N W,Devi A V,Jasti L S. Resolution of Racemic 2-Chlorophenyl Glycine with Immobilized Penicillin G Acylase[J]. Tetrahedron:Asymetry,2008,19(20):2363 - 2366.
[21] Sundberg L,Porath J. Preparation of Adsorbents for Biospecific Affinity Chromatography[J]. J Chromator,1974,90(1):87 - 98.
[22] Chen C S,Fujimoto Y,Girdaukas G. Quantitative Analyses of Biochemical Kinetic Resolutions of Enantiomers[J]. J Am Chem Soc,1982,104(25):7294 - 7299.
[23] 薛屏,刘海峰. 亲水性含环氧基磁性聚合物微球的制备与性能表征[J]. 高分子学报,2007,25(1):64 - 69.
[24] Sakai T,Matsuda A,Tanaka Y,et al. The Effect of Temperature on the Lipase-Catalyzed Asymmetric Protonation of 1-Acetoxy-2-Methylcyclohexene Giving(R)-2-Methylcyclohexanone[J]. Tetrahedron:Asymetry,2004,15(12): 1929 - 1932.
(编辑 安 静)
Enzymatic Resolution of (R,S)-2-Chlorophenyl Glycine
Methyl Ester with Magnetically Immobilized Penicillin G Acylase
Xue Ping,Gu Yaohua,Zhang Ligen,Ma Yuan,Li Peng
(State Key Laboratory Cultivation Base of Natural Gas Conversion,Ning Xia University,Yinchuan Ningxia 750021,China)
Penicillin G acylase(PGA) was immobilized on self-made magnetic polymer microspheres(GM) with epoxy groups,macropores and saturation magnetization of 6.5 emu/g to prepare the PGA/GM magnetic immobilized enzyme. The kinetic resolution of racemic (R,S)-2-chlorophenyl glycine methyl ester(2-CGM) through the hydrolysis catalyzed by PGA/GM were investigated. The enantiomeric excess values of (S)-2-CGM and (R)-2-chlorophenyl glycine were 98.0% and 58.8% respectively,and the conversion of (R,S)-2-CGM were 62.5% in the enzymatic hydrolysis under the conditions of 20 ℃ and 48 h. It was observed that the activity and enantioselectivity of PGA for the asymmetric hydrolysis of (R,S)-2-CGM were improved signif cantly by the immobilization. The immobilized enzyme could be recovered easily without mechanical loss and considerably kept its initial activity and enantioselectivity after it was reused six times.
magnetically immobilized Penicillin G acylase;(R,S)-2-chlorophenyl glycine methyl ester; asymmetric hydrolysis; enzymatic resolution; enantioselectivity
1000 - 8144(2014)11 - 1284 - 06
TQ 426.97
A
2014 - 05 - 21;[修改稿日期] 2014 - 07 - 23。
薛屏(1962—),女,内蒙古自治区锡林浩特市人,博士,教授,电话 0951 - 2062835,电邮 ping@nxu.edu.cn。
国家自然科学基金项目(21263020);国家重点基础研究发展计划前期研究专项项目(2012CB723106)。

