内含肽介导的鼠多瘤病毒样颗粒生产表达和纯化
董晓燕,刘晓丹,张 麟(天津大学化工学院,天津 300072)
内含肽介导的鼠多瘤病毒样颗粒生产表达和纯化
董晓燕,刘晓丹,张 麟
(天津大学化工学院,天津 300072)
鼠多瘤病毒样颗粒(VLPs)可由结构蛋白VP1自组装而成,可用于疫苗开发、基因治疗、药物传递和生物材料等方面.针对目前VP1生产中需要凝血酶去除谷胱甘肽S-转移酶(GST)标签,生产成本较高、操作复杂的问题,利用内含肽(intein)自剪切的特征,将内含肽插入到VP1与GST标签之间进行融合表达,表达产物经亲和色谱纯化,并通过改变柱内pH值、温度诱导内含肽剪切,使VP1与GST-intein分离从而获得VP1蛋白,产量为4,mg/(L培养基).纯化的VP1可自组装成与天然鼠多瘤病毒样颗粒一致的VLPs.结果表明,内含肽介导鼠多瘤病毒样颗粒生产纯化流程简单易行,且无需凝血酶参与,大幅降低成本,为VLPs的高效制备奠定了基础.
鼠多瘤病毒;病毒样颗粒;亲和色谱;VP1;自组装;内含肽;自剪切
病毒样颗粒(virus-like particles,VLPs)[1]是由一种或多种病毒结构蛋白自组装所形成的空心颗粒,由于其缺乏病毒基因组,且具有与天然病毒接近的结构特征和免疫原性,因此它能诱导免疫应答反应而无感染性,特别适合进行相关疫苗的研发.目前已有多种不同VLPs疫苗的研究报道,其中能够成功抵御乙型肝炎病毒[2]和人乳头状瘤病毒的VLPs疫苗已应用于临床[3-4].此外,其应用不仅限于自身病毒的VLPs疫苗研究,还可作为载体平台用于其他病原的疫苗研究,形成嵌合VLPs疫苗[5]或偶联VLPs疫苗[6].同时,由于VLPs独特的空壳结构,近年来在基因治疗[7]、药物传递[8]和新型生物材料[9-10]等方面的研究也取得了一定突破.
鼠多瘤病毒(murine polyomavirus,MPV)属于多瘤病毒属,为无包膜的闭环双链DNA病毒,是二十面立体对称(T=7d)结构,粒径约为50,nm[11];病毒衣壳包含3种结构蛋白,即VP1、VP2和VP3,其中VP1蛋白是最主要的结构蛋白[12];5个VP1通过二硫键连接形成五聚体(capsomere)的衣壳粒,72个衣壳粒自组装成VLPs[1].由于对鼠多瘤病毒的研究较为深入,且其结构较为简单、形成过程比较清楚,因此成为VLPs研究的重要模型.
VP1可在真核的酵母细胞[13]和昆虫细胞[14]中表达并组装成VLPs,但此类VLPs中常包裹杂质且粒径不均一,在后期的分离纯化过程中还需要对其进行去组装和再组装,不仅增加了操作的复杂性,降低了生产效率,且提高了成本,因此不适合大规模生产[15].然而,若在原核的大肠杆菌中表达VP1,虽然其能在胞内自组装成衣壳粒,但不会继续组装成VLPs,这样便可在分离纯化后进行VLPs的体外组装,从而提高生产效率、降低成本,是目前研究的重点[12,16].研究人员尝试使用各种方法提高VP1在大肠杆菌中的表达量,其中最有效的方法是将VP1与谷胱甘肽S-转移酶(GST)标签进行融合表达[17-18],随后利用GST亲和色谱将融合蛋白与其他物质分离,再用凝血酶切去标签得到VP1.此方法虽然可获得较纯的VP1,但凝血酶价格昂贵且容易导致对目标蛋白错误剪切,因此表达和纯化成本高、效率低,阻碍其大规模生产和应用.
内含肽(intein)[19-20]是蛋白质翻译产物在成熟过程中靠自我剪切的方式从前体蛋白中分离出来的一段多肽.经过定点突变修饰后的内含肽经诱导能够介导N端或C端单侧肽键断裂,已成功用于蛋白质的分离纯化[21-22].为了简便且经济地得到VP1,本研究借助内含肽介导的蛋白质纯化技术步骤少、避免使用凝血酶切割标签的优势,构建内含肽介导的VP1表达纯化流程,将内含肽基因序列插入到GST和VP1基因序列之间,通过大肠杆菌表达GST-intein-VP1融合蛋白,再利用GST亲和色谱进行纯化并诱导内含肽柱内剪切,将分离得到的VP1体外自组装成VLPs.该流程有望简化鼠多瘤病毒样颗粒的生产纯化流程并大幅降低成本,为VLPs的研究、生产和应用奠定基础.
1 材料和方法
1.1 材料
质粒pTWINⅠ购自NEB;表达质粒pGEX-4T-1-VP1由北京华大基因公司构建,本实验室保藏;E.coli DH5α、E.coli BL21(DE3)、T4,DNA连接酶、Fast-pfu DNA聚合酶、限制性内切酶BamHⅠ和EcoRⅠ、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自TIANGEN公司;蛋白marker购自全式金公司;DNA marker购自TaKaRa公司;GSTrap HP column购自GE Healthcare Bio-sciences公司;胰蛋白胨、酵母提取物购自OXOID公司;异丙基β-D-硫代半乳糖苷(IPTG)购自Genview公司;丙烯酰胺、过硫酸铵、TEMED等试剂均为国产分析纯;透析袋购自北京鼎国生物技术有限公司.
PCR引物合成由北京华大基因合成;重组质粒DNA序列由北京天一辉远生物技术公司测定.
LB固体培养基:10,g/L胰蛋白胨,5,g/L酵母提取物,10,g/L NaCl,15,g/L琼脂粉,含100,μg/mL氨苄青霉素.TB液体培养基:12,g/L胰蛋白胨,24,g/L酵母提取物,0.4%(体积分数,下同)甘油,2.31,g/L KH2PO4,12.54,g/L K2HPO4,含100,μg/mL氨苄青霉素.
1.2 方法
1.2.1 pGEX-4T-1-intein-VP1表达载体构建和鉴定
采用PCR法从pTWINⅠ质粒上扩增出Ssp DnaB intein基因片段,根据质粒情况设计引物:上游5’-CGGGATCC GCTATCTCTGGCGATAGTC-3’,下游5’-GGAATTC GTTGTGTACAATGATGATGTCATT C-3’(下划线分别为BamHⅠ、EcoRⅠ酶切位点).PCR反应体系为:2,ng pTWINⅠ模板,10,pmol上、下游引物,30,U Fast-pfu DNA聚合酶,ddH2O补齐至25,μL.反应条件为:94,℃预变性2.0,min,94,℃变性0.5,min,51,℃退火0.5,min,72,℃延伸0.5,min,30个循环后72,℃延伸10,min.PCR产物Ssp DnaB intein基因片段中第272位包含DraⅠ酶切位点,因此用DraⅠ酶切鉴定.
通过1.5%琼脂糖凝胶回收PCR产物.将胶回收到的Ssp DnaB intein基因片段和pGEX-4T-1-VP1质粒分别用BamHⅠ和EcoRⅠ双酶切,酶切产物分别经1.5%和1.0%琼脂糖凝胶电泳纯化后回收,之后将二者混合,加入T4,DNA连接酶于16,℃反应4,h,构建出pGEX-4T-1-intein-VP1表达载体(见图1).取连接产物转化E.coli DH5α感受态细胞,通过氨苄青霉素抗性筛选阳性克隆,用BamHⅠ和EcoRⅠ酶切鉴定阳性克隆,并对初步筛选出的阳性克隆的DNA序列进行测定.
1.2.2 融合蛋白表达
培养基及培养条件参照文献[18, 23].将鉴定序列正确的重组质粒pGEX-4T-1-intein-VP1转化至E.coli BL21(DE3)感受态细胞,涂布于LB平板上37,℃过夜培养.挑取单菌落接种于25,mL的TB培养基中,置于37,℃摇床170,r/min过夜培养.将种子液按1∶100比例接种到250,mL TB培养基中扩大培养,37,℃、170,r/min培养至OD600为0.5~0.6时加入IPTG(最终浓度0.3,mmol/L),26,℃诱导24,h.
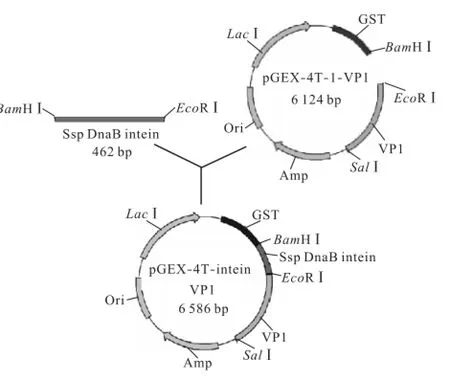
图1 pGEX-4T-1-intein-VP1重组质粒的构建示意Fig.1 Construction strategyof recombinant plasmid pGEX-4T-1-intein-VP1
取培养后的菌液于4,℃、4,500,r/min离心,收集菌体,加入100,mL预冷的平衡缓冲液(40,mmol/L Tris-HCl,200,mmol/L NaCl,1,mmol/L EDTA,5%甘油,5,mmol/L DTT,pH 8.0)重悬菌体,置冰水浴中超声破碎(400,Hz,40%输出功率,工作4,s,间歇6,s,90个循环),4,℃、12,000,r/min离心30,min,分别取全菌、上清、沉淀用SDS-PAGE分析蛋白的表达情况.1.2.3 内含肽的剪切和VP1的亲和纯化
取30,mL上述破菌上清,首先以0.5,mL/min流速上样至预先用平衡缓冲液平衡的GSTrap HP column色谱柱(5,mL)中,带GST标签的融合蛋白吸附在介质上,而杂蛋白洗脱,然后用5倍柱体积的平衡缓冲液冲洗色谱柱直至基线平稳;之后改变柱内pH值,将流动相变为剪切缓冲液(40,mmol/L Tris-HCl,200,mmol/L NaCl,1,mmol/L EDTA,5%甘油,5,mmol/L DTT,pH 7.0),待剪切液完全充满色谱柱后关闭色谱柱出入口,诱导内含肽在柱内发生剪切,以分离得到VP1(见图2).
内含肽剪切需要合适的pH值和温度,为了得到最佳的剪切效果,本文从剪切液pH值(7.0、8.0、9.0)、剪切温度(4,℃、25,℃、37,℃)、剪切时间(0,h、14,h、24,h、36,h、48,h、60,h)3个方面进行了优化.

图2 内含肽介导的VP1纯化过程Fig.2 Process of intein-mediated VP1 purification
1.2.4 VLPs的自组装
使用截留分子质量为8,000~14,000,ku的透析袋[18],通过两步透析法使VP1组装成VLPs:①将纯化的VP1溶液加入透析袋,置于组装缓冲液1(500,mmol/L(NH4)2SO4,20,mmol/L Tris-HCl,5%(体积分数)甘油,1,mmol/L CaCl2,pH 7.4)中透析17,h;②将透析袋置于组装缓冲液2(200,mmol/L NaCl,20,mmol/L Tris-HCl,5%甘油,1,mmol/L CaCl2,pH 7.4)中继续透析24,h.
1.2.5 VLPs形态学分析
VP1经两步透析组装成VLPs后,取10,μL VLPs样品滴于碳膜包被的铜网上,室温放置,待铜网干燥后,在铜网上滴2滴2%的磷钨酸(pH 7.0)负染15,min,用Tecnai G2,F20场发射电子显微镜观察样品形态.
2 结果与讨论
2.1 重组质粒pGEX-4T-1-intein-VP1的构建
利用第1.2.1节所述方法PCR扩增出的Ssp DnaB intein基因片段经琼脂糖凝胶电泳后发现条带位于500,bp前方,与预期片段大小(462,bp)一致;PCR产物经DraⅠ酶切后得到2个片段(200,bp和272,bp)在200,bp附近(见图3(a)).因此初步判断扩增的PCR产物是预期的目标片段.
将Ssp DnaB intein基因片段插入pGEX-4T-1-VP1质粒后,转化感受态细胞,筛选出的阳性克隆重组质粒用BamHⅠ和EcoRⅠ酶切进行验证,酶切后在500,bp前方有Ssp DnaB intein目标条带(见图3(b)),表明Ssp DnaB intein基因已经正确插入表达质粒中.对酶切鉴定后的阳性克隆进行全基因测序,结果100%正确(结果未显示).
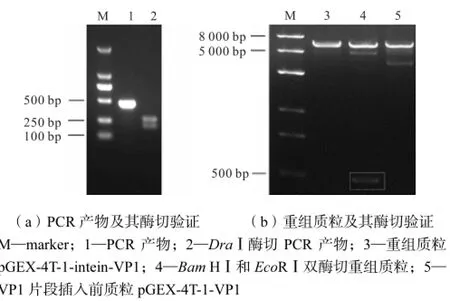
图3 PCR产物及重组质粒的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of PCR product and recombinant plasmid
2.2 融合蛋白GST-intein-VP1的表达
用筛选出的阳性克隆挑取单菌落接种于TB培养基过夜培养,之后扩大培养,在OD600达到0.5~0.6时加入IPTG诱导GST-intein-VP1融合蛋白表达(见图4条带1~3).从条带2看出融合蛋白多数在沉淀中形成包涵体,而且在预实验中发现,融合蛋白中内含肽的剪切效率较低,仅为10%.因为与内含肽C端相邻的目标蛋白的第1个氨基酸对内含肽切割效率有很大影响[24],为了提高切割效率,随后将与内含肽C端相邻的第1个氨基酸由Gln突变为有利于剪切的Gly[20].研究发现突变后融合蛋白可溶表达(见图4条带4~6),表达量为(95±5),mg/(L培养基).

图4 融合蛋白表达结果的SDS-PAGE分析Fig.4 SDS-PAGE analysis of fusion protein expression
2.3 切割条件的确定
为了得到最佳的剪切效果,从剪切时间、剪切液pH值、温度3方面对剪切条件进行优化(见图5).从图5中可以看出,融合蛋白切割量随时间的延长而增加,但切割时间超过36,h后不再增加;在pH7.0、37,℃时,切割效率与其他条件相比较高,但考虑到37,℃长时间放置蛋白容易变性,且37,℃与25,℃相比切割效率相差不大,因此选择在pH 7.0、25,℃切割36,h.
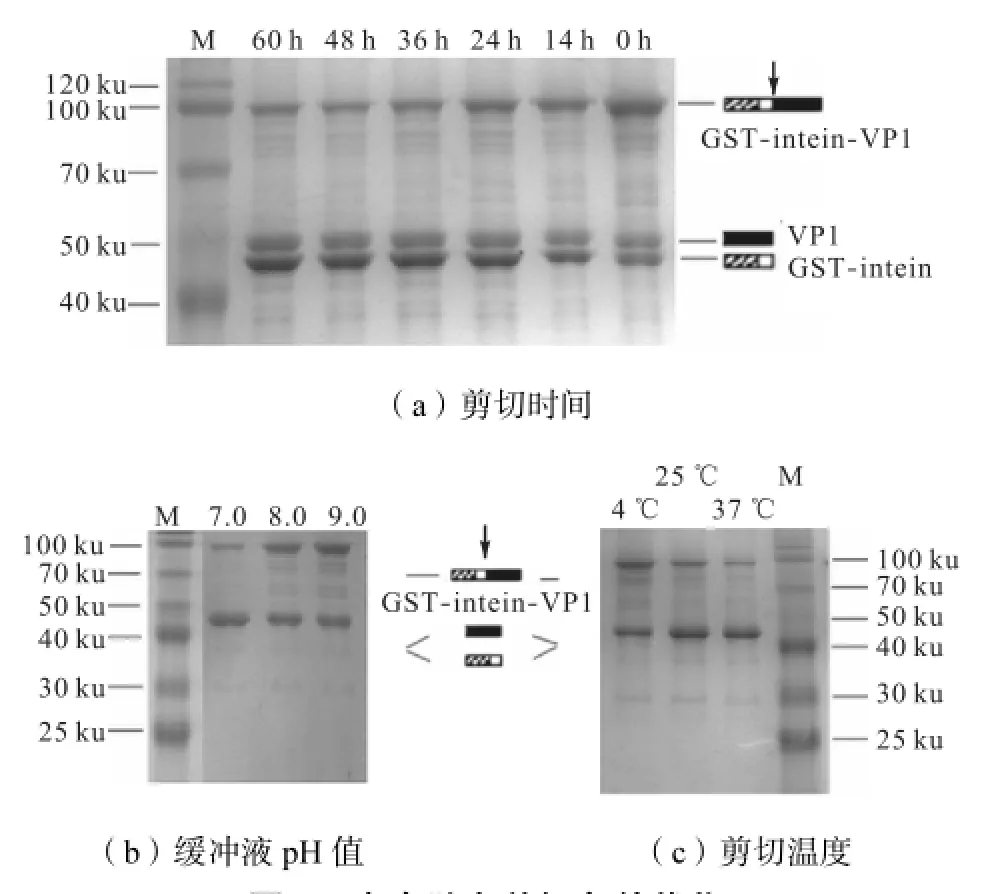
图5 内含肽自剪切条件优化Fig.5 Optimal conditions of intein self-cleavage
2.4 融合蛋白的剪切和亲和纯化
剪切液在吸附有融合蛋白的亲和色谱中停留36,h后用平衡缓冲液洗脱剪切下来的VP1,收集洗脱液,并对洗脱液做SDS-PAGE分析(见图6).
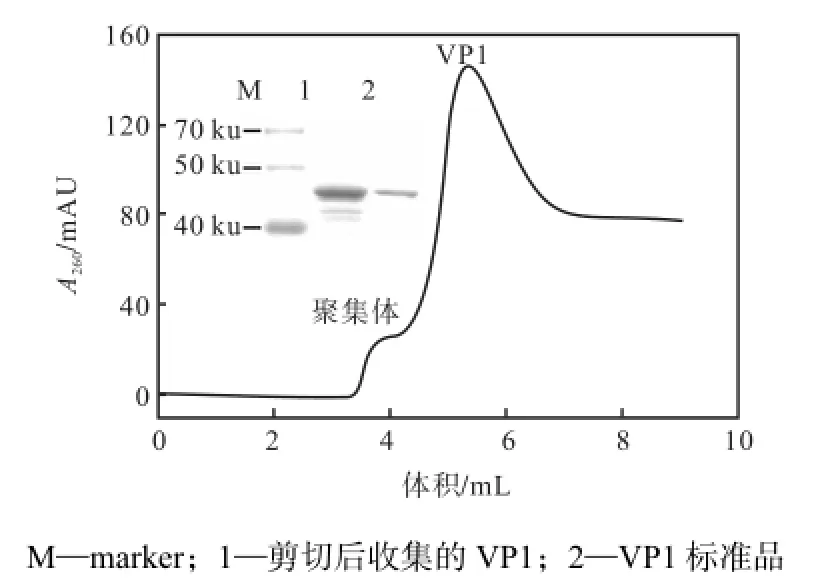
图6 内含肽柱内剪切后纯化VP1的结果Fig.6Result of purificated VP1 after intein cleavage in column
剪切后在色谱柱中收集到的在40,ku和50,ku间的产物电泳条带,与VP1标准品分子质量相同,即为融合蛋白上剪切下来的VP1;此外还有一条杂带,可能是因为非特异性吸附在色谱介质上的杂蛋白融入了剪切液中.通过Bradford法测洗脱液中VP1的浓度,计算得VP1产量为4,mg/(L培养基),与目前直接表达GST-VP1融合蛋白之后用凝血酶切割的方法(90,mg/(L培养基))相比表达量低[18].VP1产量较低的原因可能是:①在融合蛋白的表达过程中,有一部分融合蛋白在胞内发生了自剪切,导致破菌上清液中含有较多不带GST标签的VP1蛋白,在后续的分离纯化过程中这部分VP1蛋白不能吸附在亲和色谱介质上,从而降低了VP1蛋白的得率;②因为GST(26,ku)和VP1(42.5,ku)的空间结构较内含肽(17,ku)而言大很多,这二者可能会影响到内含肽的空间结构,从而影响内含肽的剪切效率.
2.5 VLPs形态学分析
为证明所得VP1蛋白结构正确,按照第1.2.4节所述方法通过两步透析法进行VLPs自组装,并使用透射电镜观察(见图7).结果表明,结构蛋白VP1组装成了直径40~50,nm的球状VLPs,与天然鼠多瘤病毒样颗粒大小一致,证明所得VP1结构正确.

图7 VP1组装的VLPs的透射电镜图Fig.7 Transmission electron micrograph of VLPs assembled from VP1
3 结 语
研究利用内含肽自剪切作用,构建内含肽介导的VP1表达纯化流程,即将内含肽插入到GST标签和VP1之间,通过亲和色谱分离纯化并改变色谱柱内pH值和温度诱导内含肽自剪切以获得VP1蛋白,经体外自组装得到具有天然结构的VLPs.本文构建的生产纯化流程无需昂贵的凝血酶参与,极大地降低了生产成本且简化了流程,为VLPs的高效制备奠定了基础.
[1] Pattenden L K,Middelberg A P J,Niebert M,et al. Towards the preparative and large-scale precision manufacture of virus-like particles [J]. Trends in Biotechnology,2005,23(10):523-529.
[2] Wheeler C M,Bautista O M,Tomassini J E,et al. Safety and immunogenicity of co-administered quadrivalent human papillomavirus(HPV)-6/11/16/18,L1 viruslike particle(VLP)and hepatitis B(HBV)vaccines [J]. Vaccine,2008,26(5):686-696.
[3] Lai W B,Middelberg A P J. The production of human papillomavirus type 16 L1 vaccine product from Escherichia coli inclusion bodies[J]. Bioprocess and Biosystems Engineering,2002,25(2):121-128.
[4] Koutsky L A,Ault K A,Wheeler C M,et al. A controlled trial of a human papillomavirus type 16 vaccine [J]. New England Journal of Medicine,2002,347(21):1645-1651.
[5] Gleiter S,Lilie H. Coupling of antibodies via protein Z on modified polyoma virus-like particles [J]. Protein Science,2001,10(2):434-444.
[6] Stubenrauch K,Bachmann A,Rudolph R,et al. Purification of a viral coat protein by an engineered polyionic sequence [J]. Journal of Chromatography B,2000,737(1/2):77-84.
[7] Braun H,Boller K,Lower J,et al. Oligonucleotide and plasmid DNA packaging into polyoma VP1 viruslike particles expressed in Escherichia coli [J]. Biotechnology and Applied Biochemistry,1999,29(1):31-43.
[8] Yamada T,Iwasaki Y,Tada H,et al. Nanoparticles for the delivery of genes and drugs to human hepatocytes[J]. Nature Biotechnology,2003,21(8):885-890.
[9] Wang Q,Lin T W,Tang L,et al. Icosahedral virus particles as addressable nanoscale building blocks [J]. Angewandte Chemie International Edition,2002,41(3):459-462.
[10] Mao C B,Solis D J,Reiss B D,et al. Virus-based toolkit for the directed synthesis of magnetic and semiconducting nan owires [J]. Science,2004,303 (5655):213-217.
[11] Rayment I,Baker T S,Caspar D L,et al. Polyoma virus capsid structure at 22. 5 Å resolution [J]. Nature,1982,295(5845):110-115.
[12] Salunke D M,Caspar D L,Garcea R L. Self-assembly of purified polyomavirus capsid protein VP1[J]. Cell,1986,46(6):895-904.
[13] Cook J C,Joyce J G,George H A,et al. Purification of virus-like particles of recombinant human papillomavirus type 11 major capsid protein L1 from Saccharomycescerevisiae [J]. Protein Expression and Purification,1999,17(3):477-484.
[14] Pushko P,Tumpey T M,Van Hoeven N,et al. Evaluation of influenza virus-like particles and Novasome adjuvant as candidate vaccine for avian influenza [J]. Vaccine,2007,25(21):4283-4290.
[15] Montross L,Watkins S,Moreland R B,et al. Nuclear assembly of polyomavirus capsids in insect cells expressing the major capsid protein VP1 [J]. Journal of Virology,1991,65(9):4991-4998.
[16] Chen X J S,Casini G,Harrison S C,et al. Papillomavirus capsid protein expression in Escherichia coli:Purification and assembly of HPV11 and HPV16 L1 [J]. Journal of Molecular Biology,2001,307(1):173-182.
[17] Smith D B,Johnson K S. Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase [J]. Gene,1988,67 (1):31-40.
[18] Chuan Y P,Lua L H L,Middelberg A P J. High-level expression of soluble viral structural protein in Escherichia coli[J]. Journal of Biotechnology,2008,134(1/2):64-71.
[19] Chong S R,Montello G E,Zhang A H,et al. Utilizing the C-terminal cleavage activity of a protein splicing element to purify recombinant proteins in a single chromatographic step [J]. Nucleic Acids Research,1998,26(22):5109-5115.
[20] Mathys S,Evans T C,Chute I C,et al. Characteriza tion of a self-splicing mini-intein and its conversion into autocatalytic N- and C-terminal cleavage elements:Facile production of protein building blocks for protein ligation[J]. Gene,1999,231(1/2):1-13.
[21] 许成钢,范晓军,张志云,等. Intein介导的重组昆虫毒素BmK IT在大肠杆菌中的可溶性表达、纯化及活性分析[J]. 生物工程学报,2007,23(6):989-994. Xu Chenggang,Fan Xiaojun,Zhang Zhiyun,et al. Soluble expression,purfication and characterization of BmK IT in Escherichia coli by Intein-mediated system[J]. Chinese Journal of Biotechnology,2007,23(6):989-994(in Chinese).
[22] 狄 洌,张宏伟,徐朗莱. Ssp dnaB蛋白质内含子介导的重组人脑钠素的制备[J]. 生物工程学报,2006,22(2):180-186. Di Lie,Zhang Hongwei,Xu Langlai. Use of Ssp dnaB mini-intein as a fusion partner for preparation of recombinant human brain natriuretic peptide[J]. Chinese Journal of Biotechnology,2006,22(2):180-186(in Chinese).
[23] Lipin D I,Lua L H L,Middelberg A P J. Quaternary size distribution of soluble aggregates of glutathione-S-transferase-purified viral protein as determined by asymmetrical flow field flow fractionation and dynamic light scattering[J]. Journal of Chromatography A,2008,1190(1/2):204-214.
[24] Xu M Q,Evans T C. Intein-mediated ligation and cyclization of expressed proteins[J]. Methods,2001,24(3):257-277.
(责任编辑:田 军)
Intein-Mediated Expression and Purification of Murine Polyomavirus Virus-Like Particles
Dong Xiaoyan,Liu Xiaodan,Zhang Lin
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
Virus-like particles(VLPs)of murine polyomavirus can be manufactured through in vitro self-assembly of structural protein VP1. VLPs have been utilized in the development of vaccines,gene therapy,drug delivery,biomaterials,etc. However,removing of GST-tag by thrombin in VP1 purification has the problems of high cost and complicated procedures. Therefore,the self-cleavage feature of intein was utilized by inserting the gene segment of intein between VP1 and GST. Then,affinity chromatography was used in the purification process and temperature and pH value were changed to induce the self-cleavage of intein. Thus,GST-intein tag and VP1 were separated. The production of VP1 was 4 mg/(L culture). Purified VP1 was assembled in vitro into VLPs,which were consistent with the natural VLPs of murine polyomavirus. Hence,the intein-mediated expression and purification process of murine polyomavirus VLPs are successfully developed,which is helpful for lower-cost,higher-efficiency production of VLPs without the involvement of thrombin.
murine polyomavirus;virus-like particles;affinity chromatography;VP1;self-assembly;intein;self-cleavage
O629.73
A
0493-2137(2014)04-0315-06
DOI 10.11784/tdxbz201308041
2013-08-19;
2013-09-25.
国家自然科学基金资助项目(21236005,21006069);国家高技术研究发展计划(863计划)资助项目(2012AA020206);天津市应用基础及前沿技术研究计划重点资助项目(13JCZDJC31100);天津市国际科技合作项目(11ZCGHHZ00600);天津大学自主创新基金资助项目.
董晓燕(1962— ),女,博士,教授,d_xy@tju.edu.cn.
张 麟,linzhang@tju.edu.cn.
时间:2013-10-15.
http://www.cnki.net/kcms/detail/12.1127.N.20131015.1055.001.html.

