加热和冷却速率对大豆蛋白凝胶特性的影响
武 肖 傅玉颖 潘伟春 关鹏翔 卢锦丽
(浙江工商大学食品与生物工程学院,杭州 310035)
各种来源的球蛋白因其良好的营养价值和对食品质构的影响在食品工业中具有重要的作用[1]。这种质构特性由蛋白质交联形成的凝胶网络结构决定,所以凝胶作为球蛋白的一种非常重要的功能特性常用来改善食品质构[2]。蛋白凝胶网络结构受到多种外部因素影响。理论上,pH、离子强度、加热温度和加热速率是影响球蛋白凝胶网络结构的重要因素[3-5];现实中,他们也是食品工业中用来调控蛋白质凝胶结构的常用加工参数。
小变形振荡(动态)流变测试是评价蛋白质凝胶性质和结构的一种非常有效的方法,它对样品物理结构和化学组成的改变极其敏感,非常适合考查凝胶形成过程中的一些微小变化[6-7]。高储能模量表示分子间有更多的相互作用和很强的网络结构,而低的tanδ表示更好的三维网络结构[8]。
目前,大量研究集中于pH、离子强度和温度对蛋白质凝胶结构的影响,而加热和冷却速率对蛋白质凝胶结构和性质影响的报道较少,特别是冷却阶段对蛋白质凝胶结构和性质具有很大的影响。Sun等[9]发现慢的加热速率对豌豆球蛋白凝胶有不利的影响,而较慢的冷却速率能够增加蛋白质凝胶的强度。本试验意在探讨加热和冷却速率对大豆蛋白热诱导凝胶特性的影响,以期为大豆蛋白的开发利用提供借鉴。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕:山东万得福集团实业有限公司。
1.2 仪器与设备
安东帕MCR 302流变仪:奥地利安东帕(中国)有限公司;高速冷冻离心机(H1850R型):湖南湘仪离心机仪器有限公司;pH计(PHS-3C型):上海理达仪器厂;冷冻干燥机(FD-1C-50型):北京博医康实验仪器有限公司;半微量凯氏定氮仪(KJ2300型):福斯中国有限公司。
1.3 试验方法
1.3.1 大豆分离蛋白的制备
采用碱溶酸沉法制备大豆分离蛋白(SPI),将低温脱脂豆粕按1∶15的比例与去离子水混合,室温搅拌2 h后9 710 r/min离心30 min,取上清液用1 mol/L HCl调pH至4.5(等电点),4℃下静置2 h后8 690 r/min离心10 min,取蛋白凝乳重新溶于去离子水中,1 mol/L NaOH调节pH至中性,然后以9 710 r/min下离心30 min除去少量不溶物,透析48 h后冷冻干燥。测其蛋白质质量分数为92.5%(N×6.25)。
1.3.2 流变分析
将SPI溶于去离子水中配成12%的溶液,充分溶解后,使用流变仪进行动态振荡分析,所用转子为同轴圆筒双间隙(型号:DG26.7),约5 mL样品倒入圆筒中,待转子到达测量部位时,在样品表面滴加少许硅油以防水分挥发。
分析测试程序:样品在25℃下平衡2 min,温度范围25℃~95℃~25℃(从室温到95℃,足够使大豆蛋白变性且常用于食品工业中),加热和冷却速率分别为 4、2、1、0.5 ℃ /min,应变为 1%,频率 1 Hz。随后对样品进行频率扫描:25℃下0.01~10 Hz。收集每个样品储能模量(G')、耗能模量(G″)和 tanδ(G″/G'),取1 Hz时数据比较形成凝胶的特性。所设应变值在热诱导蛋白网络结构的线性黏弹区内(预试验所得)。每个样品测3次。
凝胶点是凝胶开始形成时的温度,本试验采用加热阶段G'快速增加时G'与G″交点的温度作为大豆蛋白的凝胶点。
1.3.3 数据处理
试验数据均进行3次重复试验,采用SPSS软件进行分析,测定结果以均值±标准差表示。试验数据采用ANOVA和Duncan分析(95%置信区间)。
2 结果与讨论
2.1 大豆蛋白典型凝胶形成模型
大豆蛋白典型的热诱导凝胶形成曲线见图1,每个样品测试(3次)获得的流变图谱从本质上来说是完全一致的。从图1中的3个参数(G'、G″、tanδ)可以看出大豆蛋白凝胶网络结构形成过程中流变性质的改变。G'表示蛋白质凝胶网络结构的弹性组成,代表了凝胶结构的强度,对凝胶三维网络结构有贡献;G″表示黏性组成,对三维网络结构没有贡献。Tanδ值象征着网络结构形成的类型,其值越小代表三维网络结构越好。
图1a可以看出,在加热阶段温度升至80℃前G'和G″基本保持恒定。在此过程中,蛋白质分子逐渐变性(去折叠)、疏水基团暴露是凝胶形成的准备阶段。当加热温度超过85℃后,G'和G″快速上升表明凝胶网络结构逐步形成。凝胶过程初始阶段黏性行为占主导地位(G″>G'),而在加热后期弹性行为占据主导地位(G'>G″),此时蛋白质分子聚集并且交联形成三维网络结构,此过程为初始凝胶阶段;当温度达到最高95℃后,冷却阶段开始。在此过程中,G'和G″继续稳定增加,说明蛋白质分子继续交联、凝胶网络结构缓慢形成和重排。Paulson等[10]把油菜蛋白凝胶的形成和稳定性归因于疏水相互作用和氢键。因此,可以认为疏水相互作用和氢键对大豆蛋白凝胶的形成和稳定性起到同样作用。Tanδ是辨别凝胶构造的一个非常重要的参数。从图1b可以看出,在85℃之前tanδ逐渐下降,在90℃左右时急剧下降至一个非常低的水平,并且在以后的加热和冷却阶段保持恒定。这说明在冷却初始阶段大豆蛋白溶液已经形成了稳定的凝胶,并且在冷却过程中同时增加了网络结构的弹性和黏性组成。
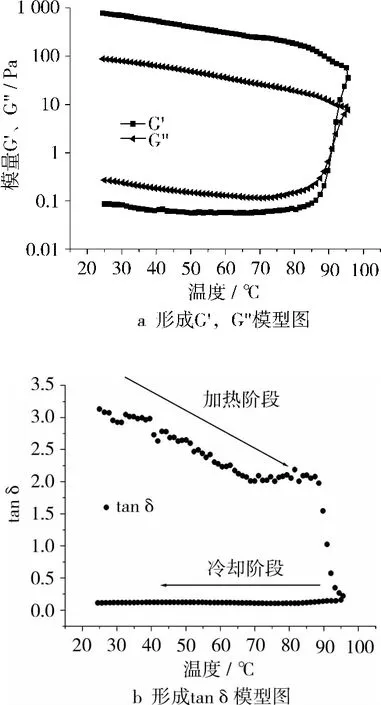
图1 典型的大豆蛋白凝胶形成G',G″模形图和tanδ模型图
图1所示凝胶过程遵循球蛋白热诱导凝胶3步过程:1):蛋白变性以及疏水基团暴露;2)去折叠的蛋白质分子间相互作用(聚集);3)聚集体交联成网络结构。特别强调的是在冷却阶段,凝胶网络结构继续发展并且被形成的许多短程键(如氢键)加强。因此,可以总结大豆蛋白溶液凝胶网络形成主要是疏水相互作用和氢键。
对于所有的加热和冷却速率,加热阶段所得的流变曲线基本相同,G'和 G″都小于1 Pa,且 G'< G″直到到达凝胶点(图1)。所以比较加热和冷却速率对冷却阶段大豆蛋白凝胶性质的影响。
2.2 加热速率对冷却阶段凝胶形成G'值的影响
从图2a可以看出,在冷却速率均为2℃/min的情况下,加热速率越慢,冷却阶段形成的凝胶G'值越大。这可以解释为在相同冷却速率下,较慢的加热速率使大豆蛋白分子有更多的时间去重排和交联形成更有序的网络结构来增加凝胶强度。这与前述Sun等[9]的研究结论不同,他们发现慢的加热速率对豌豆蛋白凝胶形成有不利的影响,这种差异可能是不同的蛋白种类造成的。
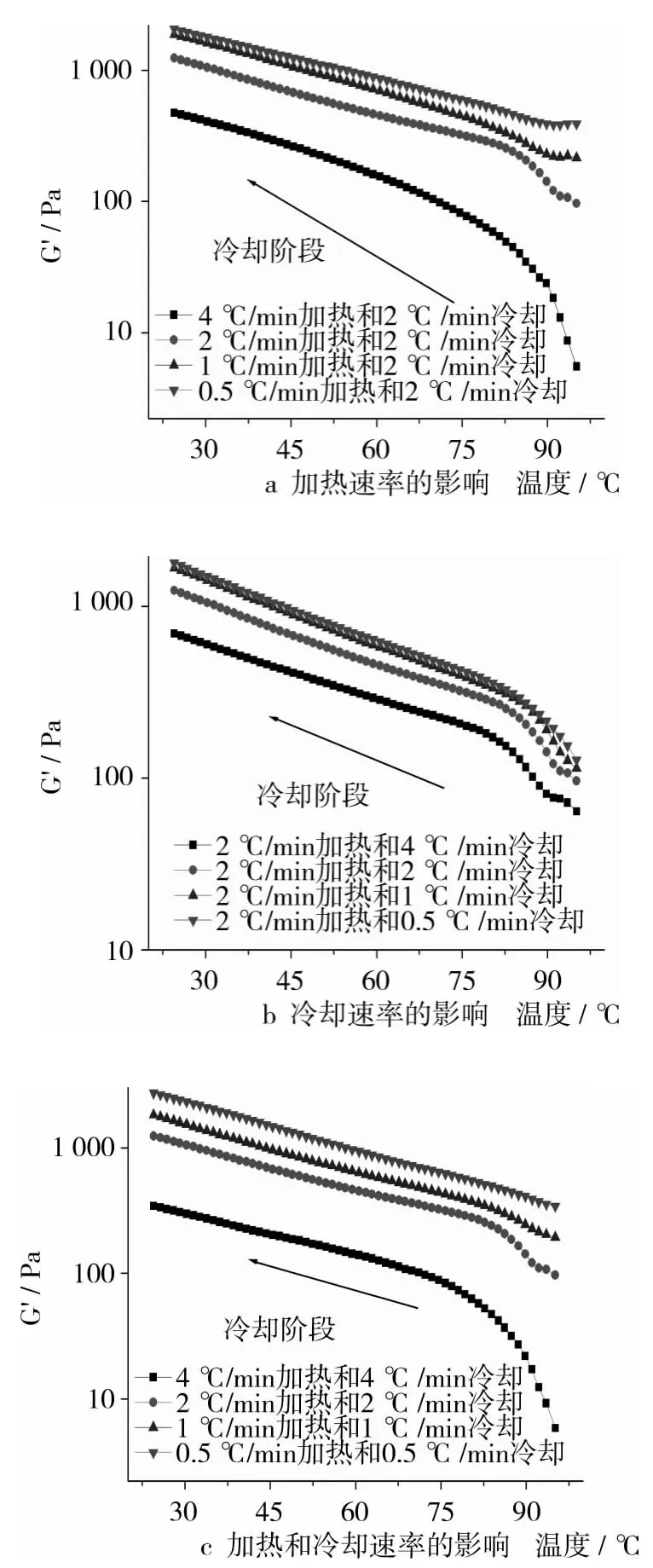
图2 不同加热和冷却速率对冷却阶段大豆蛋白溶液的影响
图3a表示不同加热速率下热诱导大豆蛋白凝胶的性质。较慢加热速率(0.5、1℃/min)的G'显著大于较快加热速率(2、4℃/min)下形成凝胶的G'值,4℃/min时tanδ显著高于其他较慢加热速率时的值。Renkema等[11]认为不同的加热速率影响蛋白质的聚集动力学导致产生不同网络结构(不同粗细的线股、孔隙等)的凝胶,而不同的网络结构又导致不同的G'值。

图3 12%大豆蛋白凝胶形成后频率扫描1 Hz时热诱导凝胶性质
2.3 冷却速率对冷却阶段凝胶形成G'的影响
图2b表示冷却速率对大豆蛋白凝胶形成的影响。在相同加热速率下,最慢的冷却速率(0.5℃/min)时大豆蛋白形成最强的凝胶强度。这是因为慢的冷却速率使蛋白质分子有更长的时间处于去折叠态,放缓了暴露基团的活动性,使其在蛋白质分子相互作用前达到最佳的排列。氢键是促进大豆蛋白凝胶结构形成的重要因素,较低的温度则有利于氢键的形成,因此可以推测慢的冷却速率促进氢键的形成从而产生更强的凝胶。O'Kane等[12]报道在慢的冷却速率(0.2℃/min)下疏水作用和二硫键与豌豆蛋白的凝胶结构有关,他们认为慢的冷却速率为巯基基团反应形成二硫键提供了充足的时间,凝胶强度增加。众所周知,亲水性氨基酸如天冬氨酸、谷氨酸、丝氨酸和苏氨酸的侧链上极性基团可以形成氢键并且为去折叠蛋白质分子提供链接。对于疏水相互作用,非极性氨基酸如丙氨酸、甘氨酸等在球蛋白变性时从分子内部暴露出来而更容易形成。
图3b表示冷却速率对热诱导大豆蛋白凝胶性质的影响。随着冷却速率的增大,G'值减少。Tanδ在较慢冷却速率时(0.5、1、2℃/min)和快速冷却速率时(4℃/min)有显著不同。这是因为在冷却阶段,随着温度的下降大豆蛋白分子活动性下降,促进了分子之间化学键的形成;慢的冷却速率下大豆蛋白有充足的时间形成各种作用力从而增大了G',而较快的冷却速率则减少了各种作用力的形成从而降低了凝胶的强度,产生了不同的网络结构类型。与加热速率对凝胶性质的影响相比,冷却速率对大豆蛋白凝胶性质的影响相对较大。
2.4 加热和冷却速率对冷却阶段凝胶形成G'值的影响
加热和冷却速率对大豆蛋白凝胶性质同样有显著的影响,如图2c,慢的加热和冷却速率比快的加热和冷却速率形成的凝胶更强。值得注意的是,在较慢加热和冷却速率(0.5、1℃/min)下,G'在冷却阶段初期较大,然后随着温度的降低缓慢增大;在较快加热和冷却速率(2、4℃/min)时,G'在冷却初期急剧增大,然后逐渐放缓。这种情况是由于在快的加热和冷却速率时,凝胶网络结构在冷却阶段继续形成,而慢的加热和冷却速率时,凝胶网络结构在加热阶段形成冷却阶段加强。
改变加热和冷却速率同样影响大豆蛋白凝胶网络结构,见图3c。G'随着加热和冷却速率的增大逐渐减少,而tanδ则逐渐的增大。对于G',其逐渐减少和加热(冷却)速率对蛋白凝胶性质的影响相一致(见图3a和图3b),进一步证明了慢的加热(冷却)速率增强了蛋白质分子之间的相互作用并产生了更强的凝胶。而对于网络结构类型(tanδ决定),同样受到加热和冷却速率的影响,快的加热和冷却速率形成的tanδ较大,说明凝胶网络结构中黏性组成较大,这与图3a和图3b的结果相一致。
2.5 加热和冷却速率对凝胶点的影响
加热和冷却速率对凝胶点的影响结果如表1所示。随着加热速率的增大凝胶点增大,和冷却速率无关。这与O'Kane等[12]的结果相一致,他们发现在较慢的加热速率下豌豆蛋白初始凝胶形成的温度较低。Renkema等[11]发现大豆蛋白在较快的加热速率时其变性温度较高,这就导致较高的凝胶温度。鸡蛋清蛋白、豌豆球蛋白和牛血清蛋白中有同样的现象[13-14]。因此,可以得出凝胶点和加热速率有关。在较低的加热速率下蛋白质分子有更多的时间重组和排列,因此,他们在较低温度下开始交联;在较高加热速率下,蛋白质分子没有足够的时间去重组和排列,因此,开始交联时温度较高。
冷却速率对凝胶点无影响,如表1结果所示。在相同加热速率不同冷却速率下,蛋白质有相似的凝胶点。当加热和冷却速率都改变时,凝胶点只受加热速率影响。

表1 加热和冷却速率对凝胶点的影响(SPI 12%)/℃
2.6 不同浓度对大豆蛋白凝胶性质的影响
蛋白质浓度对SPI凝胶性质的影响见表2(加热和冷却速率2℃/min)。G'值随着蛋白质浓度的增大(从10%~15%)而增大,因为浓度的增大提高了蛋白质分子交联的机会从而形成了更强的凝胶构造。Tanδ随着蛋白质浓度的增大而减少,说明高的蛋白质浓度形成了三维网络结构更好的凝胶。凝胶点随着蛋白质浓度的增大从95℃降低到72℃,在P<0.05水平上呈显著性差异,说明凝胶点和蛋白质的浓度相关;这与Sun等[15]的研究结果不同,他们发现盐溶豌豆蛋白的凝胶点与浓度无关。这可以解释为在相同的温度下浓度高的蛋白质有更多的机会交联,所以高浓度的蛋白质溶液在较低的温度下就开始形成凝胶。

表2 不同浓度对大豆蛋白凝胶性质的影响
3 结论
加热和冷却速率影响热诱导大豆蛋白的凝胶性质和结构。在相同冷却速率下(2℃/min),随着加热速率的增大(从0.5~4℃/min),凝胶点逐渐增大而凝胶强度逐渐减小;在相同加热速率下(2℃/min),随着冷却速率的增大(从0.5~4℃/min),最终凝胶强度逐渐减小而凝胶点基本保持不变。慢的加热(冷却)速率形成更小的tanδ,表明形成更好的三维网络凝胶结构;慢的加热(冷却)速率产生更大的G'值,表明形成更强的凝胶强度;而凝胶点随着加热速率的增大而增高,与冷却速率无关。增大蛋白质浓度可以提高凝胶强度,而tanδ值和凝胶点随着蛋白质浓度的增大而减少。因此,在食品生产中可行的途径是调控加热和冷却速率以控制大豆蛋白的凝胶强度,生产出最适的凝胶特性,而不用改变蛋白质的浓度。
[1]Van Kleef F S M.Thermally induced protein gelation:gelation and rheological characterization of highly concentrated ovalbumin and soybean protein gels[J].Biopolymers,1986,25(1):31-59
[2]Ikeda S,Nishinari K.On solid - like rheological behaviors of globular protein solutions[J].Food Hydrocolloids,2001,15(4):401-406
[3]Lakemond C M M,de Jongh H H J,Paques M,et al.Gelation of soy glycinin;influence of pH and ionic strength on network structure in relation to protein conformation[J].Food Hydrocolloids,2003,17(3):365 -377
[4]郭兴凤,张艳红,陆惠,等.大豆分离蛋白凝胶制备和凝胶质构特性研究[J].中国粮油学报,2005,20(6):68 -70
[5]华欲飞,Cui Steve W,Wang Qi,等.不同大豆分离蛋白凝胶的流变性性质[J].中国粮油学报,2003,18(6):43-48
[6]Tunick M H.Small- strain dynamic rheology of food protein networks[J].Journal of Agricultural and Food Chemistry,2010,59(5):1481 -1486
[7]Sun X D,Arntfield S D.Dynamic oscillatory rheological measurement and thermal properties of pea protein extracted by salt method:effect of pH and NaCl[J].Journal of Food Engineering,2011,105(3):577 -582
[8]Uruakpa F O,Arntfield S D.Impact of urea on the microstructure of commercial canola protein–carrageenan network:a research note[J].International Journal of Biological Macromolecules,2006,38(2):115 -119
[9]Sun X D,Arntfield S D.Gelation properties of salt-extracted pea protein isolate induced by heat treatment:effect of heating and cooling rate[J].Food Chemistry,2011,124(3):1011 -1016
[10]Paulson A T,Tung M A.Thermally induced gelation of succinylated canola protein isolate [J].Journal of Agricultural and Food Chemistry,1989,37(2):319 -326
[11]Renkema J M S,van Vliet T.Heat- induced gel formation by soy proteins at neutral pH [J].Journal of Agricultural and Food Chemistry,2002,50(6):1569 -1573
[12]O'Kane F E,Happe R P,Vereijken J M,et al.Heat- induced gelation of pea legumin:comparison with soybean glycinin[J].Journal of Agricultural and Food Chemistry,2004,52(16):5071-5078
[13]Donovan J W,Mapes C J,Davis J G,et al.A differential scanning calorimetric study of the stability of egg white to heat denaturation [J].Journal of the Science of Food and Agriculture,1975,26(1):73 -83
[14]Arntfield S D,Murray E D.Heating rate affects thermal properties and network formation for vicilin and ovalbumin at various pH values[J].Journal of Food Science,1992,57(3):640-646
[15]Sun X D,Arntfield S D.Gelation properties of salt- extracted pea protein induced by heat treatment[J].Food Research International,2010,43(2):509 -515.

