雷帕霉素对高糖环境下人肾小管上皮细胞的影响
蒋娟娟 娄青林 高雪艳 申志祥 卞茸文
糖尿病已是公认的全球公共卫生问题,在美国、欧洲等主要的发达国家,糖尿病已经成为终末期肾脏病(ESRD)最常见的病因;在中国等发展中国家,糖尿病的发生率亦显著增加,糖尿病所致的糖尿病肾病进入ESRD患者数量亦逐渐上升[1]。糖尿病肾病发病机制不明,目前认为高血糖(HG)是引起靶器官损害的根本原因,蛋白尿是糖尿病肾病独立的危险因素,高血压、脂代谢紊乱、胰岛素抵抗等因素共同作用参与糖尿病肾病的发生发展[2-4]。近年有学者提出糖尿病患者使用免疫抑制剂雷帕霉素(rapamycin,RPM)具有一定的肾保护作用。因此,本研究针对2型糖尿病常见的HG高胰岛素环境,探讨RPM对人肾小管上皮细胞(HK-2)的影响。
1 材料与方法
1.1 实验试剂 HK-2株购自武汉中国典藏物培养中心(美国ATCC)江苏省人民医院肾病实验室,RPM购自福建科瑞药业有限公司,小鼠抗人单克隆抗体actin、辣根过氧化物酶(HRP)标记的二抗购自美国Santa Cruz公司,pmTOR抗人抗体、p70S6K抗人抗体购自美国Cell Signaling公司,MTT购自美国Sigma-Aldrich公司。
1.2 方法
1.2.1 细胞培养和实验分组:HK-2置于5%CO2细胞培养箱中以含10%FBS的DMEM培养液培养,细胞80%融合时0.25%胰酶消化传代,取5~13代用于实验,实验前无血清同步24 h。采用MTT法测定不同浓度(1、10、100 nmol/L)RPM 培养不同时间(0、12、24、48 h)后HK-2细胞的活性。实验分组如下:(1)正常糖组(NG,5.5 mmol/L);(2)高糖组(HG,25.0 mmol/L);(3)HG+RPM(1、10、100 nmol/L)组。(4)HG+100 nmol/L RPM+胰岛素(Ins,1、10、100 nmol/L)组。
1.2.2 免疫印迹法(western blot)检测蛋白表达:采用western blot方法测定不同组雷帕霉素靶蛋白(pm-TOR)和P70核糖体S6激酶(p70S6K)蛋白的表达。实验方法:HK-2细胞培养24 h后,收集细胞提取总蛋白,BCA试剂盒测定蛋白浓度,取60 μg蛋白样品100℃变性5 min。SDS-PAGE凝胶电泳2 h,转印到PVDF膜上,5%脱脂牛奶室温封闭1 h,加入pmTOR或p70S6K抗人抗体4℃孵育过夜,HRP标记的二抗室温孵育1 h,ECL显色成像,凝胶分析系统定量,比较目的条带或内参条带的吸光度。以上实验均重复3次。
1.3 统计学处理 采用SPSS 14.0软件包进行数据分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度RPM培养不同时间对HK-2细胞增殖抑制率的影响 不同浓度(1、10、100 nmol/L)RPM 分别刺激0、12、24、48 h后,结果显示 HK-2细胞增殖抑制率具有浓度-时间依赖性。100 nmol/L RPM刺激48 h,HK-2细胞增殖抑制率接近50%。
2.2 HK-2细胞pmTOR蛋白的表达 HG显著上调HK-2细胞pmTOR蛋白的表达,而RPM可拮抗HG上调HK-2蛋白表达的效应。不同浓度RPM组显示,随浓度升高,RPM抑制HK-2 pmTOR蛋白表达的作用越显著(P <0.05)。见图1,2。
2.3 HK-2细胞p70S6K蛋白的表达 HG可显著上调p70S6K蛋白表达,RPM可拮抗 HG上调 HK-2 p70S6K蛋白表达的作用。随RPM浓度升高,其抑制p70S6K蛋白表达作用越显著(P<0.05)。见图3。
2.4 不同浓度胰岛素对RPM抑制HG环境下pmTOR蛋白表达的影响 在100 nmol/L RPM和HG环境下,分别加入1、10、100 nmol/L胰岛素后测定pmTOR蛋白的表达,结果显示加入1、10 nmol/L胰岛素后pm-TOR的表达与HG+100 nmol/L RPM组无统计学差异(P>0.05),而加入100 nmol/L浓度的胰岛素可抑制RPM的作用(P<0.05)。见图4。
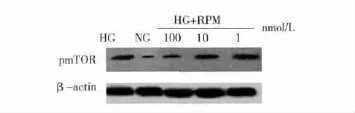
图1 RPM抑制HG上调HK-2 pmTOR蛋白表达图谱

图2 RPM抑制HG上调HK-2 pmTOR蛋白表达半定量分析
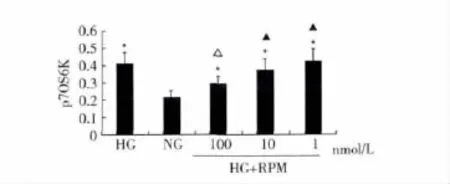
图3 RPM抑制HG上调p70S6K蛋白表达的半定量分析
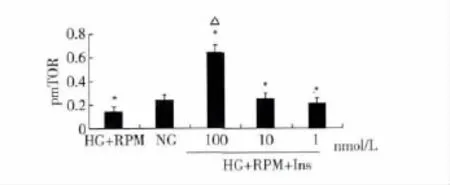
图4 不同浓度胰岛素对HG环境下RPM抑制pmTOR蛋白表达的半定量分析(n=3)
3 讨论
糖尿病肾病是糖尿病引起的严重并发症之一,在我国已经是慢性肾功能衰竭的第3位病因[5],我国50%的透析患者为糖尿病引起的肾病[6]。迄今为止,糖尿病肾病的发病机制依然不明,近年有学者提出糖尿病患者使用免疫抑制剂RPM具有一定的肾保护作用,其在糖尿病肾病的发病机制中的作用逐渐引起众多学者的关注[7]。
RPM是一种大环内酯类抗生素,目前主要用于器官移植排斥反应的预防和治疗[8]。RPM主要通过哺乳动物雷帕霉素靶蛋白(mTOR)通路发挥作用,mTOR活化后,可导致下游的2个重要的效应因子p70S6K活化和真核细胞起始因子-4E-结合蛋白1(4EBP-1)活化。p70S6K可使S6磷酸化,促进翻译过程的启动,促进RNA和蛋白质的合成。p70S6K激活后,也可通过周期素依赖激酶(cdks)促进细胞周期的发展。RPM能与哺乳动物mTOR相互作用,抑制p70S6K活化和4EBP-1磷酸化,参与细胞生长与增殖、代谢的调节,并反馈性调节胰岛素的敏感性,与2型糖尿病、肥胖等疾病的发生密切相关[9]。
足细胞肥大在慢性肾脏疾病包括糖尿病肾病进展中有重要作用,相关动物模型研究已经证实RPM干预可延缓肾小球硬化,改善糖尿病肾病的进展。使用RPM可抑制足细胞肥大,抑制肾小球系膜细胞增殖,抑制Ⅳ型胶原产生,延缓肾小球硬化,改善早期糖尿病肾病[10]。推测此类效应与RPM使用后抑制mTOR通路活化密切相关。有动物实验证实RPM可延缓糖尿病肾病的小管间质损害,减少蛋白尿。但亦有临床研究认为RPM可引起患者蛋白尿,其机制未进一步探讨,因此RPM与糖尿病肾病之间的关系及作用机制目前仍不明确[11]。
本研究采用体外实验研究RPM对HG环境下HK-2细胞影响,结果显示HG可显著活化HK-2 pm-TOR通路,RPM可通过mTOR/p70S6K通路拮抗HG对HK-2效应,且在一定范围内,浓度越高效应越显著。100 nmol/L RPM可抑制HG诱导的pmTOR蛋白表达,加入100nmol/L胰岛素可抑制RPM的作用,提示高浓度胰岛素对RPM干预的HG环境下mTOR通路有逆转作用。有文献报道RPM可反馈性地调节胰岛素的敏感性,两者在糖尿病肾病的动物及人体内的影响机制目前还不明确,需要进一步研究证实。
综上,本研究针对2型糖尿病常见的HG高胰岛素环境,观察RPM干预对HK-2细胞的影响。结果显示RPM可通过mTOR/p70S6K通路抑制HG对HK-2效应,提示RPM可影响HG状态下mTOR/p70S6K通路,在糖尿病肾病的发病机制中起一定的作用。本研究仅从体外实验探讨,其他相关的研究亦多局限于细胞和(或)动物实验,以糖尿病肾病患者为研究对象的体内研究目前尚少,RPM在糖尿病肾病患者体内的作用效应尚需进一步明确。
[1]Leite RS,Marlow NM,Fernandes JK.Oral health and type 2 diabetes[J].Am J Med Sci,2013,345(4):271-273.
[2]Lin X,Tao L,Tang D.Gene therapy,a targeted treatment for diabetic nephropathy[J]Curr Med Chem,2013,20(30):3774-3784.
[3]庄文翔,申志祥,张鹏翎.老年2型糖尿病患者血清超敏C反应蛋白与糖尿病肾病相关性分析[J].实用老年医学,2009,23(4):296-298.
[4]赵大鹏,隋艳波,栾仲秋,等.糖尿病肾病发病机制的研究进展[J].中国医药导报,2012,9(36):47-48.
[5]王笑云.老年糖尿病肾病肾衰竭诊治进展[J].实用老年医学,2007,21(5):294-298.
[6]张愉.老年糖尿病肾病研究进展[J].中国医药导报,2011,8(32):15-17.
[7]Blagosklonny MV.Rapamycin-induced glucose intolerance:hunger or starvation diabetes[J].Cell Cycle,2011,10(24):4217-4224.
[8]Lieberthal W,Levine JS.Mammalian target of rapamycin and the kidney.Ⅰ.The signaling pathway[J].Am J Physiol Renal Physiol,2012,303(1):F1-10.
[9]Gupta A,Gupta P,Biyani M.Targeted therapies in diabetic nephropathy:an update[J].J Nephrol,2011,24(6):686-695.
[10]Inoki K,Mori H,Wang J,et al.mTORc1 activation in podocytes in a critical step in the development of diabetic nephropathy in mice[J].J Clin Invest,2011,121(6):2181-2196.
[11]Godel M,Hartleben B,Herbach N,et al.Role of mTOR in podocyte function and diabetic nephropathy in human and mice[J].J Clin Invest,2011,121(6):2197-2209.

