PRB介导子宫内膜癌细胞对MPA敏感性的作用机制研究
王 晶,孙 笑,王丽华,王玉东
(上海交通大学医学院附属国际和平妇幼保健院妇科,上海 200030)
子宫内膜癌(endometrial cancer,EC)是最常见的妇科恶性肿瘤之一,年轻的内膜癌患者也相对增加。5%~14%的内膜癌患者发病年龄小于40岁,多有肥胖、不育、多囊卵巢综合征及月经不调,保留生育 /内分泌功能成为年轻患者的强烈要求。目前,孕激素长期、大量应用为年轻子宫内膜癌患者保守治疗及晚期、复发患者的主要方法。孕激素对子宫内膜不典型增生、低级别子宫内膜癌的反应率分别为67%~82%、50%~70%,仍有一部分分化良好的年轻早期患者激素治疗无效,出现复发和转移,最终采取手术切除子宫。孕激素主要是通过孕激素受体B(progesterone receptor B,PRB)抑制肿瘤的生长。本研究在分析PRB介导内膜癌细胞对孕激素敏感性的基础上,进一步探讨PRB下调后,MPA对内膜癌细胞生物学行为的影响及相关机制,为正确选择内膜癌的治疗方法,提高疗效提供理论基础。
1 材料与方法
1.1 主要试剂及仪器 人子宫内膜癌细胞系Ishikawa购自美国模式菌种收集中心 (ATCC)。细胞培养基DMEM-F12、胎牛血清 (FBS)购自美国Gibco公司。MTT、MPA为Sigma公司产品,DMSO购自Amresco公司。MPA以DMSO溶解为浓度10 mol·L-1的储存液,充分溶解后分装,-20℃保存,培养液中DMSO的终浓度不超过0.1%。兔抗人ERK、p-ERK多克隆抗体为CST公司产品,TRIzol为Invitrogen公司产品,逆转录试剂盒及PCR试剂盒为TaKaRa公司产品,引物由上海生工公司合成,蛋白Marker为 Thermo公司产品,慢病毒包装系统由pENTR/U6-shRNA载体、PL/IERES/GFP/U6载体、pIRES2-EGFP-prb载体组成,购自上海诺百生物科技有限公司,Matrigel胶购自BD公司,Transwell小室购自美国Corning公司。
1.2 实验方法
1.2.1 细胞培养 细胞生长于含10%胎牛血清的DMEM-F12培养基中,37℃、5%CO2常规培养,每1~2天换液1次。
1.2.2 慢病毒载体的制备 选择GenBank中人PRB基因编码区序列(NM000926.4)作为分析序列,设计、合成4对针对PRB基因shRNA的寡核苷酸序列。据其对PRB基因的抑制率,确定最佳干扰序列为:5′-CACCGCATGATCTTGTCAAACAACTCGA AAGTTGTTTGACAAGATCATGC-3′。构成表达 shRNA的重组慢病毒质粒载体,并行酶切鉴定。
1.2.3 慢病毒包装及滴度测定 PRB shRNA的重组慢病毒质粒载体及两种辅助载体共转染293T细胞,培养48 h后,收集细胞培养上清,浓缩后得到高滴度慢病毒浓缩液,采用10倍系列孔稀释后,转染293T细胞。
1.2.4 细胞分组及感染 细胞分为干扰组IskshRNA-PRB、阴性对照组 Isk-shRNA-NC、空白对照组Isk,将细胞悬液接种于96孔板,常规培养,细胞覆盖80%左右时,根据MOI值,进行病毒侵染实验,收集感染成功率80%以上的细胞,抽提RNA及蛋白分别进行qPCR及Western blot,检测靶点的干扰效率。
1.2.5 qPCR测定PRBmRNA 按照试剂盒操作步骤,抽提上述3组Ishikawa细胞总RNA,用紫外分光光度法测定RNA浓度。PCR反应条件:95℃30 s,95℃ 5 s,60℃ 34 s,95℃ 15 s,60℃ 1 min,95℃ 15 s。以上实验重复3次。
1.2.6 MTT法检测细胞增殖能力 每孔约8×103细胞接种至96孔板,每组设8个平行孔,干扰组分别加入不同浓度的 MPA(0.01、0.1、1、10μmol·L-1),以加等体积DMSO作为溶剂对照。酶标仪测490 nm处吸光度值,绘制生长曲线。实验重复3次。
1.2.7 Transwell法测定侵袭能力 用 Matrigel 1∶6稀释包被Transwell小室底部,小室外加500μl含10%胎牛血清培养液,小室内加入100μl不含血清细胞悬液,细胞密度为5×108·L-1,24 h后取出小室,经固定、染色,200倍镜下取5个视野计数穿膜细胞数,取其平均数。
1.2.8 流式细胞仪检测细胞凋亡 细胞接种24 h后,换以无血清培养液培养18 h,加入10μmol·L-1MPA,以加相同体积的DMSO作为溶剂对照,终浓度不超过0.1%。于48 h收集细胞,重悬并加入Annexin V-7AAD、PE染料,混匀,避光。1 h内,应用流式细胞仪检测。
1.2.9 Western blot检测 SDS细胞裂解液裂解细胞,SDS-PAGE电泳分离蛋白,Bio-Rad微型电转移系统将蛋白转移至硝酸纤维膜上,封闭1 h,加兔抗人PRB多克隆抗体 (1∶500稀释)、兔抗人ERK(1∶1 000稀释)及p-ERK抗体 (1∶1 000稀释),4℃孵育过夜,TBST洗膜3次,二抗室温孵育1 h,ECL发光,X线胶片显影、定影并扫描记录,以β-actin为内参,以上实验重复3次。
1.3 统计学方法 采用SPSS 15.0软件进行统计,实验数据采用¯x±s表示,各组的组间均数比较用方差分析。
2 结果
2.1 慢病毒载体的制备、鉴定、滴度测定及感染PRB shRNA重组慢病毒载体质粒转化DH5α大肠杆菌,细菌阳性克隆经PCR扩增,PCR产物1 954 bp。测序结果表明,插入的片段与设计的PRB shRNA序列一致,没有突变、缺失、插入等异常存在。以293T细胞GFP蛋白的表达水平为对照,经逐孔稀释滴度法测定慢病毒浓缩液滴度为2×105Tu·L-1,说明有大量质粒转入293T细胞,病毒包装成功。
2.2 慢病毒感染对Ishikawa细胞PRB表达水平的干扰效率鉴定 qPCR结果显示,Isk-shRNA-PRB组细胞中PRB mRNA的表达量仅为Isk-shRNA-NC组细胞的39.5%,即抑制率为60.5%,而阴性对照组与空白对照组细胞的PRB mRNA水平差异无统计学意义(P>0.05)。与阴性对照组相比,干扰组Ishikawa细胞PRB的mRNA水平明显降低 (P<0.05)。Western blot结果显示,干扰组细胞中PRB蛋白的表达量仅为阴性对照组的38.7%,即抑制率为61.3%,而阴性对照组与空白对照组细胞的PRB蛋白表达水平差异无统计学意义(P>0.05)。说明与阴性对照组相比,干扰组Ishikawa细胞PRB的蛋白水平下降 (P<0.05)。
2.3 干扰PRB表达,促进Ishikawa细胞增殖、侵袭,抑制凋亡 MPA可抑制空白对照组和阴性对照组Ishikawa细胞的增殖活性,1、10μmol· L-1的MPA抑制率分别为17.6%、43.8%,与干扰组相比差异均有统计学意义 (P<0.01),见 Fig 1A。而MPA对Isk-shRNA-PRB组细胞无抑制增殖的作用,高浓度MPA(10μmol· L-1)作用d 3反而促进细胞增殖,促增殖率为17.9% (与空白对照组和阴性对照组相比均有P<0.01),见Fig 1B。
侵袭实验结果显示,Isk-shRNA-PRB组细胞穿过人工基底膜的平均数为101,明显多于阴性对照组(53)和空白对照组(48),差异具有统计学意义(P<0.01),见 Fig 2。
MPA可诱导对孕激素敏感的Ishikawa细胞凋亡,MPA作用48 h,凋亡比例与干扰组比较差异具有统计学意义 (P<0.01),见Fig 3。
2.4 慢病毒感染Ishikawa细胞后PRB蛋白的表达情况及MAPK通路的激活 MPA作用24 h,检测ERK磷酸化情况,结果显示:MPA激活干扰组细胞p-ERK相关的MAPK/ERK信号通路,而空白对照组和阴性对照组ERK磷酸化较弱或无,见Fig 4。
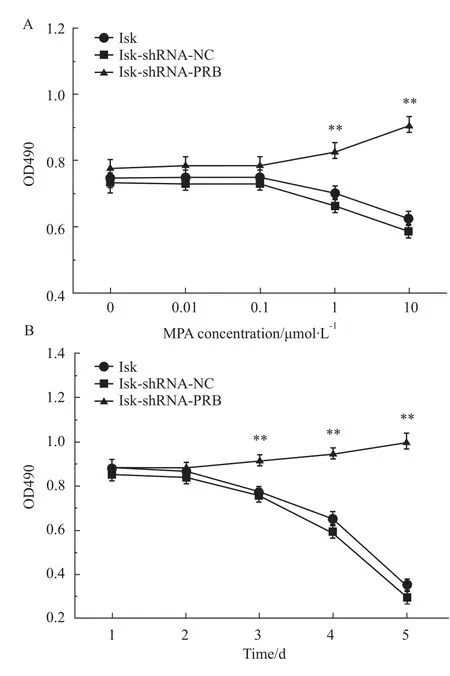
Fig 1 Effects of MPA on proliferative activity and growing abilityA:Effects of different concentrations of MPA on the proliferation of the Isk,Isk-shRNA-NC and Isk-shRNA-PRB cells;B:Effects of MPA(10μmol· L-1)on the growing ability of Isk,Isk-shRNA-NC and IskshRNA-PRB cells.**P<0.01 vs Isk or Isk-shRNA-NC

Fig 2 Effects of MPA on capacity of invasionRepresentative imagesof Transwell invasion assay using10%FBSas chemoattractant showed thatafter treatmentwith MPA(10μmol· L-1)for 24 h,Isk-shRNA-PRB cells increased the capacity of invasion.Statistical data are shown below the figures.**P<0.01 vs Isk or Isk-shRNANC

Fig 3 Effects of MPA on cell apoptosisThe effectson cellapoptosisof Isk,Isk-shRNA-NC and Isk-shRNA-PRB cells,after treatmentwith MPA(10μmol· L-1)for48 h.Statistical data are shown.**P<0.01 vs Isk or Isk-shRNA-NC
3 讨论
目前,肥胖和多囊卵巢综合征越发流行,绝经前女性内膜癌发病率逐年上升,孕激素对该病的防治尤为重要[1]。超过30% 分化良好的Ⅰ型子宫内膜癌患者对孕激素治疗无反应[2],其潜在的机制不甚了解。
孕激素受体(PR)是细胞内受体,属于甾体激素受体超家族的一种结构复杂的蛋白质,其调控众多目标基因的转录[3]。PR具有两种亚型,即PRA和PRB,它们是同一基因经不同启动子转录而来。与PRB相比,PRA在氨基端缺少164个氨基酸,因而PRA和PRB具有不同的活性和功能。研究表明:表观遗传机制如DNA甲基化和组蛋白修饰对调控PRA和PRB总蛋白的表达至关重要[4]。子宫内膜癌细胞从孕激素敏感到耐药存在一种假说:由于编码PRB的DNA发生甲基化,导致PRB表达下降,抑制黏附分子和细胞周期调控蛋白的表达,并促进凋亡抑制蛋白BIRC3的表达,从而促进转移、增殖,抗凋亡。另一项研究表明,子宫内膜癌细胞PRB表达下降很可能是孕激素治疗失败的症结[5]。也有研究提示,PTEN基因与子宫内膜癌细胞耐药密切相关[6]。
大剂量孕激素对分化良好、雌激素受体 (ER)和PR阳性的内膜癌患者反应率高[7]。对于子宫内膜癌细胞,表达内源性或重组PR,孕激素治疗可抑制细胞生长、浸润,同时促进分泌表型的分化和诱导复制性衰老[8]。维持PR表达水平,尤其PRB水平对孕激素的抗肿瘤作用至关重要。有研究表明,孕激素对细胞生长和浸润的抑制作用主要通过PRB的激活[9]。PRB表达水平降低的子宫内膜癌患者通常预后不佳,可能由于MPA耐药所致[9]。本实验将ER、PR阳性,对孕激素抑制作用敏感的人子宫内膜癌Ishikawa细胞进行慢病毒载体构建,干扰PRB表达,结果表明,内膜癌细胞PRB表达下调,对MPA生长抑制作用耐受。
孕激素能够影响耐药细胞的生物学行为。有研究表明,MPA可通过下调CyclinD1、MMP2、MMP9基因的表达,抑制内膜癌细胞增殖及侵袭能力[10]。在孕激素核受体缺失时,孕激素起到有丝分裂原作用,促进肿瘤细胞增殖[11]。本实验结果表明,干扰PRB表达,孕激素促进子宫内膜癌细胞增殖、侵袭,抗凋亡。孕激素对PRB下调后,癌细胞生物学行为影响的作用机制尚无明确认识。一般认为,孕激素通过与其特异性靶细胞结合后刺激分化,可使内膜发生分泌期改变,促使内膜癌细胞分化趋向成熟,细胞发生凋亡和萎缩,抑制肿瘤生长[7]。有研究认为,孕激素可直接作用癌细胞,延缓DNA、RNA的复制,抑制癌细胞生长。还有研究提出,孕激素经PRB介导促进黏附分子表达,如整合素、纤维结合素、钙黏蛋白6,抑制内膜癌细胞迁移、浸润[9]。MAPK通路是将促有丝分裂信号传递到核内,引起细胞增殖分化的主要信号转导系统。激活的ERK1/2与细胞增殖、分化密切相关。pERK1/2进入胞核内,促使cjun、c-fos、c-myc等原癌基因的表达,细胞由G1期进入S期,促进癌细胞恶性增殖。另外,ERK可调节cyclinE,同时灭活细胞周期抑制蛋白P27KIP的表达,从多个水平调控细胞周期。研究报道,ERK可使一些分子发生磷酸化,如转录因子ELK-1、CCAAT增强结合蛋白β、cAMP反应元件结合蛋白,促使Bcl-2抗凋亡因子表达增加[12]。另有研究发现,pERK1/2活性增高与基质金属蛋白酶类的分泌及α6整合素的高表达密切相关,表明ERK1/2可通过蛋白分解调控癌细胞的恶性行为[13]。本研究提示,MPA使PRB下调的子宫内膜癌细胞发生明显的ERK磷酸化,对敏感细胞则ERK磷酸化较弱或无。说明孕激素对PRB下调的Ishikawa细胞存在不通过与PR结合的途径,而是有其他路径激活ERK/MAPK信号通路,促进增殖、侵袭。
综上所述,PRB表达情况与保守治疗的成功率密切相关。研究孕激素作用机制,为解决年轻早期子宫内膜癌患者的生育要求具有一定的临床意义。
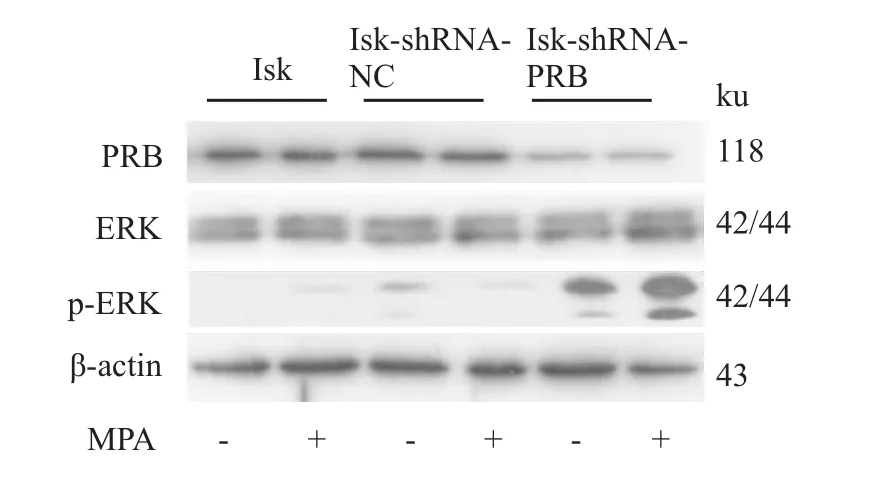
Fig 4 Effects of MPA on phosphorylation of ERK geneDetection of the phosphorylation of ERK gene in Isk,Isk-shRNA-NC and Isk-shRNA-PRB cells,after treatmentwith MPA(10μmol· L-1)for 24 h.
参考文献:
[1] Cade T J,Quinn M A,Rome R M,Neesham D.Long-term outcomes after progestogen treatment for early endometrial cancer[J].Aust N Z JObstet Gynaecol,2013,53(6):566-70.
[2] Kim J J,Chapman-Davis E.Role of progesterone in endometrial cancer[J].Semin Reprod Med,2010,28(1):81-90.
[3] Wetendorf M,DeMayo F J.The progesterone receptor regulates implantation decidualization,and glandular development via a complex paracrine signaling network[J].Mol Cell Endocrinol,2012,357(1-2):108-18.
[4] Yang S,Xiao X,Jia Y,et al.Epigenetic modification restores functional PR expression in endometrial cancer cells[J].Curr Pharm Des,2014,20(11):1874-80.
[5] Janzen DM,RosalesM A,Paik D Y,etal.Progesterone receptor signaling in themicroenvironment of endometrial cancer influences its response to hormonal therapy[J].Cancer Res,2013,73(15):4697-710.
[6] 许成芳,李小毛,李 田,王小韵.紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探讨[J].中国药理学通报,2011,27(11):1528-32.
[6] Xu C F,LiXM,Li T,Wang X Y.The effectof taxol on endome-trial cancer cells with different PTEN status[J].Chin Pharmacol Bull,2011,27(11):1528-32.
[7] 王玉东,艾志宏,罗来敏.保留生殖功能的子宫内膜癌治疗研究进展[J].国际肿瘤学杂志,2007,34(7):535-7.
[7] Wang Y D,Ai ZH,Luo LM.Therapeuticprogress in keeping fertility for endometrial carcinoma[J].J Int Oncol,2007,34(7):535-7.
[8] Smid-Koopman E,Blok L J,Kuhne L C,etal.Distinct functional differences of human progesterone receptors A and B on gene expression and growth regulation in two endometrial carcinoma cell lines[J].JSoc Gynecol Investig,2003,10(1):49-57.
[9] DaiD,Wolf DM,Litman E S,etal.Progesterone inhibits human endometrial cancer cell growth and invasiveness:down-regulation of cellular adhesion molecules through progesterone B receptors[J].Cancer Res,2002,62(3):881-6.
[10]赵书君,程晓军,丰有吉.孕激素的长期作用对子宫内膜癌Ishikawa细胞生物学行为的影响[J].分子细胞生物学报,2007,40(2):103-12.
[10]Zhao S J,Cheng X J,Feng Y J.Influence of long-term treatment with MPA on the biological character of endometrial carcinoma Ishikawa cell[J].JMol Cell Biol,2007,40(2):103-12.
[11]Hanekamp E E,Kuhne LM,Grootegoed JA,et al.Progesterone receptor A and B expression and progestagen treatment in growth and spread of endometrial cancer cells in nudemice[J].Endocr Relat Cancer,2004,11(4):831-41.
[12]Kousteni S,Han L,Chen JR,et al.Kinase-mediated regulation of common transcription factors accounts for the bone-protective effects of sex steroids[J].JClin Invest,2003,111(11):1651-64.
[13]Ahmed N,Pansino F,Baker M,et al.Association between alphavbeta6 integrin expression,elevated p42/44 kDa MAPK,and plasminogen-dependentmatrix degradation in ovarian cancer[J].JCell Biochem,2002,84(4):675-86.