磷浓度对铜绿微囊藻、大型溞和金鱼藻三者相互作用的影响
马剑敏 靳 萍,郭 萌,代克岩,徐婷婷,杨 程,蔺庆伟
(1.河南师范大学生命科学学院,新乡 453007;2.河南省环境污染控制重点实验室,黄淮水环境与污染防治省部共建教育部重点实验室,新乡 453007)
富营养化已成为当今世界普遍面临的水环境问题,它会影响水体中浮游植物和浮游动物种群的变化,从而改变生态系统的结构和功能[1-2]。蓝藻水华的频繁发生是富营养化淡水水体的一个主要表现,如何控制蓝藻水华则成为现今的水体生态环境研究热点[3]。经过多年理论研究和实践达成共识,生态修复是长期有效的控制水华的最佳方式。而生态修复中有两种重要而有效的措施:利用生物操纵[4]和大型水生植物来控制藻类[4-6]。
生物操纵是通过浮游动物的摄食(下行作用),达到直接控制浮游植物的目的。一些研究发现[7-8],以水溞等大型透明溞动物占优势的湖泊中浮游植物生物量和生产力较低。而大型水生植物不仅能与浮游植物竞争营养、光照、空间等资源[9-10],还能分泌化学物质抑制浮游植物的生长[11-12]。两者相辅相成,最终获得良好的抑藻效果。Benndorf最早提出了生物操纵的磷负荷阈值问题[13],但不同学者对磷负荷阈值范围的研究结果并不一致,有人认为该范围为 0.05—0.15 mg/L[14],有人认为是 0.25mg/L[15],因此适用于我国水体的磷浓度条件需要进一步研究。不仅如此,当水体中的磷浓度超过某一限度后,以大型沉水植物为主的清洁型草型稳态就会转化为以浮游植物为主的浑浊型藻型稳态的水生态系统[5]。且生物操纵能否有效和大型沉水植物能否恢复重建这两者之间是有关联的。所以磷浓度阈值是需要研究的关键。而之前我们也对这方面做了一些初步研究[16],但研究尚不完善,有必要进一步研究在富营养化水体中实施生物操纵和恢复大型沉水植物所需的磷浓度。铜绿微囊藻是蓝藻水华中占主要优势的藻类,大型溞是牧食浮游植物的重要浮游动物,因此选择铜绿微囊藻、大型溞和金鱼藻为实验材料,研究不同的磷浓度对三者相互作用的影响,为治理水华和恢复健康水体环境提供更多的理论依据。
1 材料与方法
1.1 实验材料
铜绿微囊藻(Microcystis aeruginosa,FACHB573)购自中国科学院水生生物研究所,保存在BG-11培养基中,培养条件为温度25℃,光暗比14h∶10h,光强2000—3000lx。实验前将其在BG-11培养基中驯化3次后扩大培养。进入对数生长期后,便可作为实验接种藻种。
大型溞(Daphnia magna):实验室内进行纯化培养并进行实验前的驯化(温度 25℃,光强 2000—3000lx,光暗比14h∶10h),使用同一母体繁殖三代以上的出生6—24h的幼龄期大型溞作为实验对象。
金鱼藻(Ceratophyllum demersum):采集于牧野湖,取回实验室后用自来水清洗干净,培养于BG-11培养基中,放在实验室靠窗的实验台上。实验时用蒸馏水清洗3遍,选取生长良好、长势一致的长15cm的顶枝做实验材料。
1.2 培养液的配制
以BG-11培养基[17]为基础,根据之前的预实验配制成11mg/L氮浓度下磷浓度梯度为0.2、0.5、1.0、1.5mg/L的培养液,然后用1mol/L NaOH调节pH到7.5;氮浓度的设置以重富营养化水质为参考,磷浓度则覆盖从中度到重度富营养化水质的范围。所有培养液及器皿均高压灭菌。
1.3 实验方法
1.3.1 接种方法
将经过扩大培养的铜绿微囊藻细胞接种于无氮无磷的BG-11培养液中饥饿培养2d,以去除藻细胞中蓄积的氮、磷,之后倒取适量藻液,4000r/min离心15min,弃去上清液,再用无菌蒸馏水洗涤2次,弃去上清液,以去除吸附性营养,最后稀释成所需的藻细胞浓度。均为无菌操作。
1.3.2 铜绿微囊藻和大型溞共培养
在250mL的锥形瓶中加入150mL BG-11培养液及5个大型溞,然后加入不同体积的铜绿微囊藻藻液,每个铜绿微囊藻密度梯度设3个重复,培养10d,观察大型溞的繁殖情况,以确定最适宜大型溞繁殖的藻细胞密度(表1)。经单因素方差分析,各密度组之间的大型溞数目差异著性(P<0.05);最适宜藻细胞密度为1.48×105个/mL。

表1 大型溞在不同密度的铜绿微囊藻中培养时的数量变化Table 1 The quantitative change of D.magna cultured in different M.aeruginosa density
根据上述实验所确定的适宜的铜绿微囊藻密度,在不同磷浓度梯度培养液的锥形瓶中,加入等量的铜绿微囊藻藻液调节成1.5×105个/mL的藻密度,放入5个形态相似的大型溞,置于光照培养箱内(25±1℃,14h ∶10h,2000—3000lx)培养 15d,每个磷浓度3个重复,每隔3d添加适量培养液。测定铜绿微囊藻密度和大型溞数目、以及各培养液中总氮和总磷的浓度,计算各指标的变化率,以确定不同磷浓度下各指标的变化趋势。
1.3.3 金鱼藻对铜绿微囊藻的化感作用
金鱼藻种植水对铜绿微囊藻的化感作用:在不同磷浓度培养液的1000mL锥形瓶中,加入相同质量的金鱼藻置于培养箱培养15d后,取出金鱼藻,补充与改良的BG-11培养液相同的氮、磷,接种相同密度的铜绿微囊藻后再于培养箱中培养15d(25±1℃,14h ∶10h,2000—3000lx),每个磷浓度设3 个重复,每隔3d添加适量培养液。以同样条件下单独培养的铜绿微囊藻为对照(3个重复)。测定藻细胞密度、以及各培养液中总氮和总磷的浓度,计算各指标的变化率。
金鱼藻与铜绿微囊藻共培养:与上述化感实验条件相同,让金鱼藻和铜绿微囊藻共培养,此外,再增加单独培养的金鱼藻作为对照(3个重复)。测定铜绿微囊藻密度和金鱼藻生物量、以及各培养液中总氮和总磷的浓度,计算各指标的变化率。
1.3.4 铜绿微囊藻、大型溞和金鱼藻三者共培养
在含不同磷浓度培养液的1000mL烧杯中,加入等量的铜绿微囊藻藻液调节成相同的藻密度,然后加入相同重量的金鱼藻和5个形态相似的大型溞,置于培养箱内(25±1℃,14h ∶10h,2000—3000lx)培养15d,每个磷浓度设3个重复,每隔3d添加适量培养液。测定铜绿微囊藻密度、大型溞数目和金鱼藻生物量、以及各培养液中总氮和总磷的浓度,计算各指标的变化率。
1.4 测定指标
铜绿微囊藻细胞密度:在分光度计上扫描铜绿微囊藻的藻液在400—800nm的吸光值,确定铜绿微囊藻最大吸收峰的波长为680nm(图1)。以相同初始条件接种3瓶铜绿微囊藻,培养14d,每隔2d测定1次藻液的吸光值(OD),并用血球计数板计数藻细胞,建立藻细胞密度与吸光值OD间的回归方程:y=119.597x-2.107,式中x为吸光值(OD),y为藻细胞密度(×106个/mL),回归系数 R2=0.993,P<0.05,因此可以用OD值直接反应藻细胞密度。
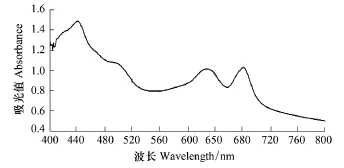
图1 铜绿微囊藻培养液在波长400—800nm下的吸光值扫描图Fig.1 Absorbance scan of M.aeruginosa culture solution on 400—800 nm wavelength
大型溞数目:肉眼计数。
金鱼藻生物量:用吸水纸吸取枝条上的多余水分后,用电子天平称其鲜重。
总氮和总磷浓度:将培养液以4000r/min离心10min,取其上清液,按照标准方法测定[18]。
1.5 数据处理
用spss19.0进行作图及统计分析。
2 结果和分析
2.1 铜绿微囊藻和大型溞共培养
图2显示:磷浓度为0.2mg/L时,铜绿微囊藻密度增加幅度较小,大型溞的增长率大于铜绿微囊藻,培养液较清澈;磷浓度大于0.2mg/L时,铜绿微囊藻密度急剧增加,培养液变为蓝绿色。可见磷浓度为0.2mg/L时,大型溞对铜绿微囊藻具有显著抑制作用(P<0.05);随着磷浓度增高,大型溞对铜绿微囊藻的抑制程度减弱 (P<0.05)。
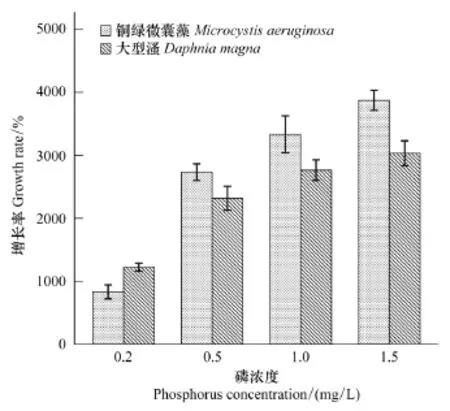
图2 铜绿微囊藻和大型溞共培养时增长率变化情况Fig.2 The change of growth rate of M.aeruginosa and D.magna when they cultured together
2.2 金鱼藻和铜绿微囊藻的相互作用
用金鱼藻种植水培养铜绿微囊藻时(图3),随着磷浓度的升高,铜绿微囊藻的增长率升高,但实验组中铜绿微囊藻的增长率远低于对照组(P<0.05)。磷浓度为0.2mg/L时,实验组的铜绿微囊藻的增长率很低,约为接种值的40%,可见磷浓度越低时金鱼藻种植水对铜绿微囊藻的抑制效果越明显。
金鱼藻与铜绿微囊藻共培养时(图3),随着磷浓度的增高,铜绿微囊藻的增长率逐渐增大,对照和实验组的金鱼藻增长率均逐渐减小,实验组的金鱼藻增长率显著低于对照组(P<0.05),原因是微囊藻与金鱼藻之间存在竞争,甚至存在化感作用。磷浓度为0.2mg/L时,金鱼藻对铜绿微囊藻有较高的抑制作用,铜绿微囊藻的密度比起始降低了20%;磷浓度介于0.5—1.5mg/L时,金鱼藻生物量明显下降,而铜绿微囊藻受到的抑制作用减弱,其密度呈现正增长。对比图3中微囊藻的增长率可以发现,金鱼藻种植水的抑藻效果明显小于两者共培养时的抑藻效果,原因是:后者除了有化感作用外,还有金鱼藻对铜绿微囊藻的竞争作用;此外,也可能是两种条件下金鱼藻分泌的抑藻物质的量有所不同,或抑藻物质进入水环境后随时间延长效力下降所致。

图3 铜绿微囊藻和金鱼藻的增长率变化情况Fig.3 The change of M.aeruginosa and C.demersum growth rate on experiment
2.3 藻-溞-草共培养
结果表明(图4,图5):高氮浓度下,铜绿微囊藻密度一直保持负增长,且随着磷浓度的增大,负增长趋势逐渐增大。说明铜绿微囊藻的种群数量得到了显著抑制(P<0.05)。金鱼藻生物量随磷浓度的升高而减少,磷浓度为0.2mg/L时,其生物量增量显著高于其他3个磷处理组(P<0.05)。大型溞数目随磷浓度的升高而增加,各浓度组之间存在显著差异(P<0.05)。

图4 三者共培养时铜绿微囊藻和金鱼藻的增长率变化Fig.4 The change of M.aeruginosa and C.demersum growth rate when M.aeruginosa,D.magnaand C.demersum cultured together

图5 三者共培养时大型溞的增长率变化情况Fig.5 The change of D.magna growth rate when M.aeruginosa,D.magna and C.demersum cultured together
2.5 不同组合下共培养对培养液中氮磷的去除效果
由图6可见:铜绿微囊藻和大型溞共培养时,4个磷浓度梯度间的除氮效果有显著差异(P<0.05),氮去除率最高为45%;磷平均去除率在50%以上,磷浓度为0.2、0.5mg/L时去除率(约70%—80%)均高于其他两个浓度。化感实验时,磷浓度为0.5mg/L时的氮磷去除效果均高于其他3个浓度。铜绿微囊藻和金鱼藻共培养时,随着磷浓度的升高,磷去除率增大,最高可达到95%;4个磷浓度梯度间的除氮效果有显著差异,对氮的去除率,在1.0mg/L磷浓度下,氮平均去除率均显著高于其他磷浓度下的去除率(P<0.05)。可见,铜绿微囊藻和金鱼藻共存时的氮、磷去除效果和化感实验时的去除效果完全不同。在三者共培养时,磷浓度为0.5mg/L时,对磷的去除率均显著高于其他浓度(P<0.05);随着磷浓度升高,氮去除率增大,4个组之间除氮效果差异显著(P<0.05)。

图6 水中总氮和总磷去除率Fig.6 Theremovalrate change oftotalnitrogen and total phosphorus
3 讨论
本实验清楚地表明了富营养化水体中生物操纵的效果会受到磷浓度以及N/P比的明显影响。磷与铜绿微囊藻的生长关系密切,且水体中的磷浓度易受到人为因素的影响。本研究中,对于0.2、0.5、1.0和1.5mg/L的磷浓度,N/P比分别为55/1、22/1、11/1、7.3/1。实验中,磷浓度升高时,铜绿微囊藻的增长率也随之增大。沈宏等[19]的研究表明,微囊藻对磷的摄取存在积累性,微囊藻的生长取决于藻细胞内的磷浓度。因此随着培养液中磷的不断消耗,细胞内的磷含量增加,而低磷培养液首先出现磷限制,高磷培养液中的铜绿微囊藻密度逐渐超过低磷培养液,铜绿微囊藻的细胞增长率高于低磷培养液。陈国永等[20]也指出细胞内磷增加有利于铜绿微囊藻生长,藻体内的磷对细胞增殖有促进作用。
铜绿微囊藻和大型溞共培养时,两者的种群数量均随磷浓度的升高而增加。磷浓度为0.2mg/L时,铜绿微囊藻的增长相对于其它高磷浓度较为缓慢,且存在大型溞的摄食作用,藻的增长率更加减小,前者的增长率低于后者,因而大型溞在磷浓度为0.2mg/L时占优势。这一结果和有的学者提出的生物操纵在0.05—0.15mg/L的磷浓度时有较好的抑藻效果[14]的结论接近,但范围略大。表明生物操纵的效果的确与水体的磷负荷有密切关系。也直接反映许多学者的研究事实,大型浮游动物的摄食可短期内控制浮游植物生物量,却不能长期有效控制蓝藻水华的急速增加,不能维持生物操纵效果的稳定性和长期性。从氮磷比的角度看,磷的相对缺乏有利于大型溞控制藻。
铜绿微囊藻和金鱼藻共培养时,磷浓度为0.2mg/L(N/P=55/1)时,金鱼藻在竞争中占优势,而铜绿微囊藻的生长受到抑制;当磷浓度大于0.2mg/L(N/P比为22/1—7.3/1)时,随着磷浓度升高,铜绿微囊藻的种群数量增大,而金鱼藻的增长率最低降到初始值的60%。在磷浓度为0.2mg/L时,金鱼藻生长状况最好,表明高磷浓度不利于金鱼藻生长,与王珺等[21]的研究结果一致。原因是营养盐浓度超过金鱼藻抗逆能力时,严重影响金鱼藻的生理活动,对金鱼藻的生长产生胁迫现象,从而使它的抗逆性弱化。而随着磷浓度的升高,铜绿微囊藻增长率增大,是因为磷浓度的增加对藻细胞的增长有促进作用;从氮磷比的角度分析,浮游植物与大型沉水植物竞争时,较高的氮磷比对大型沉水植物有利。金鱼藻的生物量最大时,铜绿微囊藻的生长受到抑制,说明金鱼藻通过对重要生态因子(光、空间、营养等)的竞争、以及向水中释放化感物质[22],从而抑制藻的生长。Scheffer等认为[15],0.25mg/L以内的磷负荷下,浅水湖泊可以通过大型沉水植物固定营养物而维持清洁状态,高于此浓度,浮游植物将会占据优势。
三者共培养时,铜绿微囊藻和大型溞的增长率变化趋势相反。在所有的磷浓度下(N/P比为55/1—7.3/1),铜绿微囊藻均处于负增长状态,金鱼藻和大型溞处于正增长状态,尤其是大型溞的增幅更为明显。表明三者共培养时,铜绿微囊藻始终受到明显的抑制,而大型溞和金鱼藻则一直处于优势。说明在藻-溞系统中,大型沉水植物的加入,可以提高浮游动物枝角类对水华藻类的控制效果。因为大型水生植物为浮游动物提供了良好的栖息场所,水生植物的光合作用,增加水体溶氧量,为浮游动物的生长和繁殖提供足够的氧气;大型沉水植物不仅同浮游植物竞争光照和营养,还可能分泌化感物质,从而抑制浮游植物的生长和发展[22],使水体透明度提高,水质得到改善。反映了生态系统的复杂性和生物多样性的提高,有利于增强大型沉水植物的竞争力和控制水华藻类的效果。生物操纵的开拓者Shapiro认为,生物操纵之后,必须恢复水生植被才能维持清水态湖泊生态系统[23]。许多研究也表明[24-25],大型沉水植物可以有效地降低浅水湖泊中营养物质的含量,从而显著提高富营养水体的水质,对氮、磷污染有明显的净化作用,可维持水体长期稳定于清澈状态。实验中氮磷去除率的结果也证明了这点。
综上可见,生物操纵与水生植被重建同时进行是可以实现的。合理的生物操纵和重建大型水生植物相结合,可以有效的控制浮游植物的过量生长,净化水体。
鉴于上述结论只是在实验室内模拟自然水生态条件下研究的结果,与实际水体的复杂性还有很大的差距,其结论的实际应用效果还有待进一步的验证。
[1]Sanders J G,Cibik S J,Delia C F.Nutrient enrichment studies in a coastalplain estuary:changes in phytoplankton species composition.Canadian Journal of Fisheries and Aquatic Science,1987,44:83-90.
[2]Vitousek P M,Moonek H A,Lubchenko J,Melillo J M.Human domination of Earth’s ecosystems.Science,1997,277:233-239.
[3]Xie P.Sliver carp,blighead carp and alagl water-bloom control.Beijing:Science Press,2003:103-129.
[4]Liu J,Qin Y J,Qiu Y L Pan W B.Advances on biomanipulation in control of eutrophic lakes.Ecologic Science,2005,24(2):188-192.
[5]Qin B Q,Yang L Y,Chen F Z,Zhu G W,Zhang L,Chen Y Y.Mechanism and controltechnology and its application of Eutrophication happen in lake.Chinese Science Bulletin,2006,(16):1857-1866.
[6]Moss B.Engineering and biological approaches to the restoration from the eutrophication of shallow lakes which aquatic plant communities are important components.Hydrobiologia,1991,200/201:367-377.
[7]Sarvala J,Helminen H,Vesa S,Salonen S,Vuorio K.Relations between planktivorous fish abundance zooplankton and phytoplankton in three lakes of differing productivity,Hydrobiologia,1997/1998,363:81-95.
[8]Tonno I,Kunnap H,Noges T.The role of zooplankton grazing in the formation of clear water phase in a shallow charophytedominated lake.Hydrobiologia,2003,506(1/3):353-358.
[9]Yang Q X.Studies on the interaction of submerged plant and phytoplankton in eutrophic waters.Journal of Lake Sciences,1996,(8):17-23.
[10]Zhang Z S.Macrophyte-phytoplankton relationship and lake trophic status.Journal of Lake Sciences,1998,10(4):83-86.
[11]Scheffer M,Berg van den M,Brcukelaar A,Breukers C,Coops H,Doef R,Meijer M L.Vegetated area with clear water in turbid shallow lakes.Aquatic Botany,1991,49:193-196.
[12]Gross E M.Allelopathy of aquatic autotrophs.Critical Reviews in Plant Sciences,2003,22(3&4):313-339.
[13]Benndorf J.Food web manipulation without nutrient control:A useful strategy in lake restoration.Aquatic Sciences,1987,49(2):237-248.
[14]Jørgensen S E and R de Bernardi.The use of structural dynamic models to explain the success and failure of biomanipulation.Hydrobiologia,1998,379:147-158.
[15]Scheffer M,Carpenter S,Foley J A,Folke C,Walker B.Catastrophic shifts in ecosystems.Nature,2001,413:591-596.
[16]Ma S,Wang C L,Zhang Y J,Jiang X Y,Ren S X,Li X Y,Ma J M.Influences ofnitrogen and phosphorus concentration on interactions among Chlorella vugaris,Daphnia magna and Ceratophyllum demersum.Acta Hydrobiologica Sinca,2012,36(1):66-72.
[17]Saito K,Hiroshi Ishii,Nishida F.Purification of microcystins by DEAE and Cl8cartridge chromatography.Toxicon,2002,40(1):97-101.
[18]State environmental protection administration. Water and wastewater monitoring analysis method(The fourth edition).Beijing:China Environmental Science Press,2002:243-257.
[19]Shen H,Song L R,Zhou P J,Liu Y D.Kinetic studies on the effects of organophosphorus presticides on the growth of Microcystis aeruginosa and the uptake of phosphorus forms by Microcystis aeruginosa in Dianchi Lake.Acta Hydrobiologica Sinica,2007,31(6):863-868.
[20]Chen G Y,Yang Z B,Ma Y,Tao M X,Effects of nitrogen and phosphorus on growth of Microcystis aeruginosa strains.Journal of Environment and Health,2007,2(9):675-679.
[21]Wang J,Gu Y F,Zu Z Y,Wu B,Yin D Q.Physiological responses of Ceratophyllum demersum under different nutritional conditions.Chinese Journal of Applied Ecology,2005,16(2):337-340.
[22]Sun Y Y,Xu S Z,Zang J,Wang C H.Growth inhibition of Ceratophyllum demersum on five species ofwater bloom microalgae.Environmental Science & Technology,2012,35(7):1-7.
[23]Blindow I, Anderson G, Hargeby A.Long-term pattern of alternative stable states in two shallow eutrophic lakes.Freshwater Biology,1993,30:159-167.
[24]Hosper S H.Stable states,buffers and switches:an ecosystem approach to the restoration and management of shallow lakes in Netherlands.Wat Sci Tech,1998,37(3):151-164.
[25]Ciurli A,Zuccarini P,Alpi A.Growth and nutrient absorption of two submerged aquaticm acrophytes in m esocosms,for reinsertion in a eutrophicated shallow lake. Wetlands Ecology and Management,2009,17:107-115.
参考文献:
[3]谢平.鲢、鳙与藻类水华控制.北京:科学出版社,2003:103-129.
[4]刘晶,秦玉洁,丘焱伦,潘伟斌.生物操纵理论与技术在富营养化湖泊治理中的应用.生态科学,2005,24(2):188-192.
[5]秦伯强,杨柳燕,陈非洲,朱广伟,张路,陈宜瑜.湖泊富营养化发生机制与控制技术及其应用.科学通报,2006,51(16):1857-1866.
[9]杨清心.富营养化水体中沉水植物与浮游植物藻类相互竞争的研究.湖泊科学,1996,(8):17-23.
[10]章宗涉.水生高等植物-浮游植物关系和湖泊营养状态.湖泊科学,1998,10(4):83-86
[16]马帅,王程丽,张亚捷,蒋昕彧,任韶霞,李效宇,马剑敏.氮磷浓度对藻-溞-草间相互作用的影响.水生生物学报,2012,36(1):66-71.
[18]国家环境保护总局.水和废水监测分析方法(第四版).北京:中国环境科学出版社,2002:243-257.
[19]沈宏,宋立荣,周培疆,刘永定.有机磷农药对滇池微囊藻生长和摄磷效应的影响.水生生物学报,2007,31(6):863-868.
[20]陈国永,杨振波,马昱,陶茂萱.氮和磷对铜绿微囊藻细胞生长的影响.环境与健康杂志.2007,24(9):675-679.
[21]王珺,顾宇飞,朱增银,武斌,尹大强.不同营养状态下金鱼藻的生理响应.应用生态学报,2005,16(2):337-340.
[22]孙颖颖,徐深圳,张静,王长海.金鱼藻对5种水华微藻生长的抑制作用.环境科学与技术,2012,35(7):1-7.
——以武汉紫阳湖为例

