硅切割废砂浆制备硅溶胶及回收碳化硅的工艺研究
王娟,彭倩,丁玉强
(江南大学化学与材料工程学院,江苏无锡 214112)
在集成电路和太阳能电池基板的薄片状产品的制造业中,对高纯度的单晶硅和多晶硅棒进行线性切割过程中,会产生大量的废砂浆。目前硅切割废砂浆的回收方法中,大多以回收聚乙二醇为主[1-2],因而导致大量固体排出,这不仅对环境造成了严重的污染,也造成了资源的大量浪费。近年来也有相关专利报道了废油砂中碳化硅与硅粉的回收[3-6],主要依靠物理方法,实现废砂浆中碳化硅粉和硅粉的回收,但该工艺对高纯硅回收技术不够成熟;对设备要求高、能耗大、不够经济合理;生产中没有准确的废砂浆成分分析方法,导致生产中大量的原料浪费。
目前关于报道纳米 SiO2制备方法有许多[7-9],作者提出采用废砂浆中硅粉一步水解的方法制备硅溶胶。由于本文采用的原料较以往有所区别,且对于制备硅溶胶仍存在实验条件难掌握等问题,故有必要探索精确检测废砂浆含量的方法及制备硅溶胶的条件。作者通过大量研究,确定了废砂浆成分分析方法,并通过单因素及正交实验优化了生产工艺条件,实现了在低成本及高效率的要求下,回收高纯度的碳化硅粉末,也制备了较高浓度的硅溶胶,为工业化回收废油砂提供了可靠依据,并有效地降低碱和机械投入成本,使得操作简单和生产绿色化。
1 实验部分
1.1 试剂与仪器
硫酸、盐酸、氢氧化钠、草酸、六水硫酸亚铁铵、邻菲罗啉、盐酸羟胺、醋酸钠、醋酸、氢氟酸、四水合钼酸铵均为分析纯;某公司硅切割废砂浆回收PEG后的废油砂(主要成分有聚乙二醇、水、碳化硅、硅粉及金属屑);双氧水(质量浓度30%)。
JJ-1型增力搅拌器;TU-1901型双光束紫外可见分光光度计;日立S-4800型场发射扫描电子显微镜。
1.2 硅溶胶制备原理
单质硅溶解法采用碱作为催化剂,通过硅粉和水的反应,首先生成水合硅酸单体,继而单体继续聚合成二元体、三元体,乃至多元体,最后形成硅溶胶。化学反应式如下:
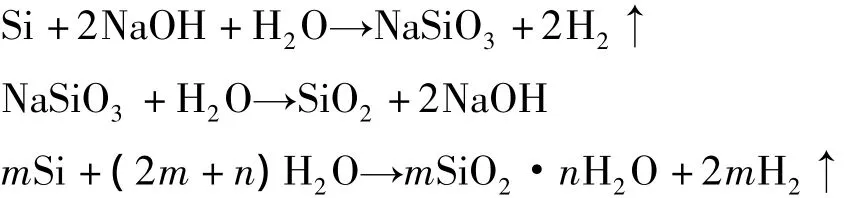
关于硅酸聚合,公认的反应机理为戴安邦教授等提出的硅酸聚合机理[10-11],该机理可解释硅酸分子的线性聚合。在不同的pH条件下,硅酸会按照不同的方式聚合,研究表明SiO2等电点为pH=2,当pH>2时,OH-与硅酸可结合成负一价的硅酸离子,反应如下:
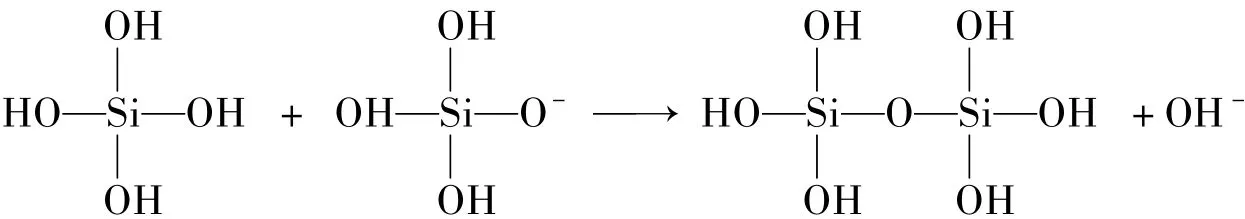
从上述反应可得到硅酸二聚体进一步与负一价的硅酸离子反应生成多硅酸,从而形成硅溶胶。在形成多硅酸时不一定都是直链的,因而碱性条件下的单质硅溶解法,可形成球形SiO2胶体粒子。
1.3 硅溶胶制备方法
将10 g废油砂与30 mL去离子水加入250 mL四口烧瓶中,置于40℃的水浴锅中振荡数分钟,使硅粉活化。加入0.8 g氢氧化钠固体,水浴加热,70℃反应1 h静置数分钟。上层溶液置于离心机进行固液分离,收集的液体即为硅溶胶,采用GB/T 6730.9—2006(硫酸亚铁铵还原-硅钼蓝分光光度法)测定硅溶胶中二氧化硅的含量。固体烘干,并用足量的稀盐酸溶液反应完全,收集的液体可作污水处理使用,烘干的固体即为回收的碳化硅微粉,用SEM观察碳化硅表面前后变化来判断回收的碳化硅质量。
1.4 废油砂成分分析[12]
1.4.1 含水量 精确称取记M的废油砂,在鼓风干燥箱中烘干,称重记M1,利用恒重法测定废油砂中水分含量。
1.4.2 PEG含量 烘干的油砂在过量的丙酮中浸泡数次、固液分离、烘干,称重记M2,利用恒重法测定废油砂中聚乙二醇含量。
1.4.3 Fe含量 上一步烘干的固体加入足量的稀盐酸反应数次,待反应无气泡产生,进行固液分离,并不断用蒸馏水冲洗,至水中无Fe2+,该步液体收集,定容至500 mL,参照GB/T 3049—2006(邻菲罗啉分光光度法)测定铁含量。
1.4.4 Si与SiC含量 反应后的固体继续烘干称重记M3,与足量48%HF+30%H2O2混合液反应数次,用清水洗涤数次,烘干称重记M4。
报道的检测技术对废油砂中铁屑检测误差较大,通过上述实验可得较精确的废油砂成分。

2 结果与讨论
2.1 废油砂成分分析结果
废油砂组分含量见表1。
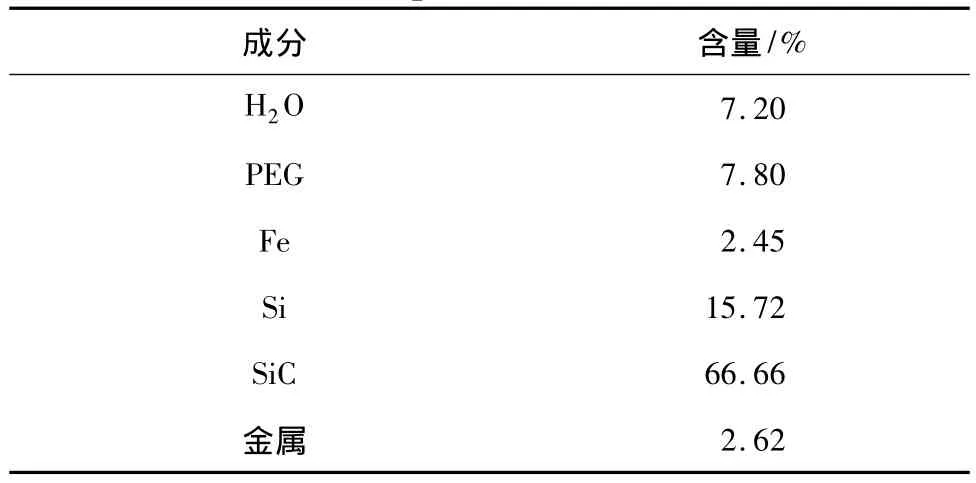
表1 废油砂组分含量Table 1 Component of waste oil sand
由表1可知,废油砂中杂质含量少,硅与碳化硅总含量为82.38%,具有制备硅溶胶与回收碳化硅的经济价值。
2.2 硅溶胶制备的单因素实验
2.2.1 氢氧化钠投加量对硅粉转化率的影响 在制备硅溶胶时,硅溶胶稳定性是一项重要指标,其与pH有着密切关系。当硅溶胶 pH在8.5~10.5,硅溶胶的稳定性和储存性最好,因为该范围内SiO2粒子表面所带电荷密度大,粒子间斥力作用占主导地位,可以达到长期稳定状态,故在制备硅溶胶过程中需要精确控制碱加入量。
在硅粉投加量为10.0 g、蒸馏水30 mL、反应温度为70℃、反应时间为1 h、硅粉活化时间25 min的实验条件下,硅粉转化率随碱加入量变化见图1。
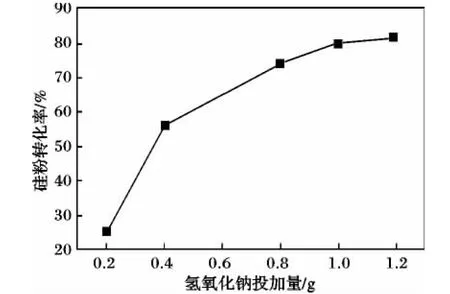
图1 氢氧化钠投加量对硅粉转化率的影响Fig.1 Influence of sodium hydroxide amount to Si conversion rate
由图1可知,随着碱加入量增加,硅粉转化率增大,但碱投入量超过1.0 g后,硅粉转化率增速减缓,因为当碱加入量增大,体系pH升高,使得硅粉转化率增大,产生的硅酸量增多,硅酸的量增加又会抑制硅粉水解,因此后来硅粉转化率增大变缓慢。测得制备的硅溶胶pH范围在8.0~10.7,达到工业中对硅溶胶pH的要求。
2.2.2 反应温度对硅粉转化率的影响 在硅粉投加量为10.0 g、蒸馏水30 mL、氢氧化钠投量加为0.8 g、反应时间为1 h、硅粉活化时间25 min的实验条件下,硅粉转化率随反应温度变化见图2。
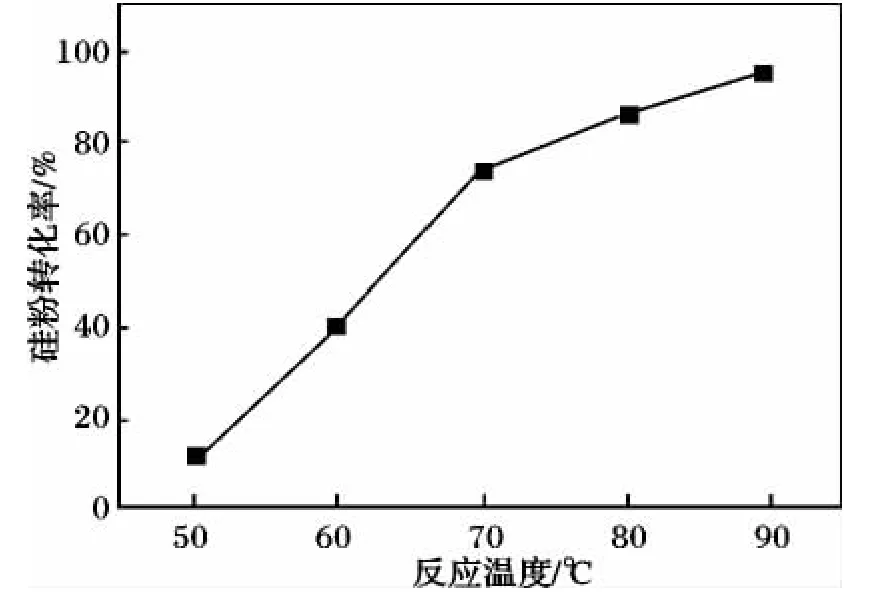
图2 反应温度对硅粉转化率的影响Fig.2 Influence of reaction temperature to Si conversion rate
由图2可知,反应温度70~90℃时,硅粉转化率高,并当反应温度达到90℃,硅粉转化率可达96.10%。温度高于90℃时会反应过于剧烈,不易控制,故温度范围应在70~90℃。
2.2.3 硅粉活化时间和反应时间对硅粉转化率的影响 在硅粉投加量为10.0 g、蒸馏水30 mL、氢氧化钠投加量为0.8 g、反应时间为1 h,分别改变硅粉活化时间和反应时间进行实验。结果表明,硅粉活化时间长短对硅粉转化率的影响不大;反应时间超过2 h后,硅粉的转化率增速不明显。实验对反应6 h后回收的液体和固体进行二氧化硅含量测定和SEM表征发现:在反应5 h后,随着时间的增加,硅溶胶中二氧化硅含量逐渐降低;且反应生成的二氧化硅会大量吸附在碳化硅表面,导致回收的碳化硅纯度降低。
2.3 硅溶胶制备的正交实验
在废油砂及蒸馏水的加入量不变的情况下,对反应时间、反应温度、硅粉活化时间及碱加入量对硅粉转化率的影响进行正交实验,因素水平见表2,结果见表3。
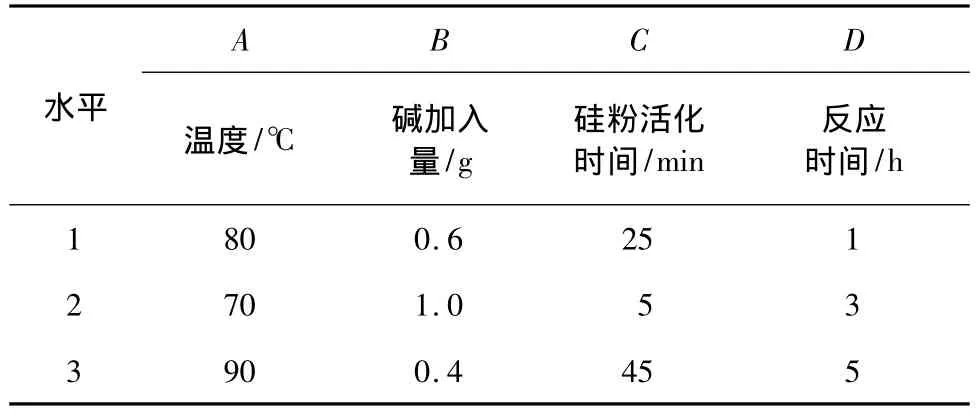
表2 因素和水平表Table 2 Factors and levels
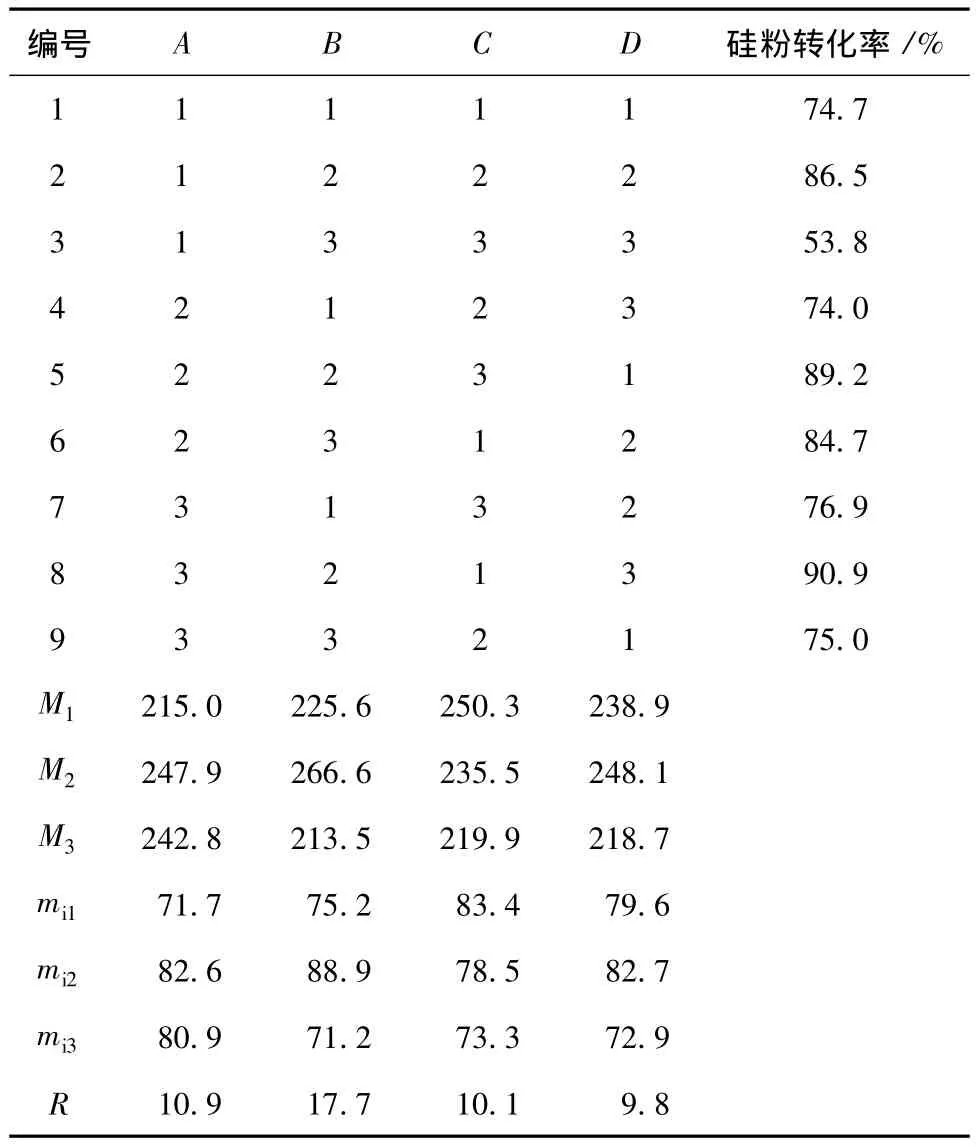
表3 正交实验结果分析Table 3 Result of orthogonal test
由表3可知,对硅粉转化率影响次序为:碱加入量>反应温度>硅粉活化时间>反应时间,反应温度选择:参考单因素中温度对硅粉转化率的影响可知,温度升高可提高硅粉转化率及缩短反应时间,且正交表中 M12及 M13值相差较小,故反应温度为90℃;碱投加量选择:考虑生产过程中碱投加成本及合成硅溶胶pH不宜过高,且正交表中M21及M22值相差不大,故碱投加量应为0.6 g;硅粉活化和反应时间选择:由于生产反应的总时间不宜过长,且M31、M32和 M41、M42相差较小,故硅粉活化和反应时间应为5 min和1 h。因此,制备硅溶胶最宜的条件为:反应温度90℃,硅粉活化时间5 min,反应时间1 h,废油砂∶蒸馏水∶碱 =10∶30∶0.6(质量比)。在最佳实验条件下,硅粉转化率可达90%,硅溶胶中二氧化硅含量达95.8 g/L。
上述最佳条件下,碳化硅微粉回收前后表面的变化情况见图3。

图3 碳化硅反应前后的SEMFig.3 SEM figure of SiC before and after reaction
由图3可知,碳化硅颗粒较硅粉粒径大许多;废砂浆中硅粉分布均匀,且含量较多,大多的硅粉屑覆盖在碳化硅表面;回收的碳化硅微粉表面没有明显的铁屑、硅粉及二氧化硅吸附,碳化硅纯度达96%,达到GB/T 2480—2008《普通磨料碳化硅》中对碳化硅纯度的要求。
3 结论
(1)提出了一种废砂浆成分分析方法,并测出废油砂中硅与碳化硅总含量为82.38%,说明了该类废油砂具有很好的回收利用价值。该方法也为工业提供了评估废油砂开发价值一种经济、精确的检测方法。
(2)废油砂制备硅溶胶的最佳条件为:反应温度90℃,硅粉活化时间5 min,反应时间1 h,废油砂∶蒸馏水∶碱 =10∶30∶0.6(质量比)。在该条件下制备得到的硅溶胶中,二氧化硅浓度达95.8 g/L,pH为10.21,能够达到市场的应用要求。
(3)在上述最佳实验条件下,能回收到表面几乎没有铁屑、硅粉和二氧化硅吸附的碳化硅,其纯度可达96%,达到 GB/T 2480—2008《普通磨料碳化硅》中对碳化硅纯度的要求。
[1]Zavatttari C,Fragiacomo G.Method for the seperation,regeneration and reuse of the exhausted glyeol-based slurry:US,6231628,Bl[P].2001-05-15.
[2]Zavatttari C,Fragiaeomo G,Portaluppi E.Method for treating an exhausted glyeol-based slurry:US,7223344B2[P].2007-05-02.
[3]杨建峰,高积强,陈畅,等.一种从切割废砂浆中回收硅粉和碳化硅粉的方法:CN,100118636.9[P].2009-08-19.
[4]Billet R L,Nguyen H T.MEMS and MEMS components from silicon kerf:US,6828047[P].2005-01-04.
[5]Wang T Y,Lin Y C,Tai C Y,et al.A novel approach for recycling loss silicon form cutting slurry waste for solar cell applications[J].J Cryst Growth,2008,310(15):3403.
[6]Kapur V K,Khanna A K,Khanna.Process for recovery of high purity silicon;US,438-8080[P].1983-06-14.
[7]Arrigada F J,Osseo-Asare K.Synthesis of nanosize silica in a nonionic water-in-oil microemulsion:Effects of the water/surfactant molar ratio and ammonia concentration[J].Journal of Colloid and Interface Science,1999,211(2):210-220.
[8]Choi J Y,Kim C H,Kim D K.Formation and characterization of monodisperse,spherical organo-silica powders from organo-alkoxysilane-water system[J].Journal of the A-merican Ceramic Society,1998,81(5):1184-1188.
[9]许念强,顾建祥,罗康,等.大粒径、高浓度硅溶胶的制备新方法[J].化工进展,2005,24(8):925-929.
[10]王金晞,陈荣三,郭腊梅,等.硅酸及其盐的研究—X—Ⅷ.硅溶胶胶粒的生长[J].无机化学学报,1985,1(2):250-254.
[11]朱屯,钱保华,陈荣三,等.硅酸及其盐的研究X.单硅酸聚合反应动力学[J].化学学报,1981,39(1):1-11.
[12]Lin Y C,Tai C Y.Recovery of silicon powder from kerfs loss slurry using phase-transfer separation method[J].Separation and Purification Technology,2010,74(2):170-177.

