雷公藤甲素诱导鼻咽癌细胞凋亡作用
王 秀,张竞竞,张 配,孙小锦,刘 哲,张鑫宇,刘 浩
雷公藤甲素(triptolide,TPL)又称雷公藤内酯、雷公藤内酯醇,是从卫矛科雷公藤属植物中分离的一种环氧二帖类内酯化合物,是治疗类风湿病雷公藤片和雷公藤多苷片等制剂的主要有效成分[1]。现代研究表明,雷公藤甲素不仅具有高效的抗炎、抗类风湿作用,还具有较强的抗肿瘤作用。研究发现,其对某些肿瘤细胞的杀伤毒性甚至高于紫杉醇和阿霉素[2-3]。但在鼻咽癌中的研究较少,本文拟将雷公藤甲素作用于鼻咽癌CNE-2Z细胞株,观察其抗鼻咽癌的作用,并探讨作用的机制。
1 材料与方法
1.1 试剂 雷公藤甲素(天津美伦医药集团);CNE-2Z细胞株,蚌埠医学院药学系生化药理实验中心提供;RPMI 1640培养基(Gibco公司);兔抗人GRP78、Akt、pAkt抗体、鼠抗人 β-actin抗体购自Santa Cruz公司;山羊抗鼠 IgG、山羊抗兔 IgG购自北京中杉金桥生物技术有限公司;ROS荧光探针-DHE(威格拉斯生物技术有限公司)。
1.2 方法
1.2.1 药液配制 雷公藤甲素用二甲基亚砜(DMSO)配成 5.5 mmol·L-1贮液,-20℃保存。临用前以 RPMI 1640培养基稀释成 62.5、125、250、500、1 000、2 000及 4 000 nmol·L-1。
1.2.2 细胞培养 CNE-2Z细胞接种于含10%新生小牛血清、青霉素(1×105U·L-1)、链霉素(100 mg·L-1)和 NaHCO3(33.7 mg·L-1)的 RPMI 1640培养液中,体积分数0.05 CO2、饱和湿度、37℃培养箱中培养,每2~3天传代1次。
1.2.3 MTT测定细胞的增殖活性 细胞接种于96孔细胞培养板中,5×103个每孔。培养24 h,吸弃培养液,加新鲜含10%血清培养液180μl,对照组加入含0.01%DMSO的培养液20μl;药物处理组加入不同浓度的雷公藤甲素溶液各20μl,使终浓度分别为 6.25、12.5、25、50、100、200及 400 nmol·L-1,其中DMSO含量不超过0.01%;同时设立调零组(无细胞组),加入200μl培养液。培养12、24、48 h后加入20μl MTT(以 PBS配成5 g·L-1),37℃继续培养4 h,弃上清,每孔加入150μl DMSO,37℃孵育30 min,酶标仪上振荡10 min,检测波长570 nm处吸光度(A)值,计算细胞存活率:细胞存活率/%=(实验组A值-调零组A值)/(对照组A值-调零组A值)×100%。以上实验重复3次。
1.2.4 PI单染法测定雷公藤甲素对CNE-2Z细胞凋亡的影响 细胞接种于6孔培养板,5×106个每孔,培养24 h后,加药处理,使雷公藤甲素的终浓度为 25、50、100 nmol·L-1,继续培养 24 h,显微镜下观察各处理组细胞的变化并拍照,收集细胞,2 500 r·min-1,离心5 min,洗涤2次;预冷的体积分数为0.75乙醇固定,4℃过夜。测试前用PBS溶液洗涤2遍,加 PI缓冲液(5 mg PI、0.1 g NaC6H5、100μl Triton-100、100μl ddH2O)300μl每管,避光染色30 min,流式细胞仪检测。
1.2.5 Western blot测定雷公藤甲素对CNE-2Z细胞内GRP-78、Akt的表达及Akt磷酸化的影响 将指数生长的CNE-2Z细胞胰酶消化、悬浮、计数,调节细胞浓度为3×108个·L-1,接种于6孔培养板,每孔2 ml,贴壁培养24 h,弃培养液,加药处理24 h后冰上提取细胞全蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳,转膜;封闭2 h,加一抗,4℃ 孵育过夜;洗膜后加二抗,室温孵育2 h;Immobilon Western Chemiluminescent HRP Substrate试剂盒用Bio-Rad凝胶成像系统获取图像。
1.2.6 雷公藤甲素对CNE-2Z细胞内活性氧水平的影响 ROS荧光探针-二氢乙啶(dihydroethidium,DHE),可自由透过活细胞膜进入细胞内,并被细胞内的ROS氧化,形成氧化乙啶。氧化乙啶可参入染色体DNA中,产生红色荧光。根据活细胞中红色荧光的产生,可以判断细胞ROS含量的多少和变化。将贴壁生长的CNE-2Z细胞用胰酶消化、悬浮,以5×106个每孔接种于6孔培养板,贴壁生长24 h,弃培养液,给药处理4 h,加入二氢乙啶使其终浓度为5μmol·L-1,37℃避光孵育 1 h,弃培养液,冰冷 PBS洗 3遍,胰酶消化,离心(800 r·min-1,5 min),收集细胞,用1 ml冰冷PBS重悬细胞,流式细胞仪测定,采用480~535 nm波长激发,590 nm~610 nm以上的发射,细胞可分成两个亚群:ROS阴性细胞仅有很低的荧光强度,ROS阳性细胞有较强的红色荧光。
2 结果
2.1 雷公藤甲素对鼻咽癌细胞CNE-2Z的抑制作用 MTT结果显示,雷公藤甲素对鼻咽癌细胞CNE-2Z具有较强的抑制作用,并且这种抑制作用随着浓度的增加及作用时间的延长而增强,见Fig 1。25、50和100 nmol·L-1雷公藤甲素处理 CNE-2Z细胞48 h后,镜下清晰可见随着浓度的增加漂浮细胞增加,细胞密度降低,见Fig 2。
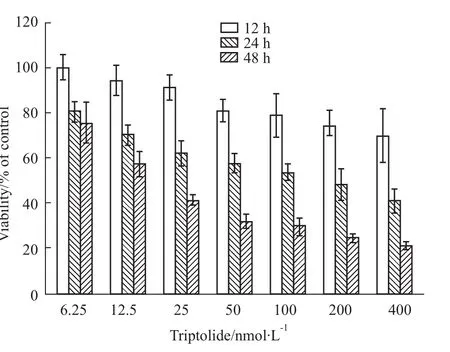
Fig 1 Triptolide inhibits proliferation of CNE-2Z cells
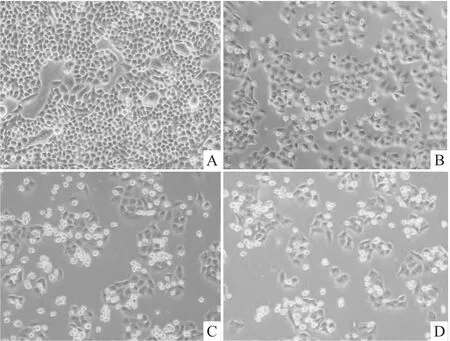
Fig 2 The morphological change of CNE-2Z cells after triptolide treatment
2.2 雷公藤甲素对鼻咽癌细胞CNE-2Z凋亡的影响 由 Fig 3可见,25、50和 100 nmol·L-1的雷公藤甲素作用CNE-2Z细胞24 h,均可引起CNE-2Z细胞的凋亡,其中100 nmol·L-1组的凋亡率达到了34.4%,占到整个抑制率46.2%的74%。
2.3 雷公藤甲素对CNE-2Z细胞内GRP78、Akt、p Akt的影响 实验结果表明,雷公藤甲素作用CNE-2Z细胞24 h后,对细胞内GRP-78蛋白的表达无明显影响,但可明显减少Akt的表达及其磷酸化水平,见Fig 4。
2.4 雷公藤甲素对CNE-2Z细胞内ROS水平的影响 活性氧实验表明,不同浓度的雷公藤甲素均能诱导鼻咽癌细胞CNE-2Z产生氧化应激。由Fig 5可见,随着雷公藤甲素浓度的升高,CNE-2Z细胞内ROS水平增加。
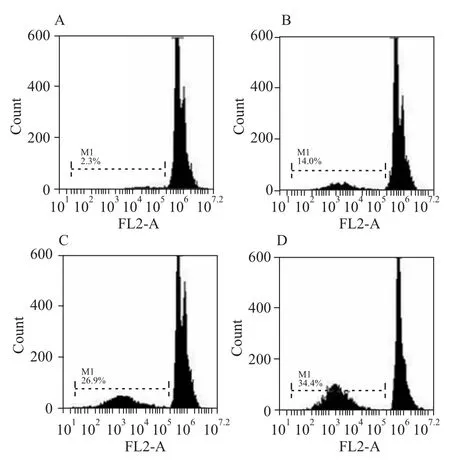
Fig 3 Triptolide induces apoptosis of CNE-2Z cells
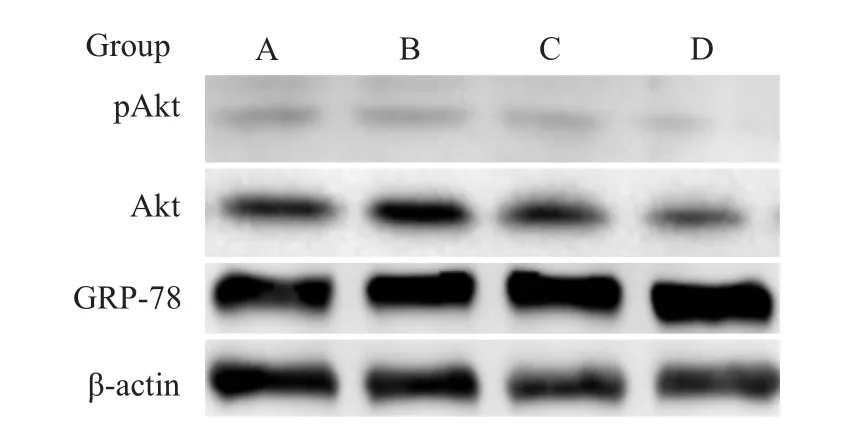
Fig 4 Effect of triptolide on expression of GRP-78,Akt and pAkt
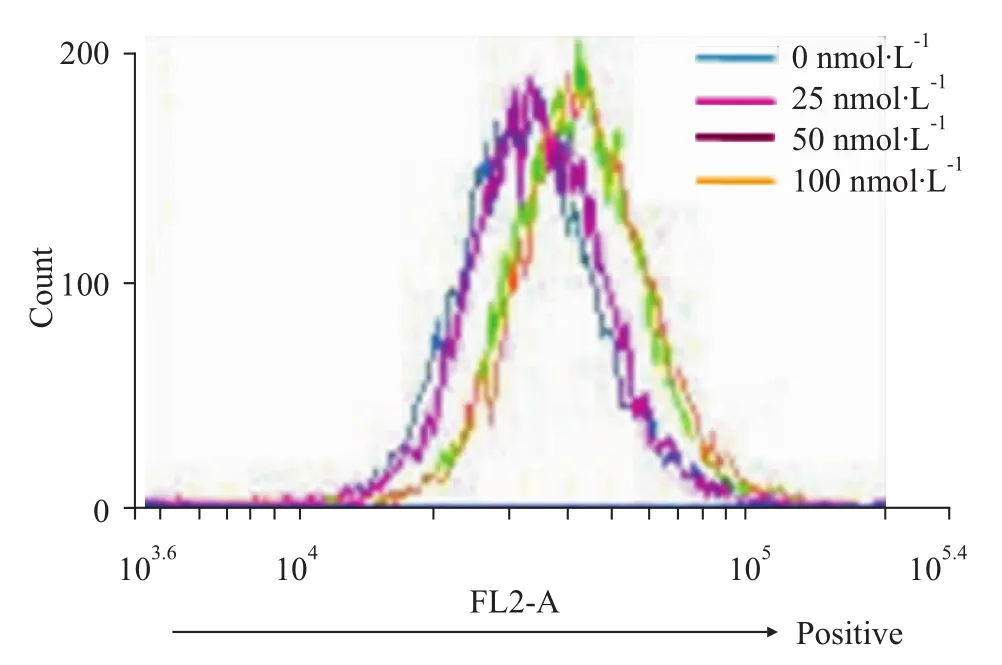
Fig 5 Reactive oxygen species level elevated in CNE-2Z cells
3 讨论
雷公藤甲素具有广谱、高效的抗肿瘤作用,对急性白血病、卵巢癌、肝癌、黑色素瘤、乳腺癌等都有较高活性[4-5]。研究表明,其高效的抗肿瘤作用主要通过诱导肿瘤细胞凋亡实现[6-7],但其诱导肿瘤细胞凋亡的机制目前尚不清楚。实验发现,雷公藤甲素对鼻咽癌也具有较强的抑制作用,同样通过诱导鼻咽癌细胞凋亡实现。其诱导细胞凋亡的作用可能与其诱导氧化应激,升高活性氧(reactive oxygen species,ROS)水平,及抑制 Akt有关。
ROS由超氧离子、过氧化氢和羟自由基组成,是细胞代谢的副产品。ROS水平对细胞生死有着重要的影响。生理情况下的ROS量小,作为信号传导分子参与调解细胞的生理活动[8]。轻度氧化应激,ROS水平轻度升高,可促进细胞存活、增殖、分化等适应性变化;重度氧化应激可使ROS剧烈增加,则造成细胞增殖阻滞、衰老、凋亡和坏死等损伤性变化[9]。肿瘤组织由于高代谢、低氧、缺血等,会持续诱发氧化应激,使肿瘤组织内ROS升高,促进肿瘤细胞的存活、增殖、侵袭、转移等。但若肿瘤细胞内ROS水平进一步升高,则抑制肿瘤细胞的增殖,促进细胞的凋亡。肿瘤治疗药物诱导细胞凋亡部分与生成内源性氧化剂有关[10]。易静等[11]研究表明,肿瘤细胞内的ROS水平,决定了细胞对凋亡的敏感性。实验中细胞内ROS水平及细胞凋亡率随着雷公藤甲素浓度的增加而升高,说明细胞的凋亡与雷公藤甲素诱导氧化应激,产生较高水平的ROS有关。
Akt是原癌基因c-Akt的表达产物,又称蛋白激酶B,在细胞凋亡、细胞增殖、细胞分化、生理代谢、衰老及疾病和癌症等细胞生理病理活动的调控中起着至关重要的作用。当细胞面临氧化损伤时,PI3K/Akt通路的活化对细胞存活非常重要。研究[12]发现,激活Akt能保护细胞免受H2O2的损伤。反之,若Akt的活化受到抑制,细胞就失去了保护,在氧化应激的刺激下,细胞发生损伤,进而凋亡。实验表明,雷公藤甲素可抑制Akt的表达及磷酸化,这一作用可能是雷公藤甲素诱导鼻咽癌细胞CNE-2Z凋亡的主要原因。
总之,雷公藤甲素能够通过诱导细胞凋亡,抑制鼻咽癌细胞CNE-2Z的生长,作用的机制可能与其诱导氧化应激及抑制Akt的表达及活化有关,具体机制有待于进一步的研究。
参考文献:
[1] 李学林,王 璟,唐进法,等.雷公藤多苷片联合用药减毒作用的研究进展[J].中国现代药物应用,2013,7(9):189-90.
[1] Li X L,Wang J,Tang JF,et al.The development of reducing tox-icity on tripterygium glycosides tablet combination[J].Chin J Mod Med Applicat,2013,7(9):189-90.
[2] Yang S.Triptolide inhibits the growth and metastasis of solid tumors[J].Mol Cancer Ther,2003,2(1):65-72.
[3] Li H.Modulation of P-glycoprotein expression by triptolide in adriamycin-resistant K562/A02 cells[J].Oncol Lett,2012,3(2):485-9.
[4] 王 丽,宋 勇.雷公藤内酯醇与非小细胞肺癌研究进展[J].中国肺癌杂志,2013,16(7):378-81.
[4] Wang L,Song Y.Advances on effects of triptolide with non-small cell lung cancer[J].Zhongguo Fei Ai Za Zhi,2013,16(7):378-81.
[5] Lin Y.Herbal compound triptolide synergistically enhanced antitumor activity of amino-terminal fragment of urokinase[J].Mol Cancer,2013,12(54):1-16.
[6] Zhao F.Triptolide induces growth inhibition and apoptosis of human laryngocarcinoma cells by enhancing p53 activities and suppressing E6-mediated p53 degradation[J].PLoS One,2013,8(11):80784.
[7] Rousalova I.Minnelide:a novel therapeutic that promotes apoptosis in non-small cell lung carcinoma in vivo[J].PLoSOne,2013,8(10):77411.
[8] 周映彤,肖洪彬,毕明刚.活性氧与内质网应激[J].中国药理学通报,2011,27(5):597-600.
[8] Zhou Y T,Xiao H B,Bi M G.ROS and endoplasmic reticulum stress[J].Chin Pharmacol Bull,2011,27(5):597-600.
[9] Fruehauf JP,Meyskens F L Jr.Reactive oxygen species:a breath of life or death?[J].Clin Cancer Res,2007,13(3):789-94.
[10]Maiti A K.Genetic determinants of oxidative stress-mediated sensitization of drug-resistant cancer cells[J].Int J Cancer,2012,130(1):1-9.
[11]易 静,杨 洁.活性氧调控蛋白质修饰影响肿瘤细胞行为机制的研究进展[J].上海交通大学学报(医学版),2012,32(9):1122-7.
[11]Yi J,Yang J.Study on the mechanisms underlying that reactive oxygen species regulate posttranslational modification of the proteins and affect the behaviors of cancer cells[J].J Shanghai Jiaotong Univ(Med Sci),2012,32(9):1122-7.
[12]张 梅,李 卫,郭瑞鲜,等.PI3K/AKT通路介导H2O2预处理减轻PC12细胞氧化损伤[J].基础医学与临床,2011,31(8):894-9.
[12]Zhang M,Li W,Guo R X,et al.PI3K/AKT pathway mediates the anti-oxidative injury induced by H2O2preconditioning in PC12 cell[J].Basic Clin Med,2011,31(8):894-9.

